RCCS模拟微重力对铜绿假单胞菌莫西沙星敏感度的影响
黄玉玲 易 勇 杨建武 江文俊 贾莉萍 杨鹤鸣 周金莲 崔 彦 徐冰心
随着航天事业的迅猛发展,太空感染问题亟待深入研究。随宇航员和太空飞行器进入太空的微生物,在失重环境下其生物学性状发生变化,时刻威胁着宇航员的健康及飞行器的安全[1,2]。铜绿假单胞菌(Pseudomonas aeruginos)是一种常见的条件性致病菌,阿波罗13号宇宙飞船执行任务过程中,曾有宇航员发生铜绿假单胞菌引起的泌尿系统感染[3]。Crabbé等[4,5]通过模拟微重力和飞船搭载菌株研究发现,铜绿假单胞菌藻酸盐、弹性蛋白酶、鼠李糖脂产生增加,其中铜绿假单胞菌POA1菌株有330种基因表达水平高于对照组1.5倍以上,涉及多种应激反应蛋白的合成、致病因子的表达、各种生理代谢的物质合成等。目前尚无微重力环境下铜绿假单胞菌药物敏感度方面的研究报道。本研究采用三维细胞培养系统(rotary cell culture system,RCCS)研究模拟微重力环境对铜绿假单胞菌莫西沙星敏感度的影响,旨在为航天员的医监医保提供参考依据。
材料与方法
1.主要试剂和仪器:铜绿假单胞菌ATCC 27853(中国普通微生物菌种保藏管理中心),LB培养基和MH肉汤培养基(北京奥博星生物技术有限责任公司),盐酸莫西沙星注射液(拜耳医药保健有限公司),莫西沙星药敏纸片(北京天坛药物生物技术开发公司),SYTO-9(美国Sigma公司),PI(美国Sigma公司),全温震荡培养箱(太仓市实验设备厂),RCCS(美国Synthecon公司),恒温恒湿培养箱(黄石市恒丰医疗器械有限公司),浊度计(法国生物梅里埃公司),FACS Calibur型流式细胞仪(美国BD公司)。
2.实验分组和模拟微重力细菌培养:参照文献[3~5],将铜绿假单胞菌ATCC 27853划线接种于血平板上,37℃过夜培养;取单一菌落,接种于新鲜LB液体培养基中,220r/min过夜培养。取50μl过夜菌悬液接种于5ml新鲜LB培养基中,振荡培养至对数生长期,新鲜LB培养基调整菌液终浓度为103。新鲜LB培养基浸洗细胞培养瓶10min,弃废液;菌液加注到50ml培养瓶中,排空气泡。将培养瓶安置于RCCS上,实验组(模拟微重力组)培养瓶轴心与地面平行,对照组(地面重力组)培养瓶轴心与地面垂直,详见图1。于25r/min、37℃下持续培养;每24h更换培养基,过程中注意严格无菌操作,分别于培养第1、7、14天取实验组和对照组适量菌液,检测莫西沙星药物敏感度。
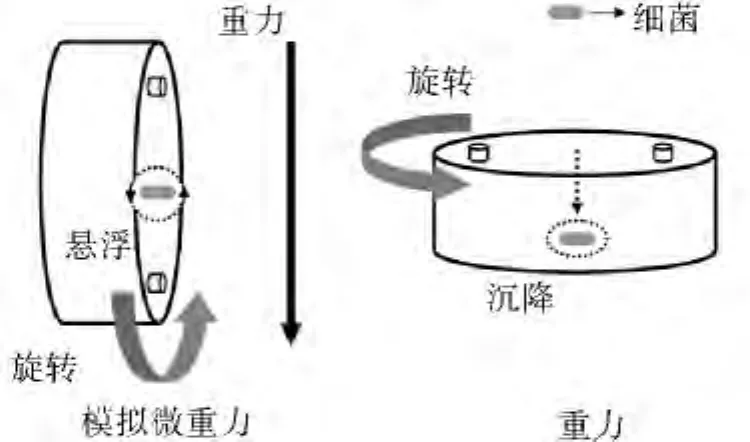
图1 RCCS模拟微重力环境及重力环境的实现
3.肉汤稀释法检测最低抑菌浓度(minimum inhibitory concentration,MIC):用试管二倍稀释法测定莫西沙星对实验组和对照组铜绿假单胞菌ATCC 27853的MIC,操作规范参照CLSI(M100-S22,2012)标准[6]。
4.K-B纸片法检测抑菌环直径:0.5麦氏单位菌悬液用无菌棉拭均匀涂布于M-H培养基,贴莫西沙星药敏纸片后置37℃孵箱培养24h,精确量取抑菌环直径。
5.流式细胞仪检测活菌比例:(1)门设定:取1ml菌液,M-H肉汤稀释成浓度为0.5麦氏单位的菌液(菌液浓度为1.5×108CFU/ml),再用MH肉汤稀释20倍,菌液终浓度为7.5×106CFU/ml;取2ml菌液4℃离心4000r/min×2min,加入等体积70%乙醇,重悬菌体;处理10min,4℃离心4000r/min×2min,收集死菌,等体积 PBS重悬;取 2ml菌液,4℃离心4000r/min×2min,收集活菌,等体积PBS重悬;根据死菌及活菌按1∶0、1∶1、0∶1 比例,混合染色后流式细胞仪检测,采集104个菌细胞,在设计的测定方案中,以前散射光/侧散射光(FS/SS)直方图横坐标和纵坐标为对数值,调节FS/SS电压,在此图中寻找细菌最集中的区域,设门并对门设置的正确性进行验证,保存数据。(2)各药物浓度下活菌比例检测:参照文献[7,8],取适量菌液,新鲜MH肉汤调整菌液浓度为0.5麦氏单位的菌液(菌液浓度为1.5×108CFU/ml);加入莫西沙星注射液,使药物终浓度分别为 64、32、16、8、4、2、1、0.5、0.25 和0.125μg/ml,菌液终浓度为 7.5 × 106CFU/ml,37℃孵育3h;4℃离心4000r/min×2min,收集菌体,PBS重悬菌体,参照试剂说明书,分别加入SYTO-9和PI染液,使其终浓度为分别为1.67和30μmol/L,标记后混匀,4℃共同避光孵育15min,流式细胞仪上机检测,同时做阳性对照(乙醇杀死菌悬液)、阴性对照(不加药的菌悬液),测定各药物浓度下活菌比例。
6.统计学方法:采用SPSS 17.0统计软件进行数据分析,数据用均数±标准差()表示,多个样本的比较采用方差分析,组间两两比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1.最低抑菌浓度:各时相点实验组和对照组莫西沙星对铜绿假单胞菌ATCC 27853的最低抑菌浓度均为 0.25μg/ml。
2.抑菌环直径:结果表明,实验组莫西沙星对铜绿假单胞菌ATCC 27853的抑菌环直径均大于对照组,1、7、14天实验组与对照组抑菌环直径比值分别1.08±0.01、1.12±0.01和1.16±0.01,各时相点差异均有统计学意义(P<0.05)。随模拟微重力时相延长,与对照组相比,实验组抑菌环直径逐渐延长(P<0.05)。
3.门设定及死活菌检测结果:铜绿假单胞菌ATCC 27853 死菌及活菌按 1∶0、1∶1、0∶1 比例,混合染色后流式细胞仪检测,门设定和直方图结果见图2。
4.各药物浓度下活菌比例:实验组各药物浓度下活菌比例均小于对照组,且同一药物浓度下,实验组活菌比例与模拟微重力时相呈负相关趋势(P<0.05,图 3)。
讨 论

图2 流式细胞仪药敏实验门设定及死活菌直方图
近年来,对微重力环境下致病菌的抗生素敏感度变化日益受到关注[9]。铜绿假单胞菌是人体常见的条件致病菌之一,是一种致病力较低但抗药性强的革兰阴性杆菌。值得重视的是,在“和平号”空间站和国际空间站上均分离到铜绿假单胞菌等多种细菌[3,10]。
RCCS是研究模拟微重力环境下微生物性状变化的一种主要方法。该系统是培养贴壁和悬浮细胞的装置,是一种绕水平轴旋转、充满液体、通过气液两相膜进行气体交换的圆柱形旋转壁式生物反应器,其培养室旋转带动容器内培养液和培养物一起做旋转运动,通过调整旋转速度可实现培养液和培养物与容器壁同步旋转。培养物在水平轴上建立了近似均质液体的悬浮轨道,重力向量持续随机分布,使培养物维持在连续的自由落体状态,作用于细胞的表观重力下降,从而在地面上模拟了实验所需的类似太空的微重力环境,同时在垂直轴上则可以创造重力环境[11]。
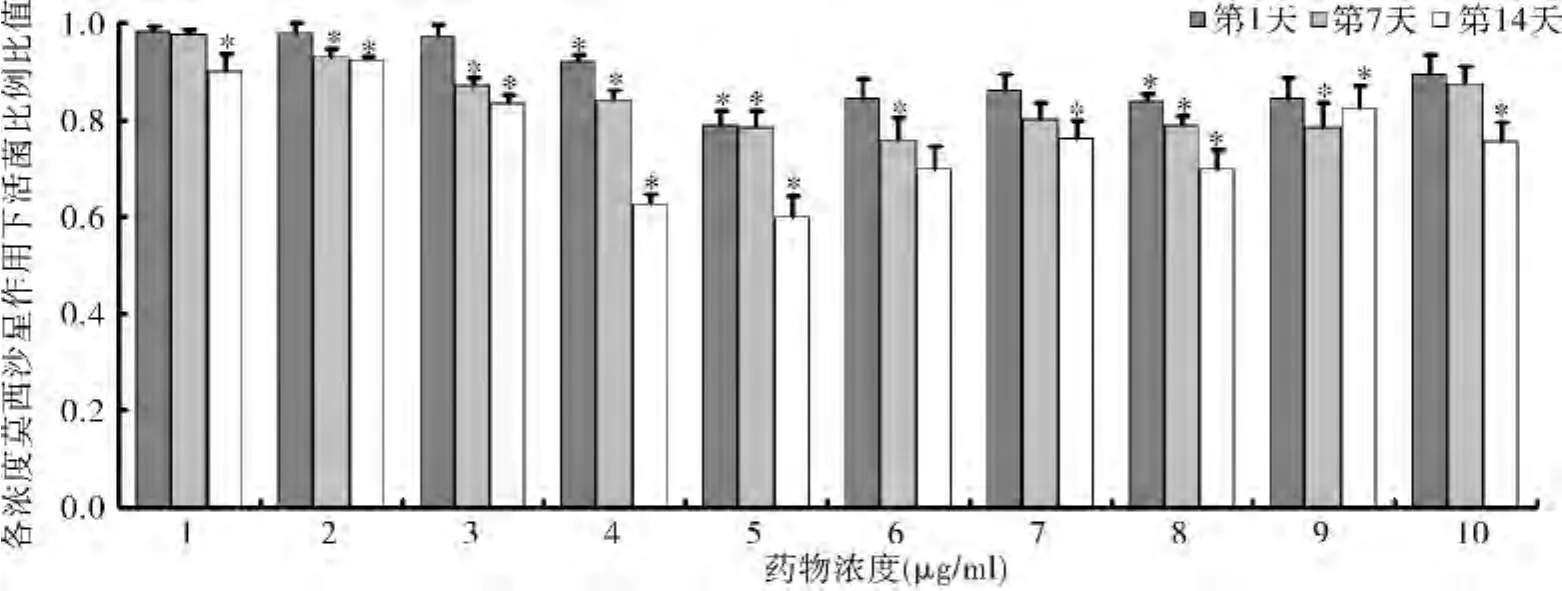
图3 各时相点不同浓度莫西沙星作用下活菌比例比值
本实验研究发现,莫西沙星对经过RCCS模拟微重力环境处理过的铜绿假单胞菌的抑菌环直径明显延长,且相同浓度莫西沙星作用下的活菌比例均小于对照组,即14天RCCS模拟微重力能增加铜绿假单胞菌对莫西沙星的敏感度。分析其机制,可能与RCCS模拟微重力环境下铜绿假单胞菌杆菌在分子水平及基因水平上应激反应蛋白变化和致病因子表达等有关[2,4,5]。尹焕才等[12]研究发现经回转器处理的大肠杆菌出现抗生素敏感突变株,认为G-菌对微重力环境更加敏感。另有研究表明,模拟微重力条件可促进大肠杆菌细胞壁增殖,增强其对氯霉素和青霉素以及高渗透压和乙醇的抵抗能力[13]。模拟微重力条件下盐古菌对枯草杆菌肽、红霉素、利福平的抗药性亦明显增加,还有研究人员则报道了不同的研究结果[14]。谢琼等进行的微生物宇宙飞船搭载试验显示,微生物经搭载后的耐药性遗传指标基本稳定,产超广谱酶的大肠杆菌和耐甲氧西林金黄色葡萄球菌,对头孢他啶、氧氟沙星、哌拉西林等35种抗生素的耐药性没有变化,蜡样芽胞杆菌对头孢唑林、头孢曲松、头孢噻肟、哌拉西林的耐药性有所减弱,但对多数药物的耐药性不变。显然,不同微生物在微重力环境下的生物学特性演变和药物敏感度变化有可能完全不同,其特点及机制有待进一步研究。
本研究还发现,14天 RCCS模拟微重力环境下莫西沙星对铜绿假单胞菌杆菌的抑菌环直径和相同药物浓度下活菌比例与模拟微重力时相呈负相关趋势,即随RCCS模拟微重力时相延长,铜绿假单胞菌对莫西沙星的敏感度进一步增强。另外发现,最低抑菌浓度却没有明显变化。尹焕才等[12]研究发现经回转器处理的大肠杆菌抗生素敏感突变株的数量与处理时间呈正相关,微重力环境下连续培养30天后头孢他定敏感度增强株的突变率为0.5%,培养60天后突变率增至55%,而120天达到了65%。Searles等[15]研究低剪切微重力环境下白色念珠菌的生长变化,发现随微重力暴露时间的延长,菌株繁殖增快,结构变异,C白菌毒力增强,对两性霉素B的耐药性增大,分析认为其归因于白色念珠菌毒力相关表型对微重力环境的迅速适应。本研究结果与前者接近。最低抑菌浓度是传统的抗生素敏感度试验检测项目,通常需要菌液和抗生素共同孵育16~24h,在此过程中,模拟微重力环境下形成的耐药性有可能发生作用,这可能是本实验研究中未能检测到最低抑菌浓度变化的主要原因[7]。无论由于微重力环境下微生物的抗生素敏感突变株形成,还是因为微生物对微重力环境产生适应和耐受,这种截然相反的表现结果进一步说明了微重力环境下微生物变化/变异以及抗生素敏感度的多样性和复杂性。
我国即将开展空间站长期太空飞行,研究太空失重或模拟失重对微生物抗生素敏感度影响及其作用机制,不仅为阐明微生物与人类之间的相互作用以及航天任务中航天员感染治疗等一系列科学问题提供理论依据,而且还对空间微生物安全监控等都具有普遍的指导意义。
1 Foster JS,Khodadad CL,Ahrendt SR,et al.Impact of simulated microgravity on the normal developmental time line of an animal-bacteria symbiosis[J].Sci Rep,2013,3:1340
2 黄玉玲,杨建武,易勇,等.微重力及太空飞行对微生物影响的研究进展[J].北京生物医学工程,2014,33(1):102-106
3 Taylor GR.Recovery of medically important microorganisms from A-pollo astronauts[J].Aerosp Med,1974,45(8):824-828
4 Crabbé A,De Boever P,Van Houdt R,et al.Use of the rotating wall vessel technology to study the effect of shear stress on growth behaviour of Pseudomonas aeruginosa PA01[J].Environ Microbiol,2008,10(8):2098-2110
5 Crabbé A,Schurr MJ,Monsieurs P,et al.Transcriptional and proteomic responses of Pseudomonas aeruginosa PAO1 to spaceflight conditions involve Hfq regulation and reveal a role for oxygen[J].Appl Environ Microbiol,2011,77(4):1221-1230
6 CLSI document M100-S22.Performance standards for antimicrobial susceptibility testing,twenty-second informational supplement[R].Wayne,PA:USA:Clinical and Laboratory Standards Institute,2012
7 Hensley DM.Maintenance of antimicrobial susceptibility of acinetobacter baumannii in modeled microgravity[J].Clin Lab Sci,2010,23(2):84-88
8 马筱玲,李庆,翟志敏.流式细胞术检测抗生素最低抑菌浓度[J].中华微生物学和免疫学杂志,2004,24(1):36-39
9 方向群,张杜超,刘长庭.微重力对病原菌毒力和抗生素敏感性影响的研究进展[J].航天医学与医学工程,2012,25(3):220-224
10 Abbes S,Trabelsi H,Amouri I,et al.Methodsfor studying the in vitro susceptibility of Candida spp.to antifungals[J].Ann Biol Clin:Paris,2012,70(6):635-642
11 Rosenzweig JA,Abogunde O,Thomas K,et al.Spaceflight and modeled microgravity effects on microbial growth and virulence[J].Appl Microbiol Biotechno,2010,85(4):885-891
12 尹焕才,薛小平,杨慧,等.模拟微重力环境下细菌生物学效应的初步研究[J].航天医学与医学工程,2009,22(5):341-346
13 Lynch SV,Mukundakrishnan K,Benoit MR,et al.Escherichia coli biofilms formed under low-shear modeled microgravity in a groundbased system[J].Appl Environ Microbiol,2006,72(12):7701-7710
14 Dornmayr-Pfaffenhuemer M,Legat A,Schwimbersky K,et al.Responses of haloarchaea to simulated microgravity[J].Astrobiology,2011,11(3):199-205
15 Searles SC,Woolley CM,Petersen RA,et al.Modeled microgravity increases filamentation,biofilm,formation,phenotypic switching,and antimicrobial resistance in Candida albicans[J].Astrobiology,2011,11(8):825-836

