不同溶剂及辅助方法对花生壳提取物中 木犀草素含量及抗菌作用的影响
周建新 林 姣 包月红 吴萌萌
(南京财经大学粮食储运国家工程实验室,南京 210046)
花生壳属于农产品加工废弃物中数量十分可观的生物质资源,我国每年大约有200多万t的花生壳[1],如何更好地使花生壳中的各种有效成分得到合理利用,提高农业经济效益,具有十分重要的社会意义[2]。木犀草素作为花生壳中最主要的黄酮类化合物,已被研究人员通过动物和临床试验证明其具有抗氧化性抗炎症、抗病毒性、降血脂和胆固醇、增强免疫力等药理作用[3-9]。体外试验也证明了花生壳提取物具有抗氧化与抗菌作用,可作为食品天然抗氧化剂和防腐剂开发,其中起主要作用的就是木犀草素[10-12]。目前,从花生壳中提取黄酮类化合物或木犀草素主要有有机溶剂法[13],辅助方法主要有超声波法[14]和微波法[15-16]等,这些研究表明溶剂种类与浓度、料液比、提取温度与时间及辅助方法等影响花生壳提取物中黄酮类化合物或木犀草素的含量,由于花生壳提取物中的抗菌物质主要是木犀草素,所以这些因素必然也会影响其抗菌活性[17]。因此,研究不同溶剂及辅助方法对花生壳中木犀草素含量和抗菌作用的影响,对于进一步开发花生壳为食品天然防腐剂具有重要的现实意义。
1 材料与方法
1.1 试验材料
花生壳:江苏南通市,手工剥壳,洗净后50 ℃干燥箱中烘干,用粉碎机磨成粉,过50目筛后备用;实验菌种:金黄色葡萄球菌6538(Staphylococcusaureus6538),江苏省疾病预防控制中心微生物试剂厂,活化后配制成所需菌量的悬浮液[18]。
木犀草素标准品:美国Sigma-Alorich公司。
1.2 试验试剂
平板计数琼脂、营养肉汤,250 g,杭州天和微生物试剂有限公司;乙醇、甲醇、丙酮、乙酸乙酯:分析纯;甲醇:色谱纯,均为南京化学试剂有限公司。
1.3 试验仪器
101-3AS型电热鼓风干燥箱:上海苏进仪器设备厂;FW80型高速万能粉碎机:天津市泰斯特仪器有限公司;JM-B5002型电子天平:余姚市纪铭称重校验设备有限公司;TP214型电子分析天平:丹佛仪器(北京)有限公司;RE-52CS型旋转蒸发器、B-220型恒温水浴锅:上海亚荣生化仪器厂;SHZ-D(Ⅲ)型循环水式真空泵:巩义市予华仪器有限责任公司;SYQ-DSX-280B型手提式不锈钢压力蒸汽灭菌器:上海申安医疗器械厂;SM-CJ-1F型单人双面净化工作台:苏州净化设备有限公司;EX20型生物显微镜:宁波舜宇仪器有限公司;HH-4型数显恒温水浴锅:国华电器有限公司;HZQ-F160型全温振荡培养箱:太仓市实验设备厂;GNP-9160型隔水式恒温培养箱:上海三发科学仪器有限公司;WP800SL23-2型微波炉:格兰仕微波炉电器有限公司;DZF-6090型真空干燥箱:武汉尚测试验设备有限公司;gilent-1260型高效液相色谱仪:美国Agilent公司。
1.4 试验方法
1.4.1 不同溶剂对花生壳提取物中木犀草素含量及抗菌作用的影响
称取10.00 g花生壳粉5份,分别至250 mL锥形瓶中,各自加入150 mL的 75%甲醇、75%乙醇、75%丙酮、乙酸乙酯和水(花生壳粉g/溶剂体积mL,即料液比为1∶15),放入50 ℃水浴锅中磁力搅拌提取2 h。经抽滤后滤渣重新倒入150 mL相应提取溶剂,再提取1h,抽滤后,合并两次滤液,放入旋转蒸发仪,经蒸发浓缩后,定容至半浸膏状态,置于50 ℃真空干燥箱中干燥,称量,计算提取得率(提取物质量/花生壳粉质量×100%),用50%乙醇定容至10 mL,此为提取物原液(原料花生壳/定容体积,1 g/mL)备用。
取一部分提取物原液经稀释后过0.22 μm滤膜,用HPLC检测木犀草素含量[19]。
以金黄色葡萄球菌作为指示菌,按平板计数法分别测定提取物的抗菌作用[18]:用50%乙醇对花生壳提取原液进行倍比稀释,取稀释液各5 mL,倒入100 mL平板计数琼脂培养基中,混匀,高压蒸汽灭菌(121 ℃,25 min);吸取金黄色葡萄球菌菌悬液(102~103个/mL)200 μL于无菌培养皿中,倒入相应含提取物原液或稀释液的培养基,摇匀,待培养基凝固后,培养箱中倒置培养(36 ℃,24 h)。计数并计算抗菌率。抗菌率=(1-加提取物菌落数/未加提取物菌落数)×100%。
1.4.2 不同辅助方法对花生壳提取物中木犀草素含量及抗菌作用的影响
本试验采用4种方法:超声波、微波、恒温振荡和水浴回流辅助提取花生壳中的木犀草素。称取20.00 g花生壳粉,放入含200 mL 70%乙醇溶液锥形瓶中,置相应的设备中处理,抽滤,滤渣再倒入400 mL 70%乙醇溶液进行第二次处理,抽滤,合并两次滤液至旋转蒸发仪上浓缩至半浸膏状态后置于50 ℃真空干燥箱中干燥,称量,计算提取得率。设置条件为超声波(温度50 ℃,2 h);微波(20 s,停顿1 min,总时间5 min);恒温振荡(温度50 ℃,转速150r/min,2 h);水浴回流(温度50 ℃,2 h)。上述提取物用50%乙醇定容至10 mL,得到提取液原液。
提取物原液中木犀草素含量检测同1.4.1。
以金黄色葡萄球菌作为指示菌,按滤纸片法分别测定提取物的抗菌作用[20]:吸取200 μL菌悬液(105~106个/mL)于平板计数琼脂培养基表面,L型玻璃棒涂匀,无菌镊子取出在花生壳提取物原液或稀释液中浸泡3 h的滤纸片(直径6 mm)贴在平板上,每个培养皿贴3片,并用50%乙醇溶液浸泡滤纸片作对照。培养(36 ℃、24 h),游标卡尺测定抑菌圈直径。
1.5 数据统计分析
2 结果与讨论
2.1 不同溶剂对花生壳提取物中木犀草素含量及抗菌作用的影响
2.1.1 不同溶剂对花生壳提取物中木犀草素含量的影响
不同溶剂花生壳提取物的木犀草素的含量如表1所示,从表1中可以看出,乙醇和水的提取得率最高,丙酮提取物略低,甲醇次之,乙酸乙酯最低;而提取物中木犀草素的含量测定中,丙酮提取物中最高,乙醇次之,甲醇略低于乙醇,乙酸乙酯和水的相对较低。但从提取物中木犀草素绝对量来看,丙酮>乙醇>甲醇>乙酸乙酯>水,考虑到丙酮和甲醇对人体的危害性,选择相对安全的乙醇作为花生壳中木犀草素提取溶剂比较合适。

表1 不同溶剂花生壳提取物中木犀草素的含量/%
注:提取物中木犀草素绝对量=提取得率×木犀草素含量。同列上标字母不同者差异显著(P<0.05)。
2.1.2 不同溶剂对花生壳提取物抗菌作用的影响
金黄色葡萄球菌是食品中常见的致病菌,因此以其作为试验菌种进行花生壳提取物抗菌作用具有代表性。不同溶剂提取物的原液及倍比稀释液对实验菌的抗菌作用如表2所示,从表2中可以看出,在同一浓度下不同溶剂的花生壳提取液的抗菌效果不一样。当提取物浓度均为1 g/mL(原液)时,乙醇、甲醇及丙酮提取物的抗菌率均达到了100%,显著高于乙酸乙酯和水提取物,这与上面检测木犀草素绝对含量的高低相一致。同时对于同种溶剂提取物而言,随着提取物浓度的增加,抗菌率提高,抗菌作用越显著,如对于乙醇提取物,随着浓度的倍比增加,抗菌率从0.25 g/mL时的 (11.5±0.4)%上升到1 g/mL时的100%。

表2 不同溶剂提取物对金黄色葡萄球菌的抗菌率/%
注:同列上标字母不同者差异显著(P<0.05)。
2.1.3 花生壳提取物木犀草素含量与抗菌作用的相关性
根据表2数据,在同一浓度下,不同溶剂提取物对金黄色葡萄球菌的抗菌率与提取物中木犀草素绝对含量或花生壳提取物得率之间进行相关性分析,结果如表3所示,在同一提取物浓度下,不同溶剂提取物对金黄色葡萄球菌的抗菌率与花生壳提取物得率之间无显著相关(P>0.5),但与木犀草素的绝对含量呈正显著相关(P<0.05)。

表3 不同溶剂提取物中木犀草素绝对含量及提取得率
注:*表示显著,P<0.05;**表示极显著,P<0.01。
2.2 不同辅助方法对花生壳提取物中木犀草素含量及抗菌作用的影响
2.2.1 不同辅助方法对花生壳提取物中木犀草素含量的影响
在对植物活性成分提取方法的研究中,选择合适的辅助提取方法,将会使提取效果显著提高[14-16]。4种辅助方法得到的花生壳提取物原液,木犀草素含量的测定结果如表4,表明通过不同辅助方法提取的木犀草素,微波提取得率最高为(4.6±0.6)%,显著高于超声波提取的(4.1±0.3)%,水浴回流提取的(3.9±0.1)%,以及振荡提取的(3.2±0.4)%。提取物中的木犀草素含量有所不同,其中,采用水浴回流法提取得到的提取物木犀草素含量最高达(16.6±1.3)%,其次分别是恒温振荡法>微波法>超声波法。而从木犀草素绝对含量看,水浴回流法>微波法>恒温振荡法>超声波法。与溶剂提取法相比,辅助方法提取花生壳中木犀草素具有绝对含量高、提取时间短等优点。
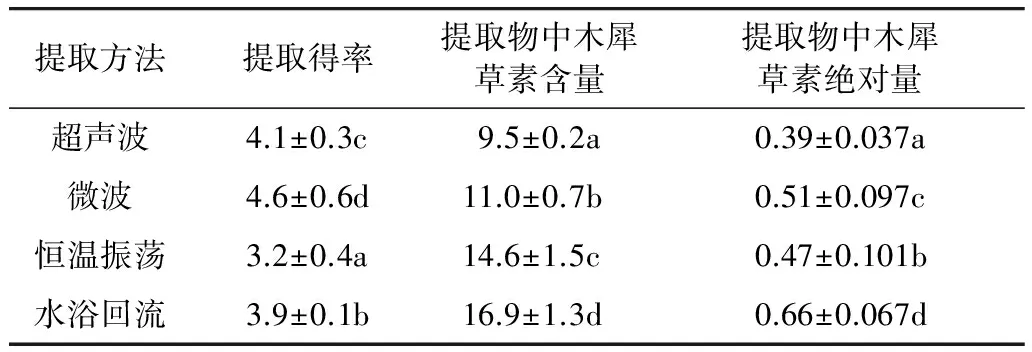
表4 不同辅助方法提取物中木犀草素的含量/%
注:同列上标字母不同者差异显著(P<0.05)。
2.2.2 不同辅助方法对花生壳提取物抗菌作用的影响
不同辅助方法提取的花生壳提取物抗金黄色葡萄球菌的情况如表5所示,表中显示,不同辅助提取条件下,对金黄色葡萄球菌的抗菌作用不一样,抗菌大小依次为:水浴回流>微波>恒温震荡>超声波。例如:原液时,回流提取物的抑菌圈直径是(9.34±0.29) mm,微波提取物的为(9.20±0.41) mm,振荡提取物(9.00±0.32) mm,超声波提取物的抑菌圈直径最小,为(8.03±0.23) mm。另外,抑菌圈的直径都是随着滤纸片所泡提取液浓度的升高而增大,且在浓度为0.25 g/mL以下,抑菌圈直径上升较快,之后几乎呈稳定上升趋势;抗菌效果与木犀草素含量一致。这说明水浴提取在这几种方法中效果最好,可能是由于水浴温度较高,分子运动加快,有利于木犀草素的提取。
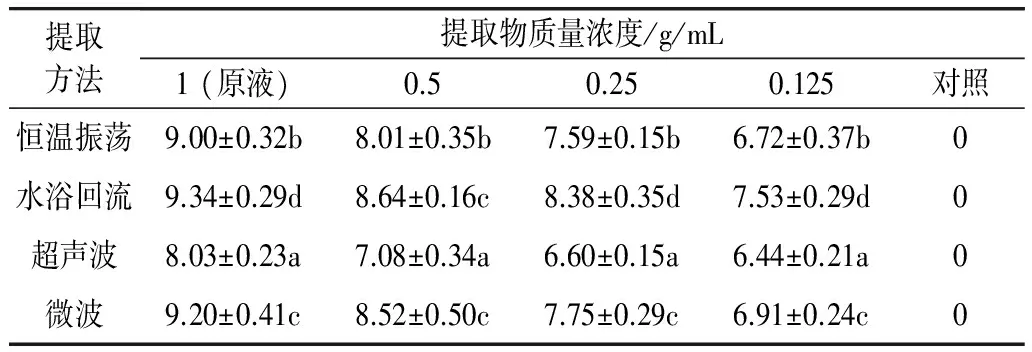
表5 不同辅助方法提取物对金黄色葡萄球菌的抑菌圈直径/mm
注:同列上标字母不同者差异显著(P<0.05)。
2.2.3 不同辅助方法花生壳提取物木犀草素的含量与抗菌作用的相关性
根据表5数据,在同一浓度下,不同辅助方法得到的花生壳提取物对金黄色葡萄球菌的抑菌圈与提取物中木犀草素绝对含量或花生壳提取物得率之间进行相关性分析,结果如表6所示。从表6中可以看出,在同一浓度下,提取物的抗菌效果与木犀草素绝对含量存在显著的正相关性,而与提取物的得率则无相关性,说明提取物的抗菌作用(以抗菌圈直径表示)与所提取的木犀草素量有关,木犀草素含量越高,抗菌作用越好;与提取物的得率无关,提取物得率的高低,与不同辅助方法溶解性能有关,而提取物中具有抗菌成分的高低才是影响提取物抗菌活性的关键,这也侧面反应了木犀草素是提取物中影响抗菌活性的一个重要的抗菌活性成分。

表6 提取物抗菌圈直径与木犀草素绝对含量
注:*表示显著,P<0.05;**表示极显著,P<0.01。
3 结论
通过对花生壳提取物木犀草素含量及对金黄色葡萄球菌抗菌作用的测定,表明提取物中木犀草素的绝对含量和抗菌效果与提取溶剂和辅助方法有关。提取物中木犀草素的绝对含量和在同一浓度时抗菌效果依次是丙酮>乙醇>甲醇>乙酸乙酯>水、水浴回流法>微波法>恒温震荡法>超声波法;同时对于同种溶剂或辅助方法提取物而言,随着提取物浓度的增加,抗菌作用越显著。通过SPSS17.0软件进行相关性分析,表明对金黄色葡萄球菌的抗菌作用与提取物中木犀草素的绝对含量呈正显著相关,与花生壳提取物得率之间无显著相关。
辅助方法有助于提高花生壳提取物木犀草素绝对含量和抗菌效果,有利于花生壳作为食品天然防腐剂的开发。
[1]石亚中,伍亚华.花生壳综合利用研究现状[J].花生学报,2008,37(2):41-44
[2]孙丰文,张茜,李自峰. 花生壳综合利用的研究进展[J].山东林业科技, 2008(6):84-88
[3]Kahiwada Y,Aoshima A,Ikesiro Y,et al. Anti-HIV benzyl isoquino line alkaloids and flavonoids from the leaves of Nelumbo nutifera,and structure-activity correlations with related alkaloids [ J]. Bioorganic & Medicinal Chemistry,2005,13(2):443-448
[4]Tewtrakul S,Miyashiro H,Nakamura N,et al. HIV-1 integrase inhibitory substances from coleus parvifolius[J]. Phytotherapy Research,2003,17(3):232-238
[5]Kimata M,Inagaki N,Nagai K. Effect of luteolin and other flavonoids on IgE-mediated allergic reaction[J]. Planta Medica,2000(66):25-29
[6]Kuo M Y,Liao M F, Chen F L,et al. Luteolin attenuates the pulmonary inflammatory response involves abilities of antioxidation and inhibition of MAPK and NFJB pathways in mice with endotoxin-induced acute lung injury[J].Food and Chemical Toxicology,2011(49):2660-2666
[7]Liisa T,Pia V,Elise S,et al. In vivo treatment of acute Chlamydia pneumoniae infection with the flavonoids quercetin and luteolin and an alkyl gallate,octyl gallate,in a mouse model[J]. Biochemical Pharmacology, 2005,70(8) :1222-1230
[8]王洪燕,全康,蒋燕灵,等.木犀草素抗肿瘤细胞增殖及增敏抗肿瘤药物作用研究[J].浙江大学学报:医学版,2010,39(1):30-36
[9]汪丽燕,韩传环,王萍.木犀草素对冠脉血流动力的实验研究[J].中国药理学通报, 1992,8(5): 388-390
[10]黎碧娜,曾庆赞,陈楚光.从花生壳中提取天然抗氧化成分的研究[J].现代化工,1995(10):31-33
[11]周建新,嵇美华,汪海峰,等.花生壳乙醇提取物(EEPH)抗菌性的研究[J].中国粮油学报, 2004,19 (1):64-66
[12]王倩,谢明杰.木犀草素对金黄色葡萄球菌的抑菌活性及其机制[J].微生物学报,2010,50(9):1180-1184
[13]杨颖,宋曙辉,徐桂花.木犀草素的生理功能、提取、纯化及应用的研究[J].食品工程,2010(1):19-24
[14]乔良博,林华卫,马雄,等.微波辅助提取花生壳中总黄酮的工艺研究[J].四川食品与发酵,2011,47(4):34-37
[15]肖淑娟,李红霞,于守武. 超声波辅助法提取花生壳中木犀草素[J]. 河北理工大学学报:自然科学版,2008,30(2):96-99
[16]裘纪莹,杜方岭,祝清俊,等.超声波辅助提取花生壳总黄酮工艺的优化[J].中国食物与营养, 2011, 17(7):34-36
[17]许晖,孙兰萍,张斌,等.花生壳黄酮类化合物的研究进展[J].农产品加工·学刊, 2008(3):11-15
[18]周建新,姚明兰,岳文倩,等. 蜂胶的抗菌性及其影响因素的研究[J].食品与发酵工业,2007,33(3):41-43
[19]林姣.花生壳木犀草素的提取分离及抗菌作用的研究[D].南京:南京财经大学,2013:11-17
[20]周邦靖.常用中药的抗菌作用及其测定方法[M].重庆:科学技术出版社重庆分社,1987:152-155.

