天目山野生春兰根中可培养内生细菌多样性研究
武永秀 宋彤彤 张瑞英 刘亮 邵红 李潞滨 孙磊
(1.河北大学生命科学学院 河北省微生物多样性研究与应用实验室,保定 071002;2.中国林业科学研究院林业研究所,北京 100091;3.浙江天目山国家级自然保护区管理局,临安 311311)
植物内生细菌是植物微生态系统中的重要组成部分,具有多种有益的生物学功能,已成为植物微生物学科具有挑战性的研究领域。植物内生细菌是指生活在植物组织内部,没有给植物造成实质性损害,或者除了定居还从中获益的细菌[1]。内生细菌可以定殖在根、茎、叶、花、果实、种子等不同器官[2,3]。许多内生细菌在离体条件下都可表现出对植物有益的特性,但是只有少数细菌被证实可高效促进植物生长,或在农业条件下具有生防作用[4,5]。因此加深对植物内生细菌的研究,阐明它们的作用,必可促进其在可持续农业中的应用。
春兰(Cymbidium goeringii Rchb. f.)为多年生地生型草本植物,属于兰科兰属,是中国兰花的代表之一,主要分布于陕西、甘肃、河南至华东、华南和西南各省区,以江苏、浙江所产春兰为贵。目前,对春兰植物内生细菌的研究报道较少,本实验室曾以温室栽培春兰为材料,对其内生细菌分离条件及根内可分泌IAA、铁载体的细菌多样性进行研究[6-8]。本研究通过对采自浙江天目山的野生春兰根内可培养细菌多样性的研究,以期丰富植物内生细菌资源,并为植物-微生物相互作用关系研究提供参考。
1 材料与方法
1.1 材料
于2009 年3 月自浙江省天目山共采集5 株健康春兰,空运回实验室后立即进行内生细菌分离。
1.2 方法
1.2.1 野生春兰根内生细菌的分离 5 株健康春兰每株取根1 g,无菌水冲洗根表面土壤,混合样品后用于内生细菌的分离。首先对根进行表面灭菌,表面灭菌条件参照刘琳等[7]方法:75%乙醇浸泡3 min,3%次氯酸钠溶液处理2 min,75%乙醇浸泡30 s,最后用无菌水冲洗。取最后一次冲洗水涂布于R2A 平板并将处理后的根组织于R2A 平板上轻压涂抹,28℃暗培养6 d,无菌落生成则表示表面灭菌合格。将表面灭菌合格的根置于无菌研钵中,加入无菌生理盐水及少量的无菌石英砂研磨,研磨液梯度稀释后涂布R2A 培养基(Difco)和TSA 培养基(Difco)平板,各设3 个平行,28℃。挑取适当稀释度平板上的所有菌落,纯化后4℃保藏备用。
1.2.2 根内生细菌的16S rDNA 序列扩增 菌落裂解法[9]制备反应模板。采用细菌16S rDNA 通用引物[10]27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-GGTTACCTTGTTACGACTT-3'(上海英骏生物技术有限责任公司合成)进行扩增。PCR 反应程序:94℃预变性4 min;94℃变性45 s,54℃退火45 s,72℃延伸45 s,30 个循环;72℃延伸10 min。1%琼脂糖凝胶电泳检测PCR 扩增产物。
1.2.3 根内生细菌的16S rDNA 序列测定及系统发育分析 对所有菌株进行16S rDNA 序列测定。测序结果利用BLAST 软件(http://www.ncbi.nlm.nih.gov/blast/Blast.cgi)与GenBank 数据库中的序列进行比对分析,选取同源性最高的且有效发表的菌株序列,利用MEGA5.1 软件(http://www.megasoftware.net/mega5.1.html)进行分析,用Clustal W 按照最大同源性的原则进行排序,采用Kimura-2 计算核苷酸差异值,最后用邻接法(Neighbor-Joining method)构建系统发育树[11]。
1.2.4 多样性指数计算 根据序列比对结果计算不同培养基获得的香浓-威纳多样性指数(Shannon-Weaver index,H)。计算公式为:H=-PilnPi,式中,Pi 为第i 种细菌占该细菌总数的比率。
2 结果
2.1 野生春兰根内生细菌的种群数量
将采集的野生春兰根样品表面灭菌后进行内生细菌的分离培养,同时检测表面灭菌效果。5 d 后检测平板无菌落形成,证明表面灭菌彻底,分离结果可用。根据菌落形态进行分类、编号、纯化,最终从野生春兰根中得到内生细菌63 株,其中R2A 培养基中得到56 株,TSA 培养基中得到7 株。R2A培养基获得的内生细菌种群数量为4×104cfu/g fw,TSA 培养基获得的细菌种群数量为0.5×104cfu/g fw。
2.2 野生春兰根内生细菌的多样性分析
测定63 株春兰内生细菌的16S rDNA 序列,将测定的序列登录GenBank,登录号为:KF751813-KF751823。将测序结果与GenBank 数据库中的序列进行比对分析,序列分析结果(表1)表明,63 株内生细菌分属于变形菌门的β-变形菌纲(31.74%)、γ-变形菌纲(7.94%)以及厚壁菌门(60.32%)的6 个属的8 个种,其中芽孢杆菌属为最优势菌属(50.79%)。分离自R2A 培养基的56 株内生细菌分属于伯克氏菌属(Burkholderia)、假单胞菌属(Pseudomonas)、Dyella 菌属、芽孢杆菌属(Bacillus)和Lysinibacillus 属。31 株细菌属于芽孢杆菌属,为最优势菌属,占R2A 培养基分离总菌数的55.36%;20 株细菌属于伯克氏菌属,为次优势菌属,占分离总菌数的35.71%。分离自TSA 培养基的7 株细菌分属于假单胞菌属、芽孢杆菌属、Lysinibacillus 属及类芽孢杆菌属(Paenibacillus),假单胞菌属的细菌占TSA 培养基分离总菌数的42.86%。由比对结果构建的系统发育树见图1。计算结果显示,天目山野生春兰根内生细菌香浓-威纳多样性指数为1.56,而R2A 培养基及TSA 培养基获得的天目山野生春兰根内生细菌多样性指数分别为1.36 和1.28。
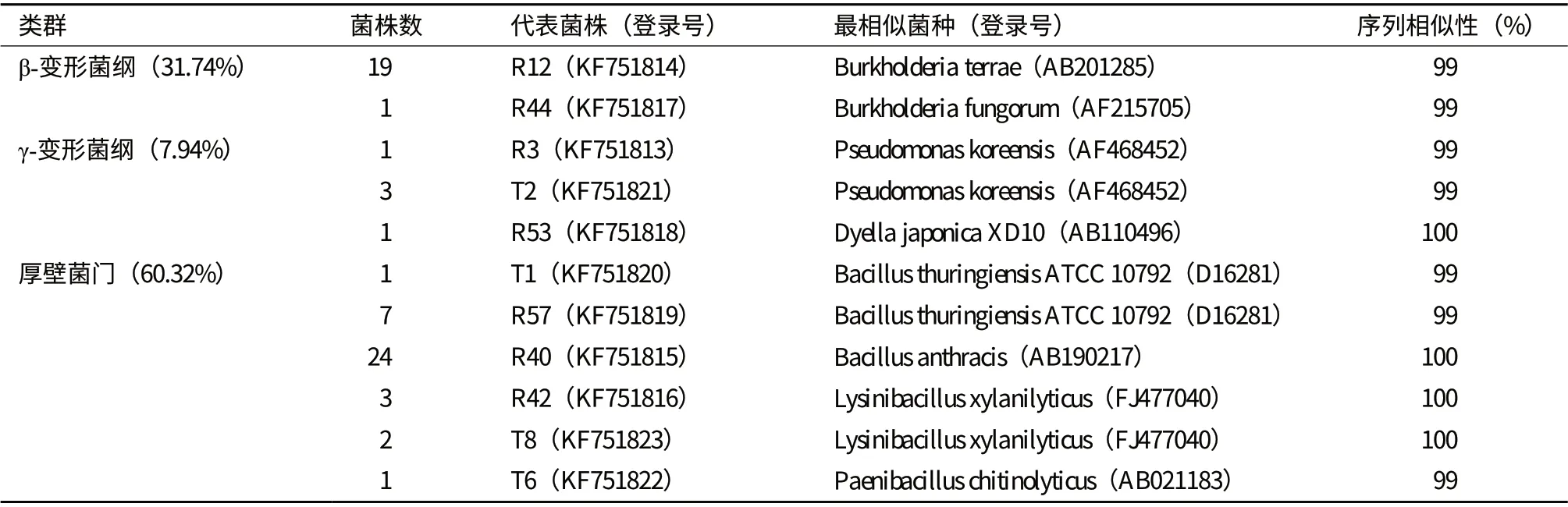
表1 天目山野生春兰根内生细菌16S rDNA 序列相似性分析
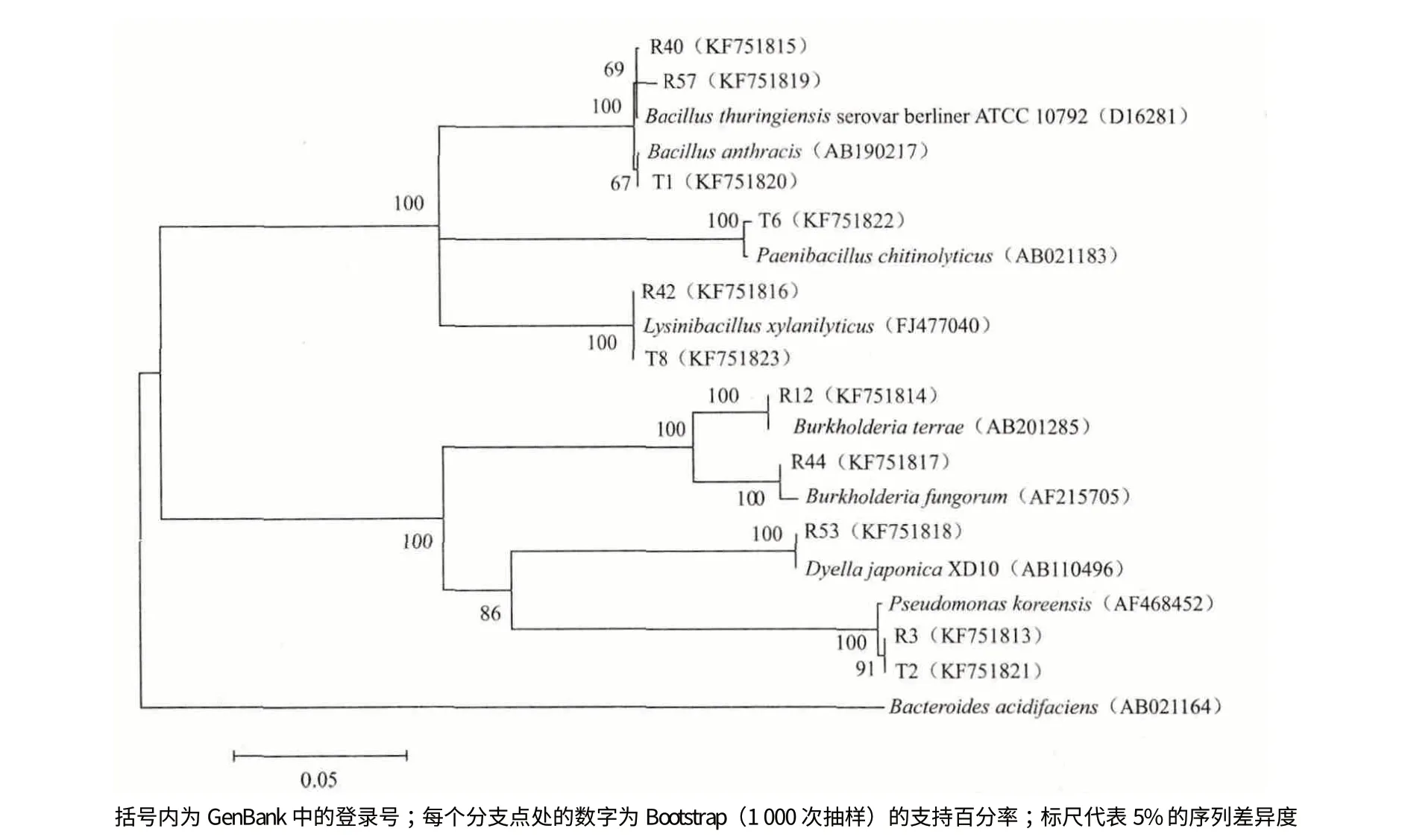
图1 天目山野生春兰可培养内生细菌的16S rDNA 系统发育树
3 讨论
本研究分离出的野生春兰根内生细菌的优势菌属为芽孢杆菌属(58.7%)和伯克氏菌属(31.7%)。该两个属的细菌作为有益植物内生细菌研究较多,报道显示伯克氏菌属具有固氮功能[12],ACC 脱氨基酶活性[13],可分泌IAA、铁载体[6,7]及生物防治[14]等多种生物学活性。芽孢杆菌属细菌作为常见的可培养的植物内生细菌对一些植物病害有较好的防治效果,并且对植物的生长具有促生作用[15]。我们从天目山野生春兰根内也分离到了1 株与Dyella 属细菌16S rDNA 相似性很高的菌株,目前Dyella 属有8 个已知种,均分离自土壤,作为植物内生细菌仅见刘琳等[7]从温室盆栽春兰根内分离出一株可分泌IAA 的Dyella sp.,这在一定程度上证明植物基因型对内生细菌具有选择性。
自报道可从表面灭菌的植物当中分离获得细菌[16,17]开始,到现在通过培养方法和非培养方法已发现了200 个属的细菌可作为植物内生细菌存在。研究和报道最多是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)的细菌。本研究从天目山野生春兰根内只分离到了变形菌门和厚壁菌门的细菌,且仅归属于6 个属的8个种。本实验室从温室盆栽春兰根中分离到的可分泌IAA的细菌属于18个已知属和两个潜在的新属[7],分泌铁载体的细菌属于17 个已知属[6]。可见温室盆栽春兰根内生细菌多样性远远高于浙江天目山的野生春兰。这可能是由于野生春兰生长过程中自然条件多变,造成内生细菌的生存环境多变不稳定;取样时间为3 月份,植物刚刚越冬进入生长时期,也可能是造成细菌多样性较低的另一原因。比较两种培养基分离的结果发现不论是从种群数量还是多样性,R2A 培养基获得数据均高于TSA 培养基,R2A培养基更适用于野生春兰内生细菌的分离。本研究结果表明初春季节天目山野生春兰根内生可培养细菌多样性较低。本研究丰富了植物内生细菌资源库,对新物种资源的发现起到了重要的作用,为有益内生细菌的综合利用提供了科学依据。
4 结论
本研究获得的天目山野生春兰根内生细菌分属于变形菌门和厚壁菌门的6 个属的8 个种,其中芽孢杆菌属(Bacillus)为最优势菌属,其余菌分属于伯克氏菌属(Burkholderia)、假单胞菌属(Pseudomonas)、Dyella 菌 属、Lysinibacillus 属 和 类芽孢杆菌属(Paenibacillus)。
[1] Kado CI. Plant pathogenic bacteria[M]//Balows A, Truper HG, Dworkin M, et al. The prokaryotes. New York:Springer-Verlag, 1991:659-674.
[2] Compant S, Clément C, Sessitsch A. Plant growth-promoting bacteria in the rhizo- and endosphere of plants:There role, colonization, mechanisms involved and prospects for utilization[J]. Soil Biology and Biochemistry, 2010(42):669-678.
[3] Fürnkranz M, Lukesch B, Müller H, et al. Microbial diversity inside pumpkins:microhabitat-specific communities display a high antagonistic potential against phytopathogens[J]. Microb Ecol Doi:10.1007/s00248-011-9942-4.
[4] Berg G. Plant-microbe interactions promoting plant growth and health:perspectives for controlled use of microorganisms in agriculture[J]. Appl Microbiol Biotechnol, 2009, 84:11-18.
[5] Scherwinski K, Grosch R, Berg G. Effect of bacterial antagonists on lettuce:active biocontrol of Rhizoctonia solani and negligible. short-term effect on non-target microbes[J]. FEMS Microbiology Ecology, 2008, 64:106-116.
[6] 孙磊, 邵红, 刘琳, 等.可产生铁载体的春兰根内生细菌多样性[J].微生物学报, 2011, 51(2):189-195.
[7] 刘琳, 孙磊, 张瑞英, 等.春兰根中可分泌吲哚乙酸的内生细菌多样性[J].生物多样性, 2010, 18(2):182-187.
[8] 孙磊, 毕晓宝, 李潞滨, 等.春兰根内生细菌分离培养方法的初步研究[J].河北农业大学学报, 2009, 32(1):42-46.
[9] 徐丽, 蔡俊鹏.菌落PCR 方法的建立及其与常规PCR 方法的比较[J].华南理工大学学报:自然科学版, 2004, 32:51-55.
[10] Lane DJ. 16S/23S rRNA sequencing[M]//Stackebrandt E, Goodfellow M. Nucleic acid techniques in bacterial systematics. United Kingdom:John Wiley & Sons, Chichester, 1991:115-175.
[11] Tamura K, Peterson D, Peterson N, et al. MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28(10):2731-2739.
[12] James EK. Nitrogen fixation in endophytic and associative symbiosis[J]. Field Crops Research, 2000, 65(2-3):197-209.
[13] Sun Y, Cheng Z, Glick BR. The presence of a 1-aminnocyclopropane-1-carboxylate(ACC)deaminase deletion mutation alters the physiology of the endophytic plant growth-promoting bacterium Burkholderia phytofirmans PsJN[J]. FEMA Microbiol Lett, 2009, 296(1):131-136.
[14] Fishal EM, Meon S, Yun WM. Induction of tolerance to fusarium wilt and defense-related mechanisms in the plantlets of susceptible Berangan Banana pre-noculated with Pseudomonas sp.(UPMP3)and Burkholderia sp.(UPMB3)[J]. Agricul Sci China, 2010, 9(8):1140-1149.
[15] Liu B, Qiao H, Huang L, et al. Biological control of take-all in wheat by endophytic Bacillus subtilis E1R-j and potential mode of action[J]. Biological Control, 2009, 49(3):277-285.
[16] Samish Z, Dimant D. Bacterial population in fresh, healthy cucumbers[J]. Food Manufacture, 1959, 34:17-20.
[17] Mundt JO, Hinkle NF. Bacteria within ovules and seeds[J]. Appl Environ Microbiol, 1976, 32(5):694-698.

