蓝靛果忍冬分化培养基的优化筛选
李富恒,曲 迪,赵恒田,朱会杰,杨洪升,徐清华,李楠丁
(1.东北农业大学生命科学学院,哈尔滨 150030;2.中国科学院东北地理与农业生态研究所,哈尔滨 150081)
蓝靛果忍冬分化培养基的优化筛选
李富恒1,曲 迪1,赵恒田2,朱会杰1,杨洪升1,徐清华1,李楠丁1
(1.东北农业大学生命科学学院,哈尔滨 150030;2.中国科学院东北地理与农业生态研究所,哈尔滨 150081)
以蓝靛果忍冬优良品系L1-8为试验材料,取其休眠枝条萌发的腋芽为外植体,将培养基(MS、White、WPM、A3)、激素IBA(0.1、0.2、0.3、0.4 mg·L-1)、6-BA(1.0、1.5、2.0、2.5 mg·L-1)和GA3(0.5、1.0、1.5、2.0 mg·L-1)等处理组合进行4因素、4水平的正交试验,以优化筛选最佳分化培养基,为完善蓝靛果忍冬组培快繁技术提供技术支撑。结果表明,筛选出最优分化培养基为MS+6-BA 2.0 mg·L-1+IBA 0.3 mg·L-1+GA31.5 mg·L-1(分化率可达95.92%);基本培养基和不同激素对分化率产生影响,在4个因素中,基本培养基和6-BA是影响分化率的主要因素,IBA和GA3为次要因素;筛选出的不同培养基组合对增殖系数影响不同,最高为4.14,且芽苗生长状况良好;继代周期为30 d时,增殖效果最好。
蓝靛果忍冬;分化;培养基;正交试验;增殖系数
蓝靛果忍冬(Lonicera caeruleaL.var.edulisTur⁃cz.ex Herd),又名蓝靛果、黑瞎子果、山茄子等,是忍冬科忍冬属多年生落叶小灌木,主要分布在俄罗斯远东地区、日本及朝鲜北部和我国东北、内蒙古及华北等地区[1-2],是新兴的野生和栽培浆果资源,其果实富含糖类、有机酸、矿物质、维生素和多种微量元素,既可生食,也可用于加工和园林绿化及提取天然食用红色素,具有较高药用价值[3]。缺乏人工培育优良品种和野生资源日益枯竭是目前制约蓝靛果忍冬发展的主要问题。因此,把蓝靛果忍冬组培快繁技术与培育新品种结合进行研究,对提高幼苗繁殖效率、加速育种进程、保护和合理利用蓝靛果忍冬品种资源、大幅度提高其经济和开发价值等具有重要理论和实践意义。
国内外学者对蓝靛果忍冬组培快繁技术研究工作已取得一定进展。Ding等对外植体消毒和最佳诱导培养基进行筛选[4-5]。赵越等以茎段为外植体,成功诱导出愈伤组织及试管苗,幼苗成活率在90%以上[6-7]。杨振国等以腋芽为外植体进行组培快繁,筛选出适宜培养基,增殖系数达3.3[8-9]。但已有研究都是以现有品种为材料进行,由于组培快繁技术效果受多因素多水平制约,试验设计上很难综合考虑,结果有局限性。本文以中国科学院东北地理与农业生态研究所选育的蓝靛果忍冬优良品系L1-8为材料,利用正交试验对其组培分化培养基进行多因素多水平优化筛选,把组培快繁技术研究与培育新品种相结合,有较强针对性和目的性,可为蓝靛果忍冬产业化发展提供理论依据和技术支撑。
1 材料与方法
1.1 材料
供试材料为中国科学院东北地理与农业生态研究所选育的蓝靛果忍冬优良品系L1-8。试验于2012~2013年在中国科学院东北地理与农业生态研究所区域农业中心进行。
1.2 方法
1.2.1 培养基的配制
在容器中先加入约一半体积的蒸馏水,按各培养基配方依次加入预先配好的母液(大量元素、微量元素、肌醇、Fe盐、VB1、VB6、烟酸、甘氨酸等)。每1 000 mL溶液中加入蔗糖30 g、琼脂7 g,调节pH至5.8。将配制好的培养基溶液分装到三角瓶中,用封口膜封瓶口,121℃灭菌20 min。
1.2.2 外植体的获得和消毒
采集蓝靛果休眠枝条,流水冲洗3 h,水培至腋芽萌发。取长约0.5 cm的外植体腋芽,无菌水冲洗后,用75%乙醇处理10 s,再用0.1%氯化汞溶液处理10 min。每次外植体消毒后均用无菌水冲洗4~5次,用无菌滤纸吸干表面水分后待用。
1.2.3 无菌芽苗的培养
在超净工作台上将消毒过的腋芽接入1/2MS+ 6-BA 2.0 mg·L-1+NAA 0.2 mg·L-1培养基中,在芽苗高接近三角瓶顶部时,取出切段进行分化培养。
1.2.4 分化培养
以4种基本培养基(MS、White、WPM、A3)、3种激素(IBA、6-BA、GA3)的4个浓度为因素和水平,用L16(45)正交表设计4因素、4水平正交试验。将获得的无菌芽苗截成长约1.5 cm的茎段,分别接种于各分化培养基中,每个处理10瓶,每瓶5个茎段。培养30 d后统计分化率。进行极差分析和方差分析,以筛选出最佳分化培养基配方。
1.2.5 不定芽的增殖培养
取经分化培养生长情况一致的芽苗,接种在由正交试验结果分析筛选出的对分化率影响较大的培养基组合中。每个处理10瓶,每瓶5个芽苗,培养30 d后计算增殖系数,分析不同培养基和激素组合对L1-8不定芽增殖的影响。
取生长一致的芽苗,接种在增殖系数较高的培养基中,分别继代15、20、25、30、35、40 d,计算各时期增殖系数,分析不同继代周期对L1-8不定芽增殖的影响。
1.2.6 培养条件
室内培养温度(24±2)℃,光照时间12 h·d-1,光照强度约为50 μmol·m-2·s-1。
1.2.7 计算公式与数据处理
分化率(%)=已分化的芽苗茎段数/接种的总芽苗茎段数×100%增殖系数=产生的不定芽总数/接种的总芽数试验数据采用Excel 2007和SPSS 10.0软件进行分析。
2 结果与分析
2.1 不同基本培养基和激素处理组合对L1-8不定芽分化率的影响
2.1.1 正交试验分化率的极差分析
表1列出正交试验结果中各处理组合分化率和极差分析值。
由表1可知,不同种类基本培养基和3种激素(6-BA、IBA和GA3)不同浓度间处理组合均可诱导外植体分化;各处理分化率为31.67%~95.92%,其中3号处理组合分化率最高,为95.92%,比分化率最低的13号处理组合(31.67%)高64.25%。各因素的极差(R)大小依次为基本培养基(25.97)、6-BA(24.68)、IBA(14.07)和GA3(13.39),说明各因素对分化率影响的主次顺序为:基本培养基>6-BA>IBA>GA3,即影响外植体分化效果的主要因素是基本培养基,其次是6-BA和IBA,GA3影响效果最小;各因素的优水平为:MS基本培养基、2.0 mg·L-1的6-BA、0.3 mg·L-1的IBA及2.0 mg·L-1的GA3;各优水平搭配即为最优组合(MS+6-BA 2.0 mg·L-1+IBA 0.3 mg·L-1+GA32.0 mg·L-1)。

表1 不同基本培养基和激素处理组合对L1-8分化率的影响Table 1 Effect of different medium and hormone combination on L1-8 tissue culture seedlings differentiation rate
由极差分析法得出的最优组合与正交试验中分化率最高的3号处理组合基本相同,二者区别只在于GA3浓度不同,前者为2.0 mg·L-1,后者为1.5 mg·L-1。考虑到GA3对分化率的影响最小,且3号处理可节省1/4的GA3使用量,降低成本,因此无需后续补充试验,即可把3号处理组合确定为最优组合。
2.1.2 正交试验分化率的方差分析
对4个因素进行方差分析结果表明,各因素对外植体分化率的影响均达到显著水平,其中基本培养基和6-BA达极显著水平(见表2),说明基本培养基和不同激素都对分化率产生影响,在优化分化培养基时既要重视基本培养基的筛选,也要重视激素种类和浓度的筛选。在这四个因素中,基本培养基和6-BA是影响分化率的主要因素,IBA和GA3是次要因素。

表2 方差分析Table 2 Analysis of variance of the different culture medium and hormone
对各因素不同水平的平均分化率进行多重比较结果表明(见表3),不同基本培养基对分化率的影响效果为MS>WPM>White>A3,各基本培养基对分化率的影响存在显著差异,其中MS的平均分化率(72.73%)极显著高于其他3个基本培养基,A3的平均分化率(46.76%)极显著低于其他3个基本培养基(见表3);不同浓度6-BA对分化率的影响效果为2.0 mg·L-1>1.5 mg·L-1>2.5 mg·L-1>1.0 mg·L-1,各浓度对分化率的影响存在极显著差异,浓度为2.0 mg·L-1的平均分化率(71.67%)极显著高于其他3个浓度(见表4);不同浓度IBA对分化率的影响效果为0.3 mg·L-1>0.4 mg·L-1>0.1 mg·L-1>0.2 mg· L-1,浓度为0.3 mg·L-1的平均分化率(68.55%)极显著高于其他3个浓度,浓度为0.2 mg·L-1的平均分化率(54.48%)极显著低于其他3个浓度(见表5);不同浓度GA3对分化率的影响效果为2.0 mg·L-1>0.5 mg·L-1>1.0 mg·L-1>0.5 mg·L-1,GA3浓度为2.0 mg·L-1和1.5 mg·L-1的平均分化率(68.96%和64.87%)极显著高于其他2个浓度(56.87%和55.57%),2.0 mg·L-1和1.5 mg·L-1、1.0 mg·L-1和0.5 mg·L-1浓度差异不显著(见表6)。

表3 基本培养基平均分化率的多重比较Table 3 Cultivation of multiple comparison analysis table

表4 不同浓度6-BA平均分化率的多重比较Table 4 6-BA multiple comparison table

表5 不同浓度IBA平均分化率的多重比较Table 5 IBA multiple comparison table

表6 不同浓度GA3平均分化率的多重比较Table 6 GA3multiple comparison table
方差分析和多重比较结果表明,基本培养基类型和不同激素种类及其浓度均会对分化率产生影响;适宜于蓝靛果忍冬L1-8品系腋芽外植体分化最佳基本培养基为MS,6-BA浓度为2.0 mg·L-1,IBA浓度为0.3 mg·L-1,GA3浓度为2.0 mg·L-1或1.5 mg·L-1,最佳基本培养基与激素组合为MS+6-BA 2.0 mg·L-1+IBA 0.3 mg·L-1+GA32.0 mg·L-1或MS+ 6-BA 2.0 mg·L-1+IBA 0.3 mg·L-1+GA31.5 mg·L-1,与极差分析法结果一致。
2.2 不同基本培养基和激素组合对L1-8不定芽增殖系数的影响
由表7可知,不同种类及浓度的培养基和激素组合对L1-8不定芽增殖系数影响较大,16个处理组合中,以3号组合增殖系数最高,达4.14,极显著高于其他各组合,且分化的芽苗粗壮,生长状况最好;2号和4号组合增殖系数分别为2.54和3.15,分别较3号组合低1.60和0.99,芽苗生长状况较3号组合稍差,二者间差异极显著;1、5、7、8和15号组合增殖系数均达到1.0以上,分别为1.84、1.01、1.15、1.14和1.12,芽苗生长状况一般;6、9、10、11、12、13、14和16号组合增殖系数均在1.0以下,分别为0.84、0.14、0.22、0.26、0.46、0.72、0.86和0.76,芽苗生长状况较差。
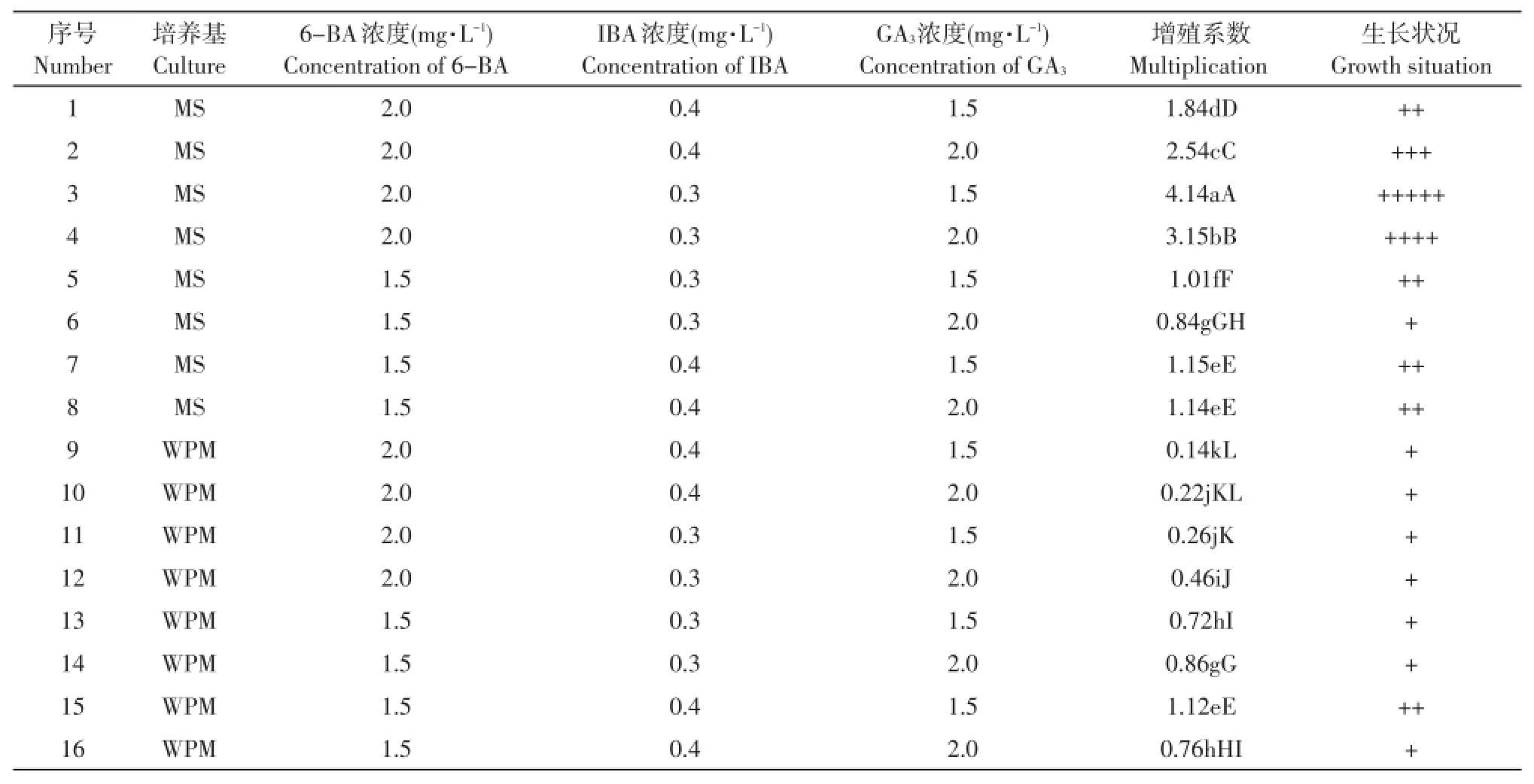
表7 不同基本培养基和激素组合对L1-8不定芽增殖系数的影响Table 7 Effect of different culture and hormone combination on L1-8 bud multiplication
2.3 不同继代周期对L1-8不定芽增殖的影响
由表8可知,不同继代周期对L1-8不定芽的增殖有不同影响,其整体变化趋势先增大后减小,继代周期为15 d时,增殖系数为3.04;继代周期为20和25 d时,增值系数分别达3.44和3.60,较15 d时分别增加0.40和0.56,差异不显著,芽苗生长状况相对较好;继代周期为30 d时,增殖系数最高,为4.20,显著或极显著高于其他各处理;继代周期为35和40 d时,增殖系数分别低至3.86 和3.22,差异极显著,说明继代增殖系数在这一阶段下降较大。继代周期过短(15 d)和过长(40 d),芽苗相对细弱,生长状况差。因此L1-8最适宜的继代周期为30 d。

表8 不同继代周期对L1-8不定芽增殖系数的影响Table 8 Effect of different subculture cycle on L1-8 not multiplication
3 讨 论
本试验在蓝靛果忍冬L1-8品系腋芽外植体的分化培养中采用4种基本培养基,即MS、White、WPM和A3(一种草莓专用培养基),每种基本培养基所含有机物和无机盐成分均不同。结果表明,MS基本培养基最适宜L1-8品系腋芽外植体的分化培养,与MS基本培养基中无机盐和离子浓度较高、养分数量和比例合适有关,在今后蓝靛果忍冬组织培养研究工作中,可按照适当增加某种离子浓度优化筛选培养基,提高培养效果和增殖系数。
内源激素和外源激素也对组织培养过程起重要调控作用,生长素和细胞分裂素合理搭配对外植体的分化影响最大。梁钻姬等研究表明,生长素和细胞分裂素配合使用比单一激素更能促进幼芽的分化和增殖。药用植物华泽兰增殖培养中,将6-BA和IBA配合使用,增殖系数高,幼芽萌发速度快,形成大量丛生芽,长势良好[10]。本试验结果表明,蓝靛果忍冬腋芽外植体分化培养的最佳组合为MS+2.0 mg·L-16-BA+0.3 mg·L-1IBA+1.5 mg·L-1GA3,继代周期为30 d,分化率和不定芽增殖系数最高,芽苗生长状况良好。其他激素配比组合分化率较低原因是由于不同种类激素间生理效应相互拮抗所致。过短或过长的继代周期对不定芽的增殖均不利,前者是苗的复壮周期不足所致,后者是生长高峰期已过或培养基中营养成分不足所致。
4 结论
a.分化培养的最佳培养基为MS+6-BA 2.0 mg·L-1+IBA 0.3 mg·L-1+GA31.5 mg·L-1,分化率可达95.92%。
b.基本培养基和不同激素都会对分化率产生影响,在4个因素中,基本培养基和6-BA是影响分化率的主要因素,IBA和GA3是次要因素。
c.不定芽增殖系数最高的培养基组合与分化培养筛选的最佳培养基相同,增殖系数可达4.14。
d.继代周期为30 d时,增殖效果最好。
[1]黄普华,邵忠文,卓丽环.我国东北地区蓝靛果的初步研究[J].自然资源研究,1982(1):57-62.
[2]李恒,邢桂菊,廉美丹.药用植物-蓝靛果[J].中国林副特产, 2002(10):45-49.
[3]向延菊,王大伟.蓝靛果忍冬的研究利用现状及其发展前景[J].塔里木农垦大学学报,2004,16(4):26-29.
[4]Jin C,Cao H N,Zong C W,et al.Research on tissue culture and rapid propagation technology of superior individuals ofLonicera edulisTurcz[J].Agricultural Science&Technology,2011,12 (11):1585-1588.
[5]Ding M,Feng R,Wang S Y.Cyanidin-3-glucoside,anatural prod⁃uct derived from black bery,exhibits chemopreventive and chemo⁃therapeutic activity[J].Joumal of Biological Chemistry,2006,281: 17359-17368.
[6]赵越,霍俊伟,王立娟.蓝靛果的组织培养及植株再生[J].植物生理学通讯,2003,39(5):468-470.
[7]梁琦兰,张启昌,杨振国,等.蓝靛果忍冬芽体组织培养技术研究[J].北华大学学报,2012,7(6):25-27.
[8]杨振国,张启昌,孙广仁.蓝靛果组培快繁技术研究[J].湖北农业科学,2012,52(3):706-707.
[9]李桂君,李艳霞,卢慧颖,等.俄罗斯耐寒蓝靛果忍冬组织培养技术研究[J].林业科技,2012,37(4):219-220.
[10]梁钻姬,潘超美,赖珍珍,等.药用植物华泽兰组织培养和快速繁殖[J].植物生理学报,2012,48(1):85-89.
Screening and optimization ofLonicera edulisdifferentiation culture
LI Fuheng1,QU Di1,ZHAO Hengtian2,ZHU Huijie1,YANG Hongsheng1,XU Qinghua1,LI Nanding1(1. School of Life Sicences,Northeast Agricultural University,Harbin 150030,China;2.Northeast Institute of Geography andAgricultural Ecology,ChineseAcademy of Sciences,Harbin 150081,China)
Lonicera edulisstrain,designated strain L1-8 that provided by Chinese Academy of Science,Northeast Institute of Geography and Agricultural Ecology Institute,was applied as material in this research.The dormant branches of axillary buds were used as explants for germination.The medium(MS, White,WPM,A3),hormone IBA(0.1,0.2,0.3,0.4 mg·L-1),6-BA(1.0,1.5,2.0,2.5 mg·L-1)and GA3(0.5,1.0, 1.5,2.0 mg·L-1)were applied for the four factors-four levels orthogonal experiment which in order to optimize the best differentiation medium and provide technical support for the perfection of tissue culture technology ofLonicera edulismicropropagation.The results showed that MS medium containing 2.0 mg·L-16-BA,0.3 mg·L-1IBA and 1.5 mg·L-1GA3(The differentiation rate was 95.92%)was screened as the optimum differentiation medium.The basic medium and the different hormone both could affect the differentiation rate. In the four factors,the basic medium and 6-BA were the main factors affected the differentiation rate, whereas IBA and GA3were the secondary factors.Screened on different culture combinations had different effects on multiplication.The multiplication was as high as 4.14 with the best growth.Subculture cycle was 30 d and the effect on multiplication was the best.
Lonicera edulis;differentiation;culture;orthogonal test;multiplication
S663.9
A
1005-9369(2014)07-0073-06
时间2014-7-7 8:14:37 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140707.0843.019.html
李富恒,曲迪,赵恒田,等.蓝靛果忍冬分化培养基的优化筛选[J].东北农业大学学报,2014,45(7):73-78.
Li Fuheng,Qu Di,Zhao Hengtian,et al.Screening and optimization ofLonicera edulisdifferentiation culture[J].Journal of Northeast Agricultural University,2014,45(7):73-78.(in Chinese with English abstract)
2013-12-13
国家外国专家局2013年度引进国外技术、管理人才项目(20132300046)
李富恒(1962-),男,教授,博士,研究方向为植物生理生化。E-mail:lifuheng1963@126.com

