OsDREB3大豆品系特异性巢式PCR及多重PCR检测方法的建立
刘营,张明辉,甄贞,李璐,高学军*
(1.农业部转基因生物产品成分监督检验测试中心,哈尔滨 150030;2.东北农业大学农业生物功能基因重点实验室,哈尔滨 150030)
OsDREB3大豆品系特异性巢式PCR及多重PCR检测方法的建立
刘营1,2,张明辉1,2,甄贞1,2,李璐1,2,高学军1,2*
(1.农业部转基因生物产品成分监督检验测试中心,哈尔滨 150030;2.东北农业大学农业生物功能基因重点实验室,哈尔滨 150030)
为建立转基因大豆OsDREB3巢式PCR检测方法和转基因大豆多重PCR检测方法,选择转基因大豆GTS40-3-2、A2704-12及OsDREB3 DNA作为多重PCR方法的待检测基因模板,成功实现3种转基因大豆、4组不同片段同时扩增和检测。结果表明,可视性好,检测下限达0.1%。转基因大豆OsDREB3巢式PCR方法所用引物满足品系特异定性检测方法要求,其检测灵敏度达0.005%。
转基因大豆;OsDREB3;品系特异性;巢式PCR;多重PCR
转基因大豆种植面积在全球持续扩大[1-2],抗逆转基因大豆由于抗逆性能受到关注。改良现有大豆抗逆性,选育耐旱、耐盐转基因大豆新品种已成为转基因大豆品种改良的重要课题[3]。本研究采用的OsDREB3是将水稻中分离得到的抗逆基因转入大豆得到的品种,提高大豆抗逆性。
国际贸易和各国食品、生物安全等部门对转基因产品实施IP(Identity preservation)管理,加强转基因成分安全性检测监控[4]。我国有关抗除草剂及抗虫转基因大豆检测方法已成熟并建立相应检测标准[5-10],而有关抗逆基因的转基因大豆检测技术标准尚未建立。为便于对即将商品化的转基因大豆OsDREB3进行安全监管和检测,本试验建立转基因大豆OsDREB3品系特异性巢式PCR检测方法及多重PCR检测方法,以期建立快速、低检测下限的OsDREB3转基因大豆检测方法。
1 材料与方法
1.1 材料
所用转基因大豆OsDREB3由东北农业大学大豆研究所提供;其他转基因品种由农业部转基因生物产品成分监督检验测试中心保存;非转基因大豆购自黑龙江唯农种子公司。
1.2 试剂与仪器
rTaq DNA聚合酶、dNTP、DNA Marker DL 2000、Clontech Genome WalkerTMUniversal Kit试剂盒、定量PCR所需试剂均购自大连宝生物工程有限公司;DNA纯化试剂盒购自Axygen公司;引物合成和测序由北京华大基因有限公司完成。
高速离心机(购自上海安亭,TDL-40B)、PCR仪(购自德国Biometra,Biometra Tgradient)、核酸电泳仪(购自杭州大和热磁,GE-100)、紫外分光光度仪(购自美国BECKMAN,DU®640)、凝胶成像系统(购自美国UVP,G8000)、核酸蛋白分析仪(购自DU 640,Beckman coulter)。
1.3 方法
1.3.1 DNA提取
称取100 mg研磨成粉末状样品材料,按CTAB法提取样品总DNA[11]。提取总DNA溶于100 μL ddH2O中,测定其浓度后,最终稀释成100 ng·μL-1备用。用紫外分光光度计测定DNA溶液的OD260与OD280值,并计算OD260/OD280值来评价提取DNA的质量,本研究中所用DNA的OD比值均在1.9左右。
1.3.2 品系特异性巢式PCR引物设计
采用Primer 5.0软件进行引物设计,由北京华大基因科技有限公司合成。根据OsDREB3边界序列[3]分别设计2对巢式定性PCR检测引物,所扩增片段应覆盖OsDREB3外源基因边界序列及大豆基因组序列,从而品系特异性定量扩增有效。引物设计原理见图1。引物序列如表1。

图1 巢式PCR引物设计原理Fig.1 Nested PCR primer design schematics

表1 巢式PCR所用引物Table 1 List of primers in nested PCR
1.3.3 多重PCR引物设计
转基因大豆引物的设计以NCBI GenBank序列为基础。依据大豆内标准基因lectin基因序列(Gen⁃Bank序列号:K00821);转基因大豆A2704-12(GenBank序列号:CS447634.1);转基因大豆GTS40-3-2(GenBank序列号:AB209952.1),多重PCR所用引物应遵循不同产物大小不同,差别较大原则,同时考虑品系特异原则设计引物。利用Primer Premier V5.0软件设计引物。序列见表2。
1.3.4 品系特异性巢式PCR灵敏度的确定
将转基因大豆OsDREB3和非转基因大豆按不同质量比混合,使样品转基因的含量分别达到0.5%、0.1%、0.05%、0.01%、0.005%、0.001%,对含混合DNA样品进检测方法行灵敏度测试。
1.3.5 多重PCR灵敏度的确定
将3种转基因大豆等质量混合后与非转基因大豆按不同质量比混合,使样品转基因的含量分别达到1%、0.8%、0.6%、0.4%、0.1%、0.05%,对含混合DNA的样品进行灵敏度测试。

表2 多重PCR所用引物Table 2 List of primers in triplex PCR
2 结果与分析
2.1.1 巢式PCR定性检测结果
转基因大豆OsDREB3巢式PCR定性检测结果如图2~3所示。

图2 第1轮巢式PCR结果Fig.2 Result of the first nested-PCR
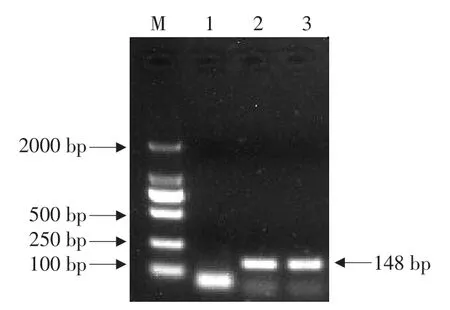
图3 第2轮巢式PCR结果Fig.3 Result of the second nested-PCR
2轮PCR扩增条带清晰可见,说明所设计特异的内外引物均可作为转基因大豆OsDREB3巢式PCR品系特异性检测引物。
2.1.2 巢式PCR定性检测结果灵敏度分析
转基因大豆OsDREB3巢式PCR定性检测灵敏度分析结果如图4所示。
当DNA样品阳性含量在0.005%及以上可扩增出清晰条带,当DNA样品阳性含量在0.001%未见条带扩增,由此图可确定巢式PCR定性检测检测下限为0.005%。

图4 多重巢式PCR灵敏度分析Fig.4 Sensitivity analysis by the multiple PCR
2.2 多重PCR定性检测方法的建立
2.2.1 转基因大豆多重PCR定性检测
把握为实现中华民族伟大复兴的中国梦而奋斗的时代主题,是我国工人阶级主力军作用的重要体现,也是工会组织围绕中心服务大局、体现价值彰显作为的重要途径。各级工会要把统一思想、凝聚力量作为思想政治工作的重要任务。要坚持以社会主义核心价值观引领广大职工,培育担当民族复兴大任的时代新人,深化“中国梦?劳动美”主题宣传教育,大力弘扬伟大民族精神和中华优秀传统文化,加强以职业道德为重点的“四德”建设,营造健康文明、昂扬向上的职工文化。
多重定性PCR产物电泳结果如图5所示,在同一PCR体系下,分别应用各自的特异引物,转基因大豆A2704-12、转基因大豆OsDREB3、转基因大豆GTS40-3-2均扩增出目的带,说明所设计引物均可作为3种转基因大豆多重PCR定性检测引物用。

图5 多重定性PCR分析Fig.5 Analysis by the multiple PCR
2.2.2 转基因大豆多重PCR定性检测灵敏度分析
3种转基因大豆多重PCR定性检测灵敏度如图6所示,转基因大豆样品含量在0.1%及以上时能扩增出较为清晰的4个目的基因,在0.05%时阳性混合标准品中只能扩增出lectin基因和转基因大豆Os⁃DREB3特异基因,说明多重PCR的灵敏度为0.1%。
3 讨论与结论
3.1 转基因大豆OsDREB3巢式PCR定性检测方法的建立
巢式PCR(Nested PCR)是在普通PCR基础上发展起来的一种PCR技术,这种方法不但减少假阳性出现,还使检测灵敏度提高。利用巢式PCR检测方法检测转基因大豆OsDREB3,首先根据其品系特异性DNA片段信息设计引物。针对本试验5′端旁侧序列信息设计一对内引物和一对外引物,外引物扩增片段为190 bp,内引物目的片段均为148 bp,避免扩增片段大导致假阴性结果和扩增片段小降低反应特异性的缺点。
该巢式PCR检测体系最终灵敏度应以第二轮PCR反应灵敏度(0.005%)为准,即巢式PCR检测体系可检出转基因大豆含量达0.005%以上样品,此检测体系灵敏度高于Zimmermann等用巢式PCR方法对转基因玉米进行检测所得灵敏度(0.01%)和闻伟刚等用半巢式PCR方法对转基因大米检测的灵敏度(0.01%)[12-13]。在理想状态下,用巢式PCR方法可检测到低于10-14g·μL-1DNA模板量。研究表明在实际检测过程中,有效模板量会低于其通过紫外分光光度计测定DNA模板量。尤其对于深加工产品来说,有效DNA损失会更加严重,用普通PCR检测时未能完全检出是否含有大豆成分和转基因大豆成分,即使检出,其重复性也不好。Martín-Sánchez等研究表明,巢式PCR方法具有高特异性和高灵敏度等特点[14],其结果无需验证,这是巢式PCR用于检测深加工转基因食品优点。
随着新型转基因转化体特异性增加,转基因产品检测方法将不断改进。而巢式PCR检测方法灵敏度是其他检测技术很难达到的,将是未来深加工产品的定性检测技术发展趋势。
3.2 转基因大豆多重PCR定性检测方法的建立
多重PCR技术是建立在传统PCR检测技术基础上快速简便检测手段,即在一个反应体系中含两对以上引物,通过PCR反应可同时检测多种目的核酸。目前国际上已广泛采用PCR方法进行转基因食品检验,要获得转基因作物的全面信息则需经过多次PCR检测,不但操作复杂,费用高,且潜在污染严重,由此限制PCR方法在常规检测中应用。多重PCR方法可通过一次扩增获得多个目标片段的信息,减少操作步骤和产物污染可能。
PCR扩增产物特异性,尤其是对于多重PCR反应体系都由所设计引物决定。该目的片段扩增结果和其他检测片段的扩增和检测结果都与每对引物相关,所要求的温度条件引物间差异不能太大,引物对间不能有太多的互补碱基数量,否则引起引物间相互缠绕形成引物二聚体,无法进行PCR反应,或达不到理想反应结果。本试验选择目前已列入农业部标准的具有代表性的3个转基因大豆品系,在一个体系内检测其共同的lectin内源基因和3个相应转化体事件。所设计的多重PCR检测用引物都是以品系特异性碱基片段为模板设计的,保证互补碱基数量少,且所有引物的最佳反应温度都是56℃,在同一温度条件下进行,确保多重PCR检测精确性。在引物设计过程中,充分考虑到所扩增片段长度,片段大小相差100多个碱基,范围为700~200 bp,可视性好。本试验建立的多重PCR转基因大豆检测体系检测灵敏度可达0.1%,与Lu建立的多重PCR检测体系灵敏度(1%)和Tian建立4重PCR检测转基因大豆检测灵敏度(0.25%和0.5%)相比较高[15-16]。整套合适的引物及配比方法,实现4组不同片段的同时扩增和检测。
本试验建立的转基因大豆多重PCR及巢式PCR检测体系,为我国转基因大豆标识制度的实施提供可靠的检测方法,该试验进行多次重复,具有良好的可重复性。其检测结果与普通定性PCR相比具有相同的稳定性及准确性,并且降低检测成本,缩短检测时间。
建立转基因大豆OsDREB3品系特异性巢式定性PCR检测方法,检测灵敏度为0.005%;建立转基因大豆A2704-12、转基因大豆OsDREB3、转基因大豆GTS40-3-2品系特异性多重PCR检测方法,检测灵敏度为0.1%。
[1]姜萍,王思明.转基因大豆技术发展动因探析[J].中国农学通报,2010,26(4):342-347.
[2]浦传亮,梁晋刚,高金玉,等.转胱硫醚-γ-合酶基因高蛋氨酸大豆对土壤细菌群落结构的影响[J].南京农业大学学报,2012,35(4):8-14
[3]刘营,张明辉,霍楠等.转基因大豆OsDREB3品系特异性定性PCR检测方法的建立[J].中国农业大学学报,2012,17(4): 34-39.
[4]Zimmermann A,Lüthy J,Pauli U.Event specific transgenic detec⁃tion in Bt11 corn by quantitative PCR at the integration site[J].Lebensm Wiss Technol,2000,33:210-216.
[5]农业部1485号公告-6-2010.中华人民共和国农业行业标准.转基因植物及其产品成分检测耐除草剂大豆MON89788及其衍生品种定性PCR方法[S].北京:中华人民共和国农业部,2010.
[6]农业部1485号公告-8-2010.中华人民共和国农业行业标准.转基因植物及其产品成分检测耐除草剂大豆A5547-127及其衍生品种定性PCR方法[S].北京:中华人民共和国农业部,2010.
[7]农业部1485号公告-7-2010.中华人民共和国农业行业标准.转基因植物及其产品成分检测耐除草剂大豆A2704-12及其衍生品种定性PCR方法[S].北京:中华人民共和国农业部,2010.
[8]农业部1782号公告-5-2012.中华人民共和国农业行业标准.转基因植物及其产品成分检测耐除草剂大豆CV127及其衍生品种定性PCR方法[S].北京:中华人民共和国农业部,2012.
[9]农业部1782号公告-1-2012.中华人民共和国农业行业标准.转基因植物及其产品成分检测耐除草剂大豆356043及其衍生品种定性PCR方法[S].北京:中华人民共和国农业部,2012.
[10]农业部1782号公告-4-2012.中华人民共和国农业行业标准.转基因植物及其产品成分检测高油酸大豆305423及其衍生品种定性PCR方法[S].北京:中华人民共和国农业部,2012.
[11]农业部1485号公告-4-2010.中华人民共和国农业行业标准.转基因植物及其产品成分检测DNA提取和纯化[S].北京:中华人民共和国农业部,2010.
[12]Zimmermann A,Hemmer W,Liniger M,et al.A sensitive detec⁃tionmethodforgeneticallymodifiedMaisGardTMcornusinganested PCR-system[J].Lebensm Wiss Technol,1998,31(7/8):664-667.
[13]闻伟刚,盛蕾,张吉红,等.痕量及微量转基因大米成分半巢式PCR检测方法的建立[J].食品科学,2008,29(12):622-626.
[14]Martín-Sánchez J,Viseras J,Adroher F J,et al.Nested polymer⁃ise chain reaction for detection of Thellerla annulata and compari⁃son with conventional diagnostic techniques:Its use in epidemiol⁃ogy studies[J].Parasitol Res.1999,85:243-245.
[15]Lu I J,Lin C H,Pan T M.Establishment of a system based on universal multiplex-PCR for screening genetically modifiedcrops [J].Anal Bioanal Chem.2010,396(6):2055-2064.
[16]Tian F,Wang X,Teng D,et al.Optimization of a multiplex PCR assay for detecting transgenic soybean components in feed products[J].Appl Biochem Biotechnol,2011,165(5-6):1225-1234.
Detecting method for event-specific nested-PCR and multiple PCR of OsDREB3 soybean
LIU Ying1,2,ZHANG Minghui1,2,ZHEN Zhen1,2,LI Lu1,2,GAO Xuejun1,2
(1.Superivision and Test Center(Harbin)for Molecular Characteristics of Genetically Modified Plants,Ministry of Agriculture,Harbin 150030,China;2.Key Laboratory of Agricultural Genomics,Northeast Agricultural University,Harbin 150030,China)
For the establishment of nested PCR detection method of transgenic soybeans OsDREB3 and multiplex PCR detection method of genetically modified soybeans,modified soybeans GTS40-3-2,transgenic soybean A2704-12 and GM soy OsDREB3 DNA were selected as gene templates of multiplex PCR method.Three kinds of genetically modified soybeans and four different fragments amplification could be detected simultaneously,and the sensitivity of multiplex PCR detection method was 0.1%.GM soybean OsDREB3 nested PCR primers were used to meet the requirements of event-specific qualitative detection methods,and the detection sensitivity was 0.005%.
transgent soybean;OsDREB3;event specific;nested PCR;multiple PCR
Q81;S565.1
A
1005-9369(2014)04-0007-05
2013-09-10
转基因生物新品种培育重大专项(2014ZX08004-002-002)
刘营(1976-),女,助理研究员,博士,研究方向为转基因检测技术。E-mail:lyneau@126.com。
*通讯作者:高学军,教授,博士生导师,研究方向为分子生物学与生物技术。E-mail:gaoxj5390@sina.com。
时间2014-4-21 13:24:39[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140421.1324.026.html
刘营,张明辉,甄贞,等.OsDREB3大豆品系特异性巢式PCR及多重PCR检测方法的建立[J].东北农业大学学报,2014,45(4)∶7-11.
Liu Ying,Zhang Minghui,Zhen Zhen,et al.Detecting method for event-specific nested-PCR and multiple PCR of OsDREB3 soybean[J].Journal of Northeast Agricultural University,2014,45(4)∶7-11.(in Chinese with English abstract)

