奶牛乳腺中调控乳脂合成关键基因表达分析
张娜,王小艳,李庆章,姜毓君
(东北农业大学乳品科学教育部重点实验室,哈尔滨 150030)
ZHANG Na,WANG Xiaoyan,LI Qingzhang,JIANG Yujun(Key Laboratory of Dairy Science,Ministry of Education,NortheastAgricuLtural University,Harbin 150030,China)
奶牛乳腺中调控乳脂合成关键基因表达分析
张娜,王小艳,李庆章*,姜毓君
(东北农业大学乳品科学教育部重点实验室,哈尔滨 150030)
采用荧光定量PCR检测高、低乳品质奶牛乳腺中调控乳脂合成重要功能基因的表达,检测乳脂合成关键酶活性。结果表明,ACC、ACSL1在高乳品质组和低乳品质组的表达量差异不显著(P>0.05),高乳品质组奶牛乳腺中FAS的表达量显著低于低乳品质组(P<0.05),高乳品质组奶牛乳腺中FAS酶活性显著高于低乳品质奶牛组(P<0.05),ACC酶活性二者差异不显著。FABP3、SCD和AGPAT6在高乳品质组的表达水平显著高于低乳品质组的表达量(P<0.05)。结果表明,ACC活性对于维持乳脂分泌至关重要,FAS活性以及FABP3、SCD和AGPAT6基因表达影响乳脂含量。
奶牛;乳腺;脂肪酸合成;荧光定量PCR
乳脂是乳中主要能量成分,决定乳汁多种物理性质和工艺特征,是评估乳及乳产品的感官指标。乳脂由甘油三酯(占乳脂含量96%~98%)和少量的甘油二酯和甘油一酯(0.02%)、游离脂肪酸(0.22%)和视黄醇组成[1]。乳中生成甘油三酯的脂肪酸超过400种,在4~18碳的脂肪酸中,cis-9,16∶1、油酸(oleic acid,OA)、trans-18:1和亚油酸(Linoleic acid,LA)含量最高[1]。乳中甘油三酯主要有两个来源,一是从外周循环血液吸收的脂肪酸;二是通过乳腺分泌细胞合成。根据奶牛品种、泌乳阶段和日粮的不同,从头合成的脂肪酸占牛奶中总脂肪酸的比例最少为0.60摩尔或按质计算为0.40[2]。本研究旨在排除外在环境和营养因素情况下,通过检测泌乳期高、低乳品质奶牛乳腺中调控乳脂合成关键基因的表达和关键酶活性分析,研究中国荷斯坦奶牛个体差异对乳脂合成影响,为提高或降低乳脂含量奠定试验基础并提供理论依据。
1 材料与方法
1.1 材料
试验动物为100头体重约550 kg,泌乳天数为(90±10)d,产奶量均为20 kg·d-1第二产健康中国荷斯坦奶牛,根据牛奶乳成分分析结果中乳蛋白和乳脂含量(见表1),随机挑选乳蛋白乳率、乳脂率高于国家标准的3头采样奶牛作为高乳品质奶牛组(H组),同时随机挑选乳蛋白乳率、乳脂率低于国家标准3头采样奶牛作为低乳品质奶牛组(L组)并以豆腐渣为主要原料制备基础饲粮,满足中国农业行业标准(NY/t34-2004)推荐营养需求。饲粮组成与营养水平如表2所示。
试验动物采用栓系式饲养。日榨乳2次,机器榨奶;每日喂精、粗饲料3次;时间5:00,11:00,17:00;保证试验期间精、粗饲料及营养水平一致。喂养3个月后,屠宰取奶牛乳腺组织-80℃冻存备用。

表1 奶牛乳成分分析Table 1 Composition of milk of dairy cows(%)
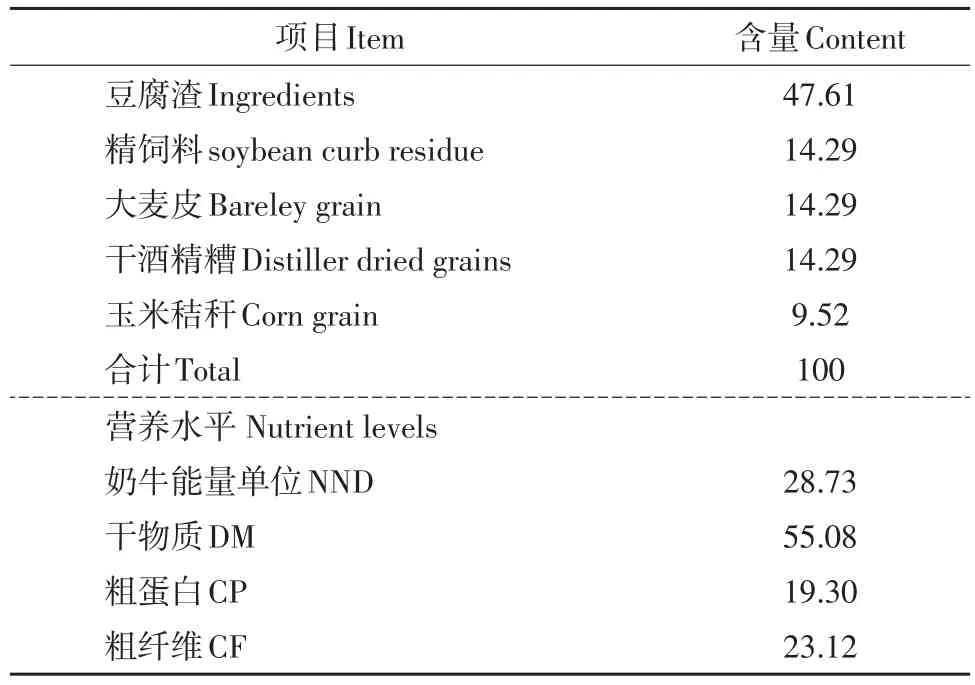
表2 饲粮组成与营养水平(以干物质为基础)Table 2 Composition and nutrient levels of basal diets(air-dry basis)(%)
1.2 荧光定量PCR
1.2.1 乳腺组织总RNA的提取
乳腺组织液氮研磨后,采用TRIzol法提取乳腺组织中总RNA。取1 μL RNA样用DEPC水1∶10稀释后,使用NanoDrop 2000紫外分光光度计测定RNA溶液浓度和纯度(OD260/OD280),所有样本比值要求在1.8~2.0,检测合格后,用于cDNA合成。
1.2.2 cDNA的合成
应用PrimeScriptTM RT试剂盒进行反转录合成cDNA。RT反应液在冰上配制,各组取出0.1 μg RNA,逆转录cDNA。
1.2.3 荧光定量PCR
应用Applied Biosystems 7300 real-time PCR System和SYBR Premix Ex TaqTM试剂盒进行荧光定量RT-PCR反应。反应体系20 μL,冰上配制反应液。根据荧光定量-PCR引物设计原则,使用Primer Premier 5.0和Oligo 6软件设计引物,并应用NCBI(National Center for Biotechnology Information)的BLAST功能进行同源性分析,保证引物的特异性,交由Invitrogen基因公司合成,乙酰辅酶A羧化酶(Acetyl-CoA carboxylase,ACC,E.C.6.4.1.2)、脂肪酸合成酶(Fatty acid synthase,FAS,E.C. 2.3.1.85)、长链乙酰CoA合成酶(Long chain ac⁃yl-CoA synthetases,ACSL)、脂肪酸结合蛋白3(Fat⁃ty acid binding protein 3,FABP3)、长链乙酰CoA合成酶硬脂酰辅酶A去饱和酶(Stearoyl-CoA desatu⁃rase,SCD,EC1.14.99.5)、1-酰基甘油-3磷酸酰基转移酶6(1-acyl glycerol 3-phosphate acyl transfer⁃ase 6,AGPAT 6),内参基因β-actin合成的引物序列如表3所示。

表3 荧光定量PCR引物Table 3 Primer pairs used to real-time PCR
1.2.4 荧光定量PCR基因扩增效率
模板cDNA进行10倍浓度稀释,设置5个浓度梯度,每个梯度为4个副孔。加入引物。一般为5个梯度,根据仪器给出曲线和方程计算扩增效率。
1.3 关键酶活性的检测
SCD、ACC、FAS活性的测定方法依据试剂盒说明书进行。试剂盒根据酶联免疫吸附法(ELISA)双抗体加心法原理测定酶活性。
1.4 数据分析
2 结果与分析
2.1 总RNA浓度和质量
各组奶牛提取的总RNA浓度较高,OD260/OD280均在1.8~2.0,说明RNA纯度较好(表4)。
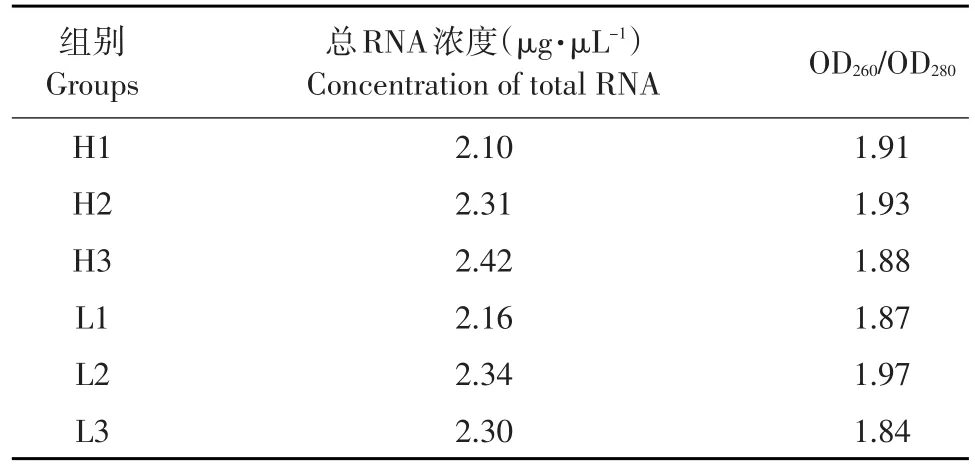
表4 各组奶牛总RNA浓度和质量Table 4 Concentration and quality of total RNA in different groups of dairy cows (%)
2.2 调控乳脂合成重要功能基因和内参基因的熔解曲线、扩增曲线和扩增效率
本试验各检测基因的熔解曲线均是单一峰,表明PCR产物单一(见图1)。
图1 Real-time PCR的溶解曲线和扩增曲线Fig.1 Solubility curves and amplification curves of Real-time PCR
本试验采用双delta法检测乳脂合成重要功能基因相对表达,内参基因与目的基因的扩增效率必须一致或相近。如表5所示,目的基因与内参基因的扩增效率均在95%~105%且相差不差过5%,扩增效率较好,不需要更换引物。
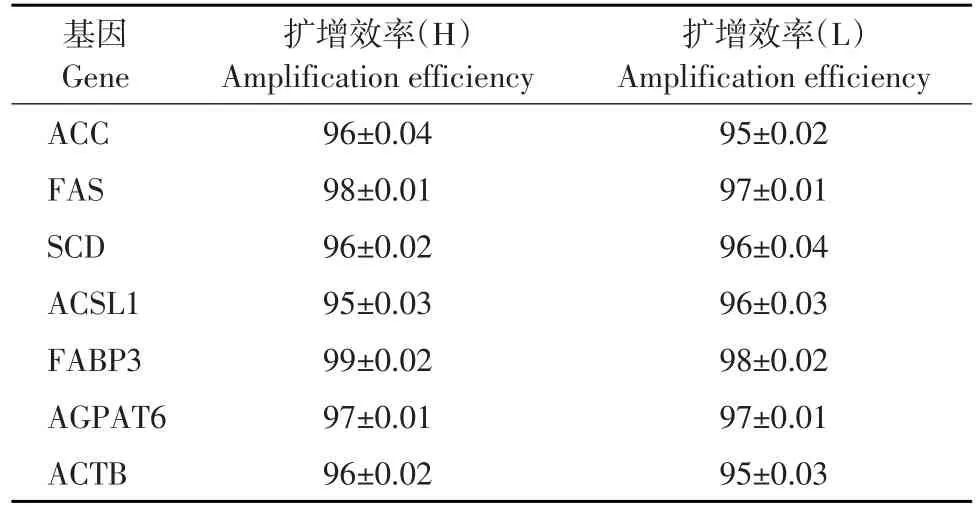
表5 荧光定量PCR的扩增效率Table 5 Determination of real-time PCR amplification efficiency(%)
2.3 调控乳脂合成重要功能基因mRNA的相对表达量
如图2所示,高乳品质组奶牛乳腺中FAS的表达量显著低于低乳品质组(P<0.05)。ACC、ACSL1在高乳品质组和低乳品质组的表达量差异不显著(P>0.05)。FABP3、SCD和AGPAT6在高乳品质组表达水平显著高于低乳品质组的表达量(P<0.05)。
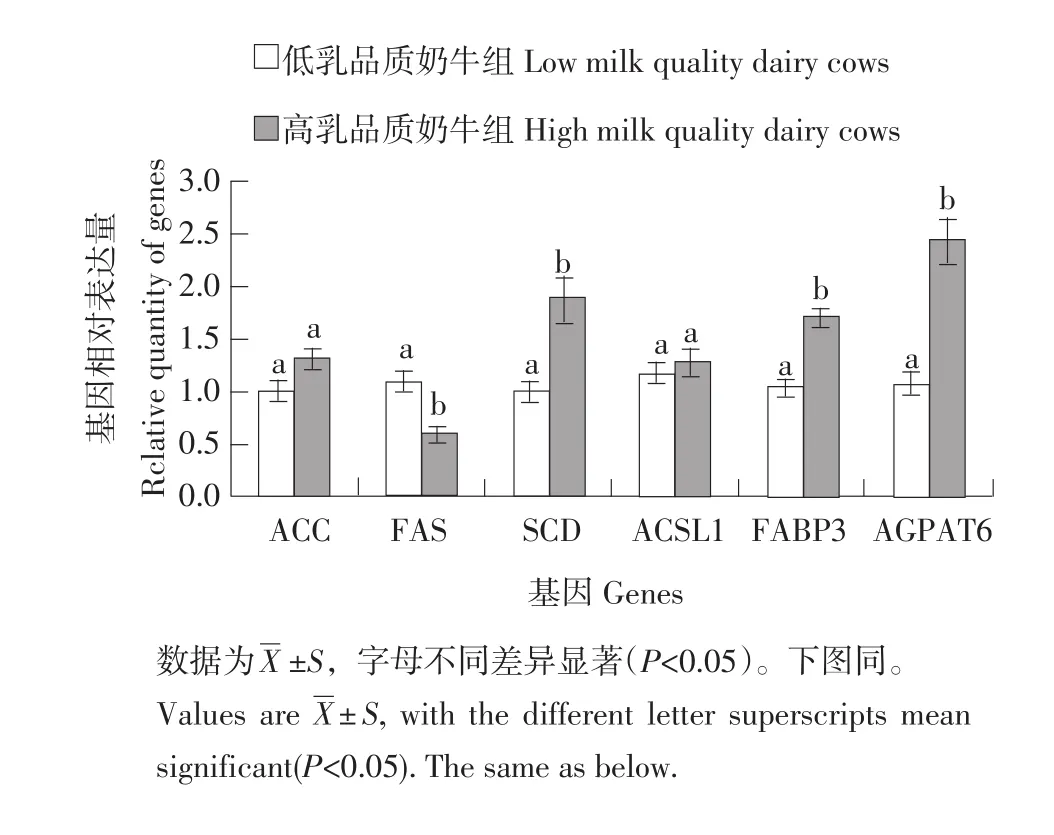
图2 乳脂合成相关重要功能基因的mRNA水平的检测Fig.2 Expression of functional genes related to the synthesis of lipids
2.4 乳脂合成关键酶活性
本研究测定脂肪酸合成酶(FAS)、硬脂酰辅酶A去饱和酶(SCD)、乙酰辅酶A羧化酶(ACC)3种酶在高、低乳品质奶牛乳腺组织中的活性。由结果可知(见图3),ACC酶活性在高乳品质组和低乳品质组中差异不显著(P>0.05)。FAS、SCD在高乳品质组的活性显著高于低乳品质组(P<0.05)。
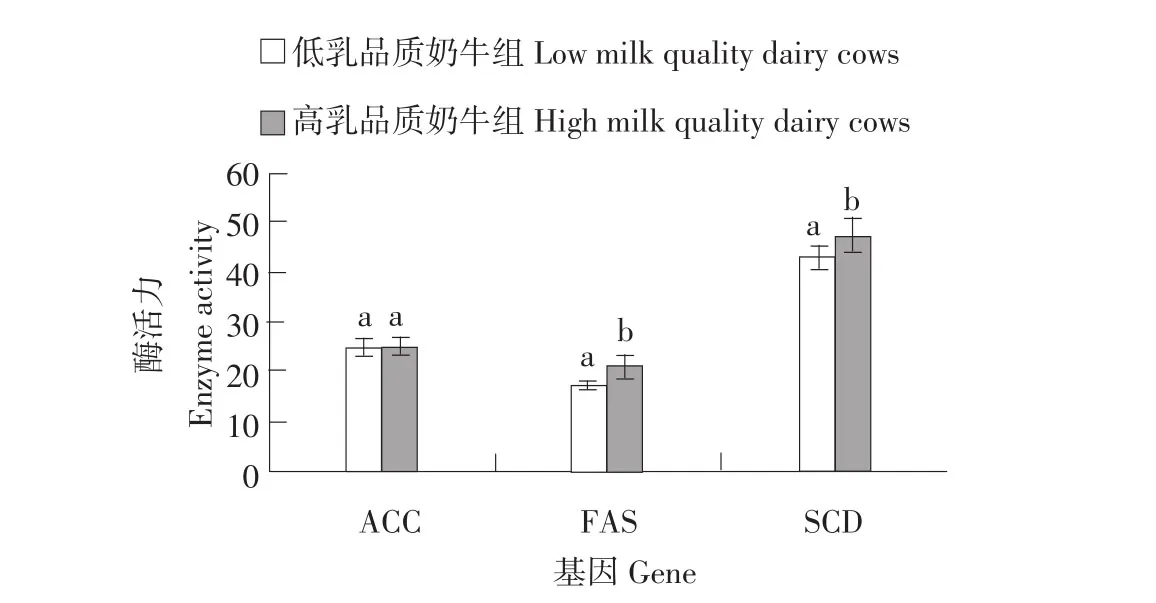
图3 乳脂合成关键酶的活性检测Fig.3 Activity assay of key enzymes related to synthesis of lipids
3 讨论与结论
本试验对供试奶牛所采取饲养方式基本一致,即采用固定舍饲和日粮组成基本稳定,没有明显改变喂养方式。试验结果中,虽然ACC、AC⁃SL1在高乳品质组和低乳品质组的表达量差异不显著(P>0.05),而且高乳品质组奶牛乳腺中FAS的表达量显著低于低乳品质组(P<0.05),但是高乳品质组奶牛乳腺中FAS酶活性显著高于低乳品质奶牛组(P<0.05),ACC酶活性二者差异不显著。乳腺上皮细胞利用乙酸和β-羟丁酸合成短链和中链脂肪酸,乳腺中从头合成所有的4到12碳的脂肪酸,绝大多数的14碳(14∶0.95%)和大约50%的C16∶0分泌到乳汁内,然而18碳和更长链的脂肪酸被认为从循环血液中获得[3]。脂肪酸的从头合成需要乙酰CoA存在,同时需要2种关键酶乙酰CoA羧化酶(ACC)和脂肪酸合酶(FAS),并且由NADPH提供还原当量[4]。乳腺合成脂肪酸最初的4碳单位由乙酸和β羟丁酸提供。乙酸在胞浆中生成乙酰CoA,并通过丙二酰单酰CoA途经,在脂肪酸合成时为碳链的延长提供碳原子。而β羟丁酸进入乳腺上皮细胞后直接转化为丁酰CoA。由ACC催化,乙酸转化为乙酰CoA是脂肪酸合成的限速步骤。本试验结果中,ACC活性在两个试验组中差异不显著,说明ACC活性对于维持乳脂分泌至关重要,而高乳品质组奶牛中FAS活性显著升高,说明FAS活性对乳脂含量高低至关重要。
FABP3、SCD和AGPAT6在高乳品质组的表达水平显著高于低乳品质组的表达量(P<0.05)。脂肪酸结合蛋白(Fatty acid binding protein,FABP)和长链乙酰CoA合成酶(Long chain acyl-CoA synthetas⁃es,ACSL)是在体外乳腺细胞培养、转基因脂肪酸转运蛋白和基因敲除小鼠模型中,发现的一系列在各种组织中参与长链脂肪酸吸收的候选蛋白。FABP和ACBP是非反刍动物细胞中主要的脂肪酸穿膜转运蛋白,可使特定的长链脂肪酸转运到特定的细胞器上[5]。长链脂肪酸在细胞内参与代谢之前,先通过酯化作用生成酯酰CoA,脂肪酸激活主要通过ACSL亚型参与作用的ATP依赖机制[6]。一些ACSL(ACSL1、3、4和5)和FABP(FABP1、3、4、5和6)亚型在泌乳期奶牛乳腺组织中也有表达,并且ACSL1、FABP3、FABP4和FABP5在泌乳期表达量很大,但ACBP的mRNA的含量比较低,说明其在奶牛乳腺脂肪酸合成中作用很小[7]。本研究结果表明ACSL1和FABP3的表达量在高乳品质奶牛乳腺中显著高于低乳品质组。Bionaz and Loor研究表明,奶牛乳腺中ACSL1和FABP3参与协同调节运输脂肪酸合成甘油三酯[8]。
长链脂肪酸进入乳腺分泌细胞后去饱和,但是无证据表明乳腺摄取的脂肪酸可再延长[3]。乳腺上皮细胞中含有硬脂酰辅酶A去饱和酶(Stearoyl-CoA desaturase,SCD,EC1.14.99.5)复合物,通常简称为D-9脱氢酶,这种酶催化脂肪酰基辅酶A酯的氧化,进而在碳9和碳10之间引进顺式双键。SCD催化反应的底物包括细胞色素b5、NAD(P)-细胞色素b5还原酶、分子氧以及脂酰辅酶A。反刍动物乳腺SCD活性维持和调控乳流动性,能保证乳汁从乳腺内高效流出[9]。硬脂酰辅酶A和棕榈酰辅酶A是SCD催化18∶0生成OA的主要前体物,在牛乳腺上皮细胞中SCD催化反应的主要产物是OA[10-11]。用于乳腺甘油三酯合成的49%~60%的18∶0脂肪酸发生去饱和作用,占分泌到乳汁内OA的60%[12-14]。SCD催化的反应产物贡献奶牛乳脂中约90%cis-9,14∶1和50%~56%的顺cis-9,16∶1[13]。许多其他饱和脂酰辅酶A也可以作为SCD底物,如C10∶0、C12∶0、C14∶0、C15∶0和C17∶0)[2,15]。64%~97%的cis-9,trans-11共轭亚油酸由SCD催化trans-11,18:1合成[10]。在奶牛乳腺内由13C标记的25%的trans-11,18:1去饱和生成cis-9,trans-11共轭亚油酸[16]。本试验中,高乳品质组SCD的基因表达量和酶活性均显著高于低乳品质组。本课题组发表的另一篇文章气相色谱检测高、低乳品质奶牛乳汁中脂肪酸含量结果显示,高乳品质组中脂肪酸C18∶2n6t、C18∶2n6c、C18∶3n6(γ-亚麻酸)含量显著高于低乳品质组[17]。SCD是催化饱和脂肪酸合成单不饱和脂肪酸的限速酶,所以高乳品质组奶牛乳汁中长链脂肪酸的含量较高。
从头合成脂肪酸,摄取的长链脂肪酸以及SCD产物共同形成合成甘油三酯的脂肪酸库。酯化脂肪酸通过3-磷酸甘油途径完成。1-酰基甘油-3磷酸酰基转移酶(1-acyl glycerol 3-phosphate acyl transferase,AGPAT,E.C.2.3.1.51)催化sn-2位置的脂肪酸酯化。AGPAT的8种亚型均在奶牛乳腺组织内表达,且AGPAT6、AGPAT1和AGPAT3表达量分别是AGPAT总mRNA的60%、18%和10%[7]。AGPAT6的表达最易受泌乳阶段的影响,在泌乳60 d奶牛乳腺组织AGPAT6的表达量是产前15 d表达量的15倍[8]。本试验结果表明,高乳品质组AG⁃PAT6基因表达量显著高于低乳品质组,说明AG⁃PAT6在乳脂合成中发挥重要作用。
[1]Jensen R G.The composition of bovine milk lipids:January 1995 to December 2000[J].J Dairy Sci,2002,85:295-350.
[2]Bauman D E,Davis C L.Biosynthesis of milk fat[M]//Larson B L, Smith V R.Lactation:A comprehensive treatise.London,U K:Ac⁃ademic Press,1974(2):31-75.
[3]Chilliard Y,Ferlay A,Mansbridge R M,et al.Ruminant milk fat plasticity:nutritional control of saturated,polyunsaturated,trans and conjugated fatty acids[J].Ann Zootech,2000,49:181-205.
[4]Barber M C,Clegg R A,Travers M T et al.Lipid metabolism in the lactating mammary gland[J].Biochimica et Biophysica Acta, 1997,1347:101-126.
[5]Doege H and Stahl A.Protein-mediated fatty acid uptake:novel insights from in vivo models[J].Physiology,2005,21:259-268.
[6]Watkins P A,Maiguel D,Zhenzhen J,et al.Evidence for 26 dis⁃tinct acyl-coenzyme A synthetase genes in the human genome[J]. J Lipid Res,2007,48:2736-2750.
[7]Bionaz M,Loor J J.Gene networks driving bovine milk fat synthe⁃sis during the lactation cycle[J].BMC Genomics,2008(9):366-387.
[8]Bionaz M,Loor J J.ACSL1,AGPAT6,FABP3,LPIN1,and SLC 27A6 are the most abundant isoforms in bovine mammary tissue and their expression is affected by stage of lactation[J].J Nutr, 2008,138:1019-1024.
[9]Timmen H,Patton S.Milk fat globules:fatty acid composition, size,and in vivo regulation of fat liquidity[J].Lipids,1988,23: 685-689.
[10]Palmquist D L,Lock A L,Shingfield K J,et al.Biosynthesis of conjugated linoleic acid in ruminants and humans[M]//Advances in food and nutrition research.New York:Elsevier Academic Press,2005:179-217.
[11]Bernard L,Leroux C,Chilliard Y.Expression and nutritional reg⁃ulation of lipogenic genes in the ruminant lactating mammary gland[M]//Bosze Z.Bioactive components of milk,advances in ex⁃perimental medicine and biology.New York:Springer Press, 2008:67-108.
[12]Enjalbert F,Nicot M C,Bayourthe C,et al.Duodenal infusions of palmitic,stearic or oleic acids differently affect mammary gland metabolism of fatty acids in lactating dairy cows[J].The J Nutr, 1998,128:1525-1532.
[13]Mosley E E,McGuire M A.Methodology for the in vivo measure⁃ment of the delta9-desaturation of myristic,palmitic,and stearic acids in lactating dairy cattle[J].Lipids,2007,42:939-945.
[14]Glasser F,Ferlay A,Doreau M,et al.Long-chain fatty acid metab⁃olism in dairy cows:A meta-analysis of milk fatty acid yield in re⁃lation to duodenal flows and de novo synthesis[J].J Dairy Sci, 2008,91:2771-2785.
[15]Shingfield K J,Chilliard Y,Toivonen V,et al.Trans fatty acids and bioactive lipids in ruminant milk[M]//Bosze Z.Bioactive com⁃ponents of milk,advances in experimental medicine and biology. New York:Springer Press,2008:35-65.
[16]Moshel Y,Rhoads R E,Barash I.Role of amino acids in transla⁃tional mechanisms governing milk protein synthesis in murine and ruminant mammary epithelial cells[J].J Cell Biochem,2006, 98:685-700.
[17]高学军,徐诗瑶,王小艳,等.泌乳中期不同乳品质奶牛乳中脂肪酸含量差异分析[J].东北农业大学学报,2013,44(9):7-11.
Analysis of expression of lipogenic genes in dairy cows mammary with different qualities milk/
Expression of lipogenic genes in the mammary of cows with different qualities milk were detected by real-time PCR,and mammary enzymes involved in milk fat synthesis were detected simuLtaneously.The results showed that the expression of ACC and ACSL1 in the high quality milk groups (H groups)and the low milk quality groups(L groups)were not significant difference(P>0.05),and the expression of FAS in H groups was significantly lower than the L groups(P<0.05).FAS activity in H groups was significantly higher than L groups(P<0.05),and the difference of ACC activity was not significant between H groups and L groups.The expression of FABP3,SCD and AGPAT6 in H groups were significantly higher than L groups(P<0.05).The results showed that ACC activity was essential for maintaining the secretion of milk fat,and FAS activity and FABP3,SCD and AGPAT6 affect fat content.
dairy cow;milk;fat acidsynthesis;real-time PCR
S852.21
A
1005-9369(2014)06-0084-07
时间 2014-6-11 16:07:27 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140611.1607.005.html
ZHANG Na,WANG Xiaoyan,LI Qingzhang,JIANG Yujun(Key Laboratory of Dairy Science,Ministry of Education,NortheastAgricuLtural University,Harbin 150030,China)
张娜,王小艳,李庆章.奶牛乳腺中调控乳脂合成关键基因表达分析[J].东北农业大学学报,2014,45(6):84-90.
Zhang Na,Wang Xiaoyan,Li Qingzhang,et al.Analysis of expression of lipogenic genes in dairy cows mammary with different qualities milk[J].Journal of Northeast Agricultural University,2014,45(6):84-90.(in Chinese with English abstract)
2013-12-20
国家重点基础研究发展(973)计划项目(2011CB100804);国家自然科学青年基金(31101784);东北农业大学博士启动基金(2012RCB15)
张娜(1981-),女,助理研究员,博士,研究方向为乳腺发育与泌乳生物学。E-mail:nazhang1981@126.com。
*通讯作者:李庆章,教授,博士生导师,研究方向为乳腺发育与泌乳生物学。E-mail:qzli@neau.edu.cn

