小米蛋白的营养消化性研究
徐婧婷, 刘思思, 刘 贺, 郭顺堂,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.北京市怀柔区卫生局卫生监督所,北京 101400)
小米蛋白的营养消化性研究
徐婧婷1, 刘思思2, 刘 贺1, 郭顺堂1,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;
2.北京市怀柔区卫生局卫生监督所,北京 101400)
采用体外模拟消化法分别对小米乳、小米醇提蛋白、小米分离蛋白进行营养消化性分析.研究发现,与对照大豆乳相比,小米乳中的蛋白质表现出较低的消化率,仅为35.2%.其中,小米蛋白主要成分之一醇溶蛋白是导致小蛋白消化率较低的主要原因.醇溶蛋白本身形成的二硫键以及其强烈的疏水性是导致其不被消化的关键因素.
小米蛋白;体外消化;消化率
粟类为世界第六大谷物,主要种植在亚洲、非洲.在中国,主要种植的粟类为谷子,谷子籽粒脱皮后的种仁称为小米(foxtailmillet),是我国北方地区主要粮食作物之一.小米的营养丰富、齐全,主要包括碳水化合物、蛋白质和氨基酸、脂肪酸等,各种营养素比例适宜,是良好的营养源.
蛋白质是生命活动不可缺少的物质基础.小米中的蛋白质主要贮存在胚和胚乳细胞中,属低过敏性蛋白,其成分主要包括:清蛋白、球蛋白、醇蛋白、谷蛋白和其他不溶性蛋白.不同小米品种之间蛋白质含量存在一定的差异.通过对我国上百种谷子样品进行分析得到,我国小米的蛋白质含量差异不大,均在10%~15%[1-3].通过分析小米蛋白的组成发现,其醇溶蛋白质含量最多,占总蛋白的60%左右[4].SDS-PAGE凝胶电泳分析得到,清-球蛋白组分中,有4条带最为明显,分别是54,34,22,12 ku;醇溶蛋白组分中,也有4条带,分别是23,21,18,12 ku;而谷蛋白则有多条组分带[4].进一步分析了小米醇溶蛋白片段的氮端氨基酸序列,认为19~27 ku部分富含亮氨酸和丙氨酸,14~17 ku部分富含蛋氨酸和半胱氨酸,小米醇溶蛋白与玉米醇溶蛋白具有较高的同源性[5].对氨基酸含量进行分析,发现小米中谷氨酸含量最高,亮氨酸、天门冬氨酸、丙氨酸、苯丙氨酸、缬氨酸、脯氨酸含量较多[6].小米的必需氨基酸(除色氨酸外)占蛋白质的42.03%,必需氨基酸指数(EAAI)为76.22,高于其他粮食;多数必需氨基酸的氨基酸评分值(AAS)均大于100,能满足人体的需求[3].与多数谷物类似,小米的第一限制性氨基酸为赖氨酸,而与富含赖氨酸的豆类蛋白不同,将两者混合食用会使必需氨基酸的盈缺得到互补.
小米蛋白具有重要的生理功能.谷类籽粒蛋白质能显著提高血浆中高密度脂蛋白的浓度,具有抗动脉粥样硬化的功能.同时谷类籽粒蛋白质对胆固醇的新陈代谢也有一定调整作用,并且进一步的研究发现,蛋白质对由D-半乳糖胺导致的肝损伤具有修复作用.将试验小鼠喂养小米蛋白质14 d后,可以抑制血清天冬氨酸转氨酶、丙氨酸转氨酶和乳酸脱氢酶活性的提高[5,7].通过研究小米酸不溶性蛋白对CCl4所致小鼠肝损伤动物模型的保肝作用,发现小米酸不溶性蛋白确实具有保肝疗效[8].通过建立大鼠十二指肠溃疡模型证明了小米饮食可提高胃粘膜屏障的完整性,小米和大米饮食可增加胃粘膜组织中前列腺素E2含量,对实验性大鼠十二指肠溃疡愈合作用优于面粉饮食[9].与此同时,通过研究自制小米多肽的体外抗氧化性并进行小鼠实验,证实了小米多肽具有明显的免疫调节作用[10].另有对小米蛋白中的其他功能成分的研究,发现小米蛋白中含有不少具有淀粉酶活性及抗菌活性的蛋白质成分.尽管已有研究对小米蛋白组成、氨基酸组成和生理功能进行了详尽的分析,但其蛋白的营养消化性仍未知.同时,大量试验证明,与小米蛋白同源性较高的高粱蛋白具有较强的抗消化性.因此,小米蛋白消化性如何,是否具有抗消化组分,小米蛋白消化产物具有何特征等均未见报道.因此,本课题通过模拟体外消化法,探讨小米蛋白的消化速度及难易程度,找出其不消化组分及原因,为小米蛋白的深加工利用提供一定理论依据.
1 材料与方法
1.1 材料与试剂
武乡小米,市售,购于北京;大豆,市售;胃蛋白酶(Pepsin,粉体,975单位/(mg蛋白))、胰蛋白酶(Trypsin,粉体,500单位/(mg蛋白))均为sigma公司产品;真菌淀粉酶VERON M4,德国AB酶制剂公司.
1.2 仪器与设备
KDY-9820型凯氏定氮仪,北京华威兴业科技有限公司;HZQ-F100型振荡培养箱,中国哈尔滨东联电子技术开发有限公司;FD-1型冷冻干燥机,北京博医康技术公司;MOEDL BE-210N型电泳槽,日本BIO-CRAFT公司;DYY-III8B型稳压稳流定时电泳仪,北京六一仪器厂;TS-1型脱色摇床,江苏海门市麒麟医用仪器厂;M218nfs型扫描仪,美国惠普公司;HR-G1型干胶仪,北京华瑞仪器有限公司.
1.3 方法
1.3.1 淀粉酶酶解小米乳水解度DE值测定
小米洗净,按料液比(g/mL)1∶2加水于100℃蒸煮20min,冷却后,10倍水打浆备用.将淀粉酶配制成1mg/mL溶液,向小米乳中加入不同剂量淀粉酶(按照淀粉酶添加量与淀粉含量质量比添加,添加量为400,600,800,1 000mg/kg).摇床37℃振荡反应,反应至15,30,45,60,90 min时,取出小米乳溶液离心(4 000 r/min,20 min),留上清液测定DE 值,0min即未加淀粉酶处理.配制A液:称取69.3 g硫酸铜(CuSO4·5H2O)溶于蒸馏水中,定容至1000mL;B 液:称取346 g酒石酸钾钠(NaC4H4O6·4H2O),100 g氢氧化钠溶于蒸馏水中,定容至1 000mL.DE值测定:取适量样液加蒸馏水至25 mL蒸馏水,置于250 mL三角瓶中,依次加A、B液各10mL,加热煮沸,保持微沸2 min.迅速冷却后依次加入质量分数为30%的碘化钾10 mL,26%硫酸10 mL,1%淀粉溶液2mL,用标定过的0.1 mol/L硫代硫酸钠滴定至蓝色消失.其中,空白样以蒸馏水代替样液.
1.3.2 小米醇提蛋白的提取
取脱脂小米粉,加入体积分数为70%的乙醇,料液比1∶5,搅拌1.5 h,温度30℃,离心(4 000 r/min,20min),取上清液,重复一次.向提取液中加入0~4℃的冷盐水稀释至原体积的3倍,缓慢加入并搅拌,使最终溶液中氯化钠质量分数为0.3%,在0~4℃冰箱中静置1 d使蛋白沉淀,水洗涤沉淀数次,冷冻干燥备用.
1.3.3 小米分离蛋白的提取
取脱脂小米粉,加入蒸馏水,料液比1∶5,用0.1 mol/L NaOH调溶液pH值为9.5,搅拌1.5 h,温度30℃,离心(4 000 r/min,20min),取上清液,重复一次.调整提取液 pH值为4.2,静置 0.5 h,离心(1 000 r/min,5min),取沉淀并水洗沉淀数次,得到的沉淀加水调pH值为7.0复溶,冷冻干燥备用.
1.3.4 大豆乳的制备
将大豆以1∶3的料液比在4℃冰箱里浸泡12 h,使其充分溶胀.去掉多余的水分后,再以1∶5的料液比碾磨2min,加入消泡剂以除去泡沫,在铺有脱脂棉的布氏漏斗上抽真空过滤,得到的滤液即为生豆乳.将生豆乳置于沸水浴中搅拌加热,直至豆乳内部温度上升至90℃后保持10min,再于冰水浴中冷却至室温,保存备用.
1.3.5 小米乳体外模拟消化
分别制备不同条件下的小米乳或小米蛋白溶液,用1 mol/L的HCl将溶液的pH值调到2.0,加入质量分数为1%的胃蛋白酶,在37℃条件下振荡消化2 h,酶解液用1 mol/L的NaOH将pH值调到7.4,加入质量分数为1%胰蛋白酶在37℃条件下继续振荡消化.分别消化0,15,30,60,120min后取出样品,80℃加热20 min灭酶,离心(4 000 r/min, 20min)后残渣、上清液分别冻干备用.
1)小米乳:小米洗净,按料液比1∶2加水于100℃蒸煮20min,冷却后,10倍水打浆,再用淀粉酶酶解1 h.其中,以大豆乳作为对照实验.
2)小米醇提蛋白:将小米醇提蛋白冻干粉配制成0.2 g/L的溶液,充分分散,于100℃水浴加热20 min.
3)小米分离蛋白:将小米分离蛋白冻干粉配制成0.2 g/L的溶液,充分分散,于100℃水浴加热20 min.其中,上清液置于-18℃保存备用,沉淀用于SDS-PAGE(Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis)电泳.
1.3.6 亚硫酸氢钠处理小米醇提蛋白体外模拟消化
取200mg小米醇提蛋白粉,加入2mL 0.5mol/L NaHSO3溶液于沸水浴中加热煮制20 min,冷却至37℃,加蒸馏水35mL.用1mol/L的HCl将溶液的pH值调到2.0,加入质量分数为1%的胃蛋白酶,在 37℃条件下振荡消化2 h,酶解液用1 mol/L的NaOH将pH值调到7.4,加入质量分数为1%胰蛋白酶在37℃下继续振荡消化.分别消化0,15, 120 min后取出样品,80℃加热20 min灭酶,离心(4 000 r/min,20min)后残渣冻干备用.另取200mg小米醇提蛋白粉,加入2mL 0.5mol/L NaHSO3溶液室温下反应.空白组不添加消化酶.
1.3.7 SDS-PAGE电泳
将蛋白冻干粉(以蛋白含量计2~5 mg)加入1.5mL的离心管中,加入0.5mL的含有20%甘油, 0.2%SDS-PAGE,0.063 mol·L-1Tris-HCl(pH 6.8)的样品处理液,再添加0.36 g尿素,20μL饱和溴酚蓝溶液,20μL巯基乙醇,加蒸馏水使总体积为1 mL,充分混合均匀,静置过夜后进行电泳.采用BE -210N型垂直平板电泳装置,胶板厚1mm.分离胶质量分数12.5%,交联度2.7%;浓缩胶质量分数4%,交联度2.7%.电泳缓冲液含有5mmol/L Tris, 38.4mmol/L甘氨酸和0.1%SDS-PAGE.样品上样量为5μL.电泳过程中,浓缩胶部分保持电流15 mA,进入分离胶后,电流为25 mA.电泳结束后,电泳胶片用含33%甲醇和12%三氯乙酸(TCA)的固定液固定4 h,然后用考马斯亮蓝G-250染色液染色3 h.染色结束后,用蒸馏水对胶片脱色,直至底色基本脱去为止.用惠普扫描仪扫描,干胶仪干胶.
1.3.8 凯氏定氮法
取0.3 g醇溶蛋白、分离蛋白,分别放入消化管中,向管中加入 0.50~0.55 g催化剂(K2SO4及CuSO4·5H2O混合物(3∶1)),10 mL H2SO4.轻轻摇匀,放入消化炉中消化,在消化管口放一小漏斗.用电炉以小火加热,待内容物全部炭化,泡沫停止产生后,加大火力,保持瓶内液体微沸,至液体变蓝绿色呈澄清透明后,再持续加热30 min.冷却,小心用蒸馏水冲洗小漏斗,冷却至室温.使用半自动凯氏定氮仪对样品进行蒸馏.用标定过的0.1 mol/L的HCl滴定.每个样品做3个平行.
消化率计算公式如下:

2 结果与分析
2.1 小米乳淀粉水解度的测定结果
在小米胚乳细胞中,淀粉以单个淀粉粒的形式存在且排列紧密.小米蛋白体则是蛋白质的主要存在形式,位于淀粉粒之间的空隙或“镶嵌”在淀粉粒之间[6].蛋白体与淀粉粒之间紧致的空间关系是影响蛋白质或淀粉消化率的重要原因.当淀粉遇水在高温下发生糊化作用时,因淀粉粒的快速膨胀将进一步挤占蛋白体的空间,使蛋白酶与蛋白体更不易接触,从而降低消化率.糊化后的黏稠液体也使得蛋白消化物分离变得更加困难.因此,在小米乳进行体外模拟蛋白消化前,先与淀粉酶作用,结果如图1.在各剂量组下,最初的15 min内,淀粉水解度迅速提高,至60 min后,上升速度呈缓慢增加趋势或与之前持平.600剂量组与800剂量组、1 000剂量组相比,淀粉水解度相差不大,DE值仅由15.03上升至16.47,差异不显著(P>0.05).观察经淀粉酶作用的小米乳状态,高温灭酶后,与未经淀粉酶处理的样品相比,已由黏稠液体状变为水样状态.
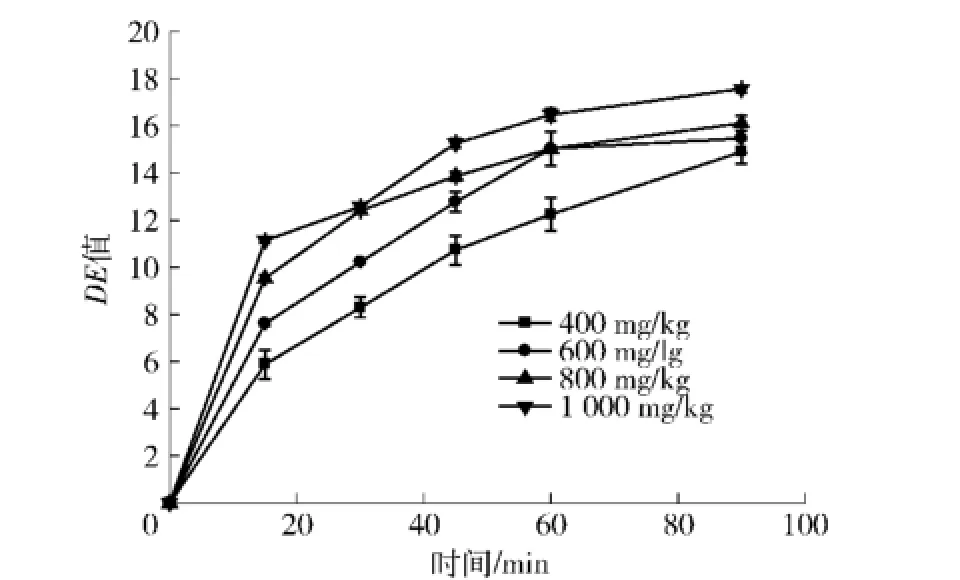
图1 小米乳淀粉水解度变化情况Fig.1 Hydrolysis curve of foxtailmillet starch
2.2 小米乳模拟体外消化结果
将经过淀粉酶处理的小米乳进行体外模拟消化,其蛋白消化率变化如图2,即小米乳经淀粉酶、胃蛋白酶作用2 h后,消化率值由空白组1.4%上升至20.2%.在胰蛋白酶消化的过程中,小米乳消化率呈缓慢上升趋势,在开始的1 h内,水解消化已达到极限值两小时胰蛋白酶模拟消化后,消化率值从20.2%上升至35.2%.仅从消化率值增加来看,胃蛋白酶对小米蛋白具有更高的消化效率.以大豆乳作为对照实验时发现,无论是仅经过胃蛋白酶消化,还是经过胃蛋白酶-胰蛋白酶的联合消化,小米乳的消化率都要低于大豆乳(表1).
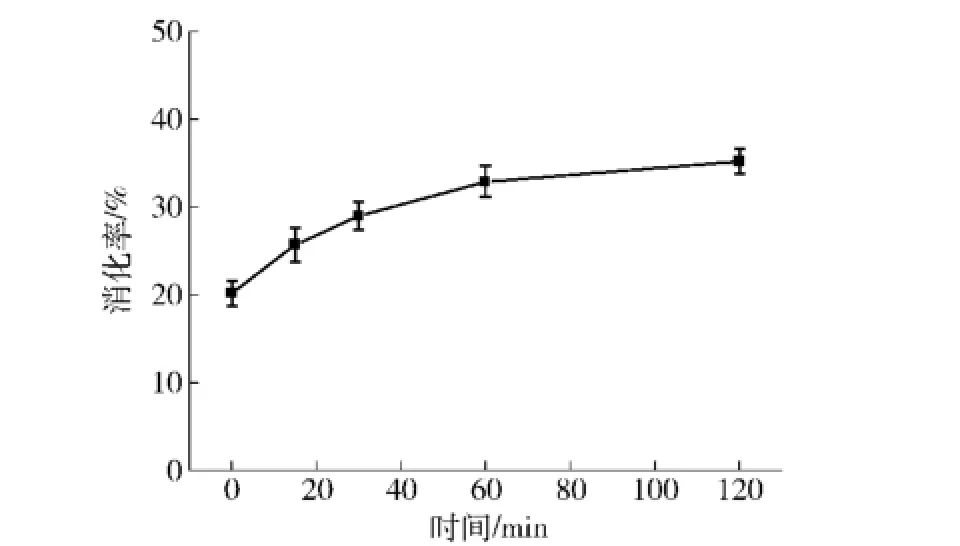
图2 小米乳的胰蛋白酶体外模拟消化情况Fig.2 In vitro trypsin digestion curve of foxtailmillet

表1 小米乳与大豆乳的体外模拟消化率Tab.1 In vitro protein digestibility of foxtailmillet and soy
进一步分析小米乳残渣中的蛋白成分(图3)发现,随着胰蛋白酶水解的进行,18~21,23,15,12 ku段条带始终无变化且条带明显,这些组分与有关报道的小米醇溶蛋白分布区域类似[6].

图3 小米乳消化残渣SDS-PAGE电泳图Fig.3 SDS-PAGE electrophoresis of foxtailmilletdigestion residues
2.3 小米分离蛋白和小米醇溶蛋白和体外模拟消化
由于小米乳中各种成分较多,体系比较复杂,因此,将分离纯化得到的小米分离蛋白和小米醇提蛋白分别进行胃蛋白酶-胰蛋白酶体外模拟消化,电泳观察其蛋白消化情况,见图4、图5.
从图4可以发现,小米分离蛋白在经过胃蛋白-胰蛋白酶模拟消化后,大部分条带已经消失,只有小分子区域段还存在部分模糊条带.而图5显示的小米醇提蛋白则基本没有变化,各部分条带清晰,仅18~21 ku区域条带颜色稍有减弱(取样量相等),可认为该部分有少部分蛋白被消化.可见,醇溶蛋白确实是小米蛋白消化率低的主要原因,蛋白酶几乎无法与其作用.
有研究发现,高粱醇溶蛋经蒸煮后蛋白体结构仍保持完好,甚至更不易被胃蛋白酶所消化.这可能是因为在蛋白体周围形成一层通过二硫键结合的蛋白质外壳缘故,或是因为二硫键形成而导致蛋白体外围的内层在热的作用下进行一种名为“韧化作用(toughening)”的缘故引起的[11].因此,为进一步证明小米醇溶蛋白不消化的原因,本研究选择将小米醇溶蛋白进行NaHSO3处理,再进行体外模拟消化,SDS-PAGE电泳谱图如图6.结果发现,经NaHSO3处理过的醇溶蛋白在12 ku、15 ku区域段条带依然明显,但23 ku、18~21 ku区域大部分条带消失,这说明二硫键的存在是导致小米醇溶蛋白不消化的原因之一.而将醇提蛋白在生、熟不同阶段分别进行NaHSO3处理时,其残渣蛋白电泳条带并无差异,证明在蒸煮过程中,亚基间并没有形成新的二硫键.由于说明小米醇溶蛋白本身具有的二硫键才是影响其消化率的关键因素之一.与此同时,虽然经过了NaHSO3处理,但仍有部分条带依然无法被消化酶酶解消化,这说明除了二硫键,还有其他因素影响小米醇溶蛋白消化性.

图4 小米分离蛋白消化残渣SDS-PAGE电泳图Fig.4 SDS-PAGE electrophoresis of foxtailmillet protein isolate digest residues
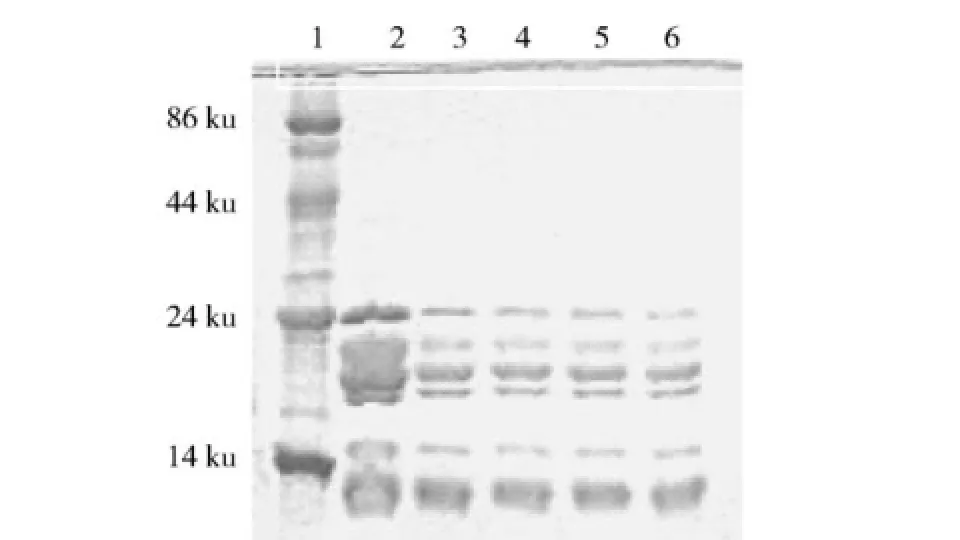
图5 小米醇提蛋白消化残渣SDS-PAGE电泳图Fig.5 SDS-PAGE electrophoresis of foxtailmillet prolamine digest residues
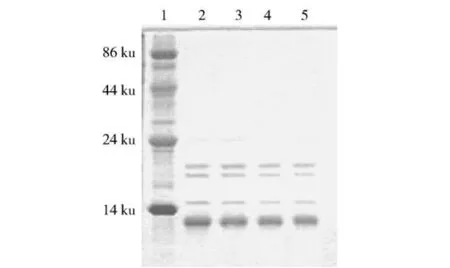
图6 NaHSO3处理小米醇提蛋白消化残渣SDS-PAGE电泳图Fig.6 SDS-PAGE electrophoresis of foxtailmillet prolamine digest residues treated by NaHSO3
3 讨 论
研究发现,小米乳蛋白的体外模拟消化率并不高.而且由于本实验仅对小米乳进行了模拟体外消化,其他各成分对小米蛋白消化性的影响未知,也无法模拟其他成分的消化.值得注意的是,小米的植酸含量为3.54~7.96mg/g,而大米的植酸含量仅为1.00~1.35mg/g[12].植酸因有6个磷酸基团而具有较强极性,螯合能力强,可与金属离子及蛋白质发生螯合作用形成不溶性复合物从而降低其生物利用率.酚酸类物质除因含有羟基可与蛋白质结合之外,在中性至碱性条件下,酚酸类物质还会被氧化形成高氧化活性物质,氧化蛋白质氨基酸残基而致其聚合,影响其生物利用率[13].
小米醇溶蛋白作为小米储藏蛋白约占总蛋白含量的60%,而在消化过程中,醇溶蛋白基本不被消化.除了以上讨论过的二硫键外,疏水性也是导致其不被消化的重要原因.小米的全蛋白氨基酸含量分析表明,谷氨酸含量最高,亮氨酸、天门冬氨酸、丙氨酸、苯丙氨酸、缬氨酸、脯氨酸含量较多[6].其中,只有谷氨酸与天门冬氨酸为亲水性氨基酸,其他氨基酸均为疏水性氨基酸.因含有较多的疏水性氨基酸,小米醇溶蛋白强烈疏水.由于蛋白酶主要在亲水性环境中发挥作用[14-15],而小米醇溶蛋白疏水性强,酶与醇溶蛋白间难以接触,不能充分发挥效果,这也是导致其低消化率的原因.
4 结 论
利用体外模拟消化法进行小米乳模拟消化时,与对照大豆乳相比,小米乳中的蛋白质表现出较低的消化率,仅为35.2%.其中,作为小米蛋白主要成分的醇溶蛋白为小米蛋白不被消化的主要原因.醇溶蛋白本身形成的二硫键以及其强烈的疏水性是导致其不被消化的关键因素.同时,小米中其他化学成分也与小米蛋白的低消化率相关.
[1] 古世禄,刘厦.中国谷子蛋白质氨基酸组成的研究[J].华北农学报,1989,4(1):8-15.
[2] 李庆春,黎裕,曹永生,等.小米蛋白质含量和氨基酸组成及对其蛋白质品质的评价[J].中国粮油学报, 1994,12(9):7-13.
[3] 杨春,栗红瑜,邓晓燕,等.小米蛋白质的氨基酸组成及品质评价分析[J].农产品加工·学刊,2008(12): 8-10.
[4] Kumar K K,Parameswaran PK.Characterisation of storage protein from selected varieties of foxtailmillet(Setaria italica(L)Beauv)[J].Journal of the Science of Food and Agriculture,1998,77(4):535-542.
[5] Kohama K,Naqasawa T,Nishizawa N.Polypeptide compositions and NH2-terminal amino acid sequences of proteins in foxtail and proso m illets[J].Bioscience,Biotechnology,and Biochemistry,1999,63(11):1921-1926.
[6] 赵学伟,魏益民,王章存,等.小米蛋白质的理化特性研究[J].粮食与饲料工业,2011,12(7):34-37.
[7] Nishizawa N,Sato D,Ito Y,et al.Effects of dietary protein of proso millet on liver injury induced by D-galactosamine in rats[J].Bioscience,Biotechnology,and Biochemistry,2002,66(1):92-96.
[8] 许洁,王常青,赵陈勇,等.小米酸不溶性蛋白抗四氯化碳肝损伤的研究[J].食品科学,2011,32(15): 251-254.
[9] 张锦华.不同饮食对大鼠十二指肠溃疡愈合的影响及胃粘膜的保护作用[J].胃肠病学,2002,7(1):30-32.
[10] 刘剑利,曹向宇,李其久,等.小米多肽对小鼠免疫调节作用[J].中国公共卫生,2012,28(1):44-45.
[11] 张伟敏,肖祖能,钟耕.高粱蛋白质消化率研究进展[J].粮食与油脂,2004(9):14-17.
[12] 吴澎,田纪春,王凤成.谷物中植酸及其应用的研究进展[J].中国粮油学报,2009,24(3):137-143.
[13] Damodaran S.Amino acids,peptidesand proteins[C]∥Fennema,O R(ed).Food Science and Technology. New York:Marcel Dekker,1996:414-415.
[14] Duodu K G,Taylor JR N,Belton PS,et al.Factors affecting sorghum protein digestibility[J].Journal of Cereal Science,2003,38(2):117-131.
[15] Duodu K G,Nunes A,Delgadillo I,et al.Effect of grain structure and cooking on sorghum and maize in vitro protein digestibility[J].Journal of Cereal Science, 2002,35(2):161-174.
Nutrition and Digestion Study of M illet Protein
XU Jingting1, LIU Sisi2, LIU He1, GUO Shuntang1,*
(1.College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China; 2.Huairou Sanitation Supervision Institution,Beijing 100083,China)
In vitro protein digestion was used to analysis the digestibility ofmilletmilk,foxtailmillet prolamine andmillet protein isolate.Compared with soybeanmilk,the foxtailmillethad a low protein digestibility(only 35.2%),which wasmainly caused by foxtailmillet prolamine.Disulphide crosslinking and its strong hydrophobicity were the key factors.
millet protein;in vitro digestion;digestibility
TS210.1
10.3969/j.issn.2095-6002.2014.04.004
2095-6002(2014)04-0015-06
(责任编辑:叶红波)
2014-06-30
徐婧婷,女,博士,主要从事蛋白质加工与利用方面的研究;
*郭顺堂,男,教授,博士,主要从事蛋白质综合利用方面的研究.通讯作者.
徐婧婷,刘思思,刘贺,等.小米蛋白的营养消化性研究.食品科学技术学报,2014,32(4):15-20. XU Jingting,LIU Sisi,LIU He,etal.Nutrition and digestion study ofmillet protein.Journal of Food Science and Technology,2014,32(4):15-20.

