急性脑出血大鼠肠屏障功能的变化
张继龙,武国艳,汪连珍,李立为,王智超
急性脑出血大鼠肠屏障功能的变化
张继龙,武国艳,汪连珍,李立为,王智超
目的:研究急性脑出血对肠粘膜屏障功能的影响。方法:成年雄性Wistar大鼠60只,随机分为脑出血组和对照组各30只。脑出血组采用立体定向技术将大鼠自体尾动脉不抗凝动脉血液50 μL缓慢注入尾状核制备脑出血模型,对照组注射等量生理盐水。2组分别于造模前和造模后0.5、3、6、12、24 h检测血浆二胺氧化酶(DAO)活性和D-乳酸(D-Lac)浓度,于造模前和造模后12、24 h检测血浆内毒素(LPS)浓度;造模后24 h取空肠l cm,光镜下观察肠粘膜。结果:与对照组比较,脑出血组造模后12、24 h DAO活性和造模后6、12、24 h D-Lac浓度及造模后12、24 h LPS浓度明显增高,差异有统计学意义(<0.05或<0.01)。光镜下观察,脑出血组小肠存在病理性损伤,对照组小肠结构正常。结论:急性脑出血早期即发生肠屏障功能障碍。
急性脑出血;肠屏障功能;二胺氧化酶;D-乳酸;内毒素
急性脑出血对机体来说是一个急性强刺激,可引起全身应激,引发多个器官的病理生理改变,甚至多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)。肠道被认为是机体应激的中心器官,在MODS的形成中具有重要作用。大量研究证实,肠道不仅是MODS的“受损”器官,又是MODS的“始动”器官[1],因此保护肠屏障结构和功能的完整性是有效防治MODS的重要环节[2]。脑出血应激引起的消化道症状在临床上很常见[3-5],如应激性溃疡、肠麻痹、腹泻等,但排除其他干扰因素从动物实验建立脑出血模型研究是否存在肠道粘膜屏障改变尚未见报道。因此,本研究避开缺氧、感染等因素影响,观察大鼠脑出血能否引起肠屏障功能的改变。
1 材料与方法
1.1 实验动物
健康成年清洁级雄性Wistar大鼠60只,体质量(240±20)g,均由华中科技大学同济医学院实验动物中心提供。动物分笼饲养,自由活动。随机分为脑出血组和对照组各30只。
1.2 方法
1.2.1 脑出血模型制备 参照Deinsberger等[6]的方法制备大鼠脑出血模型。①麻醉:术前 24 h禁食,8 h禁水。10%水合氯醛(350 mg/kg)腹腔麻醉。②生命体征检测:麻醉后气管插管,多参数监测仪监测心电、呼吸,右股动脉持续监测血压;保持舌下血氧饱和度>95%,如低于95%则经气管插管吸氧;置入胃管。③模型制作:将其俯卧位固定在立体定位仪,调节门齿托的高度,使大鼠前、后囟处于同一水平,沿头皮正中切一长约10 mm切口,无菌操作暴露前囟,定位于前囟前0.2 mm,中线向右旁开3 mm处钻一直径为0.5 mm的小孔,进针深度为5.5 mm(即尾状核位置)。断尾取血50 μL,立即注入更换微量注射器内,血液静置5 min使之充分凝固。用微量进样器在8~10 min内缓慢、多次、少量注入,注血结束后留针10 min缓慢退针,局部用骨蜡封闭后缝合皮肤。所有操作均在无菌条件下进行,术毕将大鼠放回笼中饲养,自由活动进食水。对照组注射等量生理盐水,其余同脑出血组。④营养:所有大鼠通过胃管给予肠内营养,24 h共鼻饲肠内营养混悬液250 mL(速度约70 mL/h),间断给予生理盐水鼻饲(300 mL/24 h),静脉给予10%葡萄糖、林格氏液或生理盐水,入液量每 24 h 100 mL/kg,总能量摄入30 kcal/kg。
1.2.2 标本采集和检测 2组分别在造模前和造模后0.5、3、6、12、24 h抽血,装入肝素抗凝管,取血 3 mL,4℃低温离心机,3 000转/分,离心15 min,分离血浆,取上清液1 mL,-70℃保存备用,集中检测血浆二胺氧化酶(diamine oxidase,DAO)、D-乳酸(D-lactate,D-lac)。2组分别在造模前和造模后12、24 h共3个时间点抽血,应用经过去热源肝素化处理的内毒素(lipopolysaccharide,LPS)专用试管,取血3 mL,4℃低温离心机,离心15 min,在超净台内严格无菌操作,分离血浆,取上清液1 mL,放入同样的试管,-70℃保存备用,集中检测LPS。脑出血组所有大鼠于造模后24 h标本采取完毕后,行脑组织切片,证实脑出血。
1.2.3 肠标本制备 2组大鼠造模后24 h取空肠l cm,生理盐水冲洗,10%甲醛固定,备用HE染色。
1.3 统计学处理
采用SPSS 18.0软件分析数据,计量资料以(均数±标准差)表示,重复计量资料的方差分析、配对 检验,<0.05为差异有统计学意义。
2 结果
2.1 大鼠脑出血模型观察
脑出血组所有大鼠清醒后均出现拖步行走、肢体偏瘫、旋转爬行等,造模后24 h脑组织切片证实脑出血,说明造模成功,见图1。对照组大鼠未出现神经缺损症状,脑内亦无血肿形成。
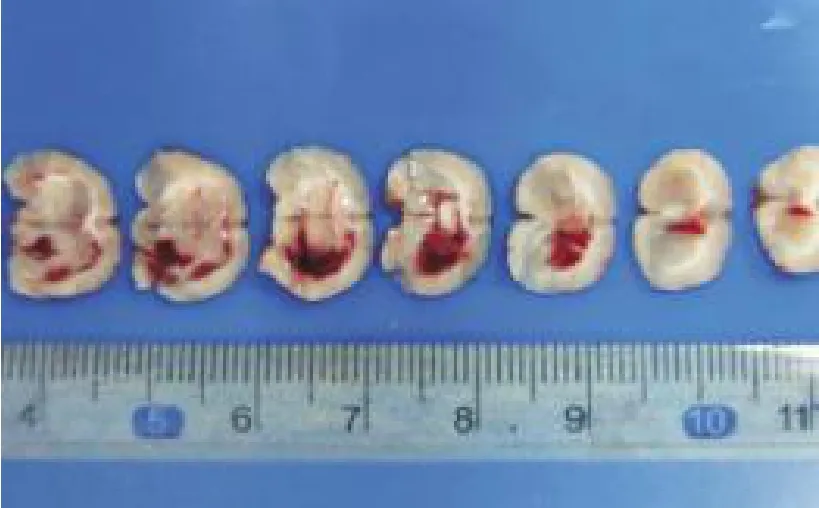
图1 脑出血组大鼠造模24 h后脑组织切片
2.2 血浆DAO活性变化
脑出血组的血浆DAO于造模前、造模后0.5、3、6 h与对照组比较差异无统计学意义(>0.05);造模后12 h高于对照组,差异有统计学意义(<0.05);造模后24 h高于对照组,有显著性差异(<0.01),见表1。
表1 2组各时间点血浆DAO活性结果比较(U/mL,±s)
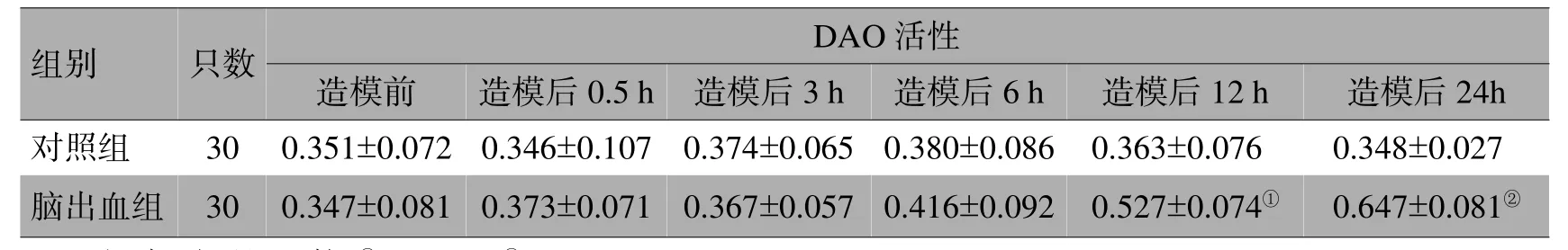
表1 2组各时间点血浆DAO活性结果比较(U/mL,±s)
注:与对照组比较,①<0.05,②<0.01
组别只数DAO活性造模前造模后0.5 h造模后3 h造模后6 h造模后12 h造模后24h对照组300.351±0.0720.346±0.1070.374±0.0650.380±0.0860.363±0.0760.348±0.027脑出血组300.347±0.0810.373±0.0710.367±0.0570.416±0.0920.527±0.074①0.647±0.081②
2.3 血浆D-lac浓度变化
脑出血组的血浆D-lac于造模前、造模后0.5、3 h与对照组比较差异无统计学意义(>0.05);造模后6 h高于对照组,差异有统计学意义(<0.05);造模后12、24 h高于对照组,有显著性差异(<0.01),见表2。
表2 2组大鼠各时间点血浆D-lac活性变化比较(μg/mL,±s)
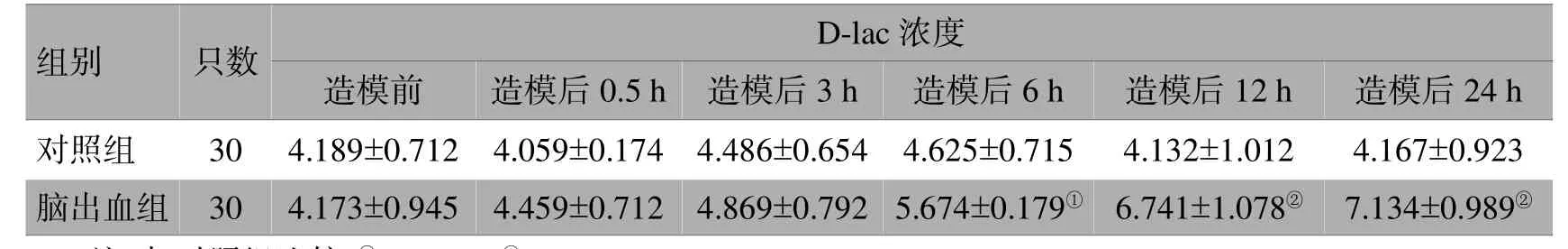
表2 2组大鼠各时间点血浆D-lac活性变化比较(μg/mL,±s)
注:与对照组比较,①<0.05,②<0.01
组别只数D -l a c浓度造模前造模后0 . 5 h造模后3 h造模后6 h造模后1 2 h 造模后2 4 h对照组3 04 . 1 8 9 ± 0 . 7 1 24 . 0 5 9 ± 0 . 1 7 44 . 4 8 6 ± 0 . 6 5 44 . 6 2 5 ± 0 . 7 1 54 . 1 3 2 ± 1 . 0 1 2 4 . 1 6 7 ± 0 . 9 2 3脑出血组3 04 . 1 7 3 ± 0 . 9 4 54 . 4 5 9 ± 0 . 7 1 24 . 8 6 9 ± 0 . 7 9 25 . 6 7 4 ± 0 . 1 7 9①6 . 7 4 1 ± 1 . 0 7 8②7 . 1 3 4 ± 0 . 9 8 9②
2.4 血浆LPS浓度变化
表3 2组大鼠各时间点血浆LPS浓度比较(EU/mL,±s)

表3 2组大鼠各时间点血浆LPS浓度比较(EU/mL,±s)
注:与对照组比较,①<0.05,②<0.01
组别只数LPS浓度造模前造模后1 2 h 造模后2 4 h对照组3 00 . 3 7 8 ± 0 . 0 3 70 . 4 1 2 ± 0 . 0 6 2 0 . 3 9 1 ± 0 . 0 7 1脑出血组3 00 . 3 5 7 ± 0 . 0 6 50 . 7 0 8 ± 0 . 0 4 2①0 . 8 4 5 ± 0 . 3 2 1②
2.5 肠粘膜病理学改变
HE染色光镜下观察,对照组空肠结构正常,绒毛结构完整,呈高柱状上皮,间质无水肿,见图2A。脑出血组空肠可见部分绒毛水肿、断裂、脱落,固有层血管充血,中性粒细胞浸润及淋巴细胞浸润、少量柱状上皮坏死,肠腔炎性渗出,见图2B。
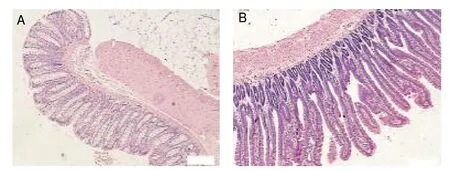
图2 对照组(A)、脑出血组(B)肠粘膜病理学改变(HE染色,×200)
3 讨论
脑出血时机体发生应激反应,肠道灌注急剧减少,肠粘膜水肿、糜烂,肠粘膜屏障功能破坏,细菌、毒素移位透过肠粘膜屏障,引起肠功能衰竭,诱发全身炎症反应。DAO是一种含有脱氨的腐胺和组胺的细胞内酶,主要分布在成熟的绒毛上皮,能准确反映肠粘膜的完整性、成熟度和损伤程度[7,8]。当肠粘膜遭受严重损伤,由于上皮破坏,DAO大量释放入血,可引起血浆DAO活性升高。本研究发现,脑出血组在造模后12、24 h血浆DAO活性明显高于假手术组(<0.05或<0.01),说明在脑出血时,即使没有明确的低血压、休克、缺氧和感染等,肠粘膜细胞仍然存在损伤。
哺乳动物既不产生D-lac,也不能或仅能缓慢代谢D-lac,正常情况下血中其水平很低。人体内的D-lac主要由胃肠道的细菌发酵产生,肠道菌群中多种细菌均可产生。当肠道发生急性应激致缺血时,局部细菌大量繁殖,破坏肠粘膜生物屏障,肠粘膜通透性增加。此时,肠道细菌产生的大量D-lac透过受损肠粘膜经循环进入血液,使血液中D-lac水平升高。因此检测其外周血水平可间接反映肠粘膜损害程度和通透性变化[9,10]。本研究表明,造模后6、12、24 h脑出血组D-lac浓度高于假手术组(<0.05或<0.01),说明D-lac能较早反映肠粘膜损伤。
LPS是革兰阴性菌的外膜成分。由于健全的肠道屏障作用,LPS被限制在肠腔内,并不进入体循环。当机体处于缺血、创伤、烧伤或受到电离辐射后,肠道屏障功能易遭受破坏,而发生严重的LPS移位,使得血中的LPS浓度增高,而内毒素血症是肠粘膜损害的突出表现,肠源性内毒素血症又可以导致肠道功能进一步受损,形成恶性循环。同时在临床中,LPS的检测较血液细菌培养迅速、简便,可早期诊断肠粘膜损害。本研究显示,造模后12、24 h,脑出血组LPS浓度高于对照组(<0.05或<0.01),说明脑出血组存在肠屏障损害。
综上所述,大鼠脑出血时存在肠屏障功能障碍,提示脑出血时应尽早干预及调整肠道功能,对改善预后有积极意义。
[1]Leaphart CL,Tepas JJ 3rd.The gut is a motor of organ system dysfunction [J].Surgery,2007,141: 563-569.
[2]Gomersall CD,Joynt GM,Freebairn RC,et al.Resuscitation of critically ill patients based on the results of gastric tonometry:a prospective,randomized,controlled trial[J].Crit Care Med,2010,28:607-614.
[3]杨胜.重症脑出血并发胃肠道功能衰竭的临床研究[J].中国医疗前沿,2011,6:49-50.
[4]沈衡升,李珺,杨倩.重症脑出血急性期肠道功能的临床研究 [J].中日友好医院学报,2010,24: 84-86
[5]闫豫萍.高血压性脑出血并发胃肠衰竭的回顾分析 [J].中西医结合心脑血管病杂志,2008,6: 996-997.
[6]Deinsberger W,Vogel J,Kuschinskey W,et al. Experimental intracerebral hemorrhage.Description of a double injection model in rats[J].Neurol Res,1996, 18:475-477.
[7]Tsunooka N,Maeyama K,Hamada Y,et al.Bacterial translocation secondary to small intestinal mucosal ischemia during cardiopulmonary bypass.Measurement by diamine oxidase and peptidglycan[J].Eur J Cardiothorac Surg,2004,25:275-280.
[8]Wollin A,Navert H,Bounous G.Effect of intestinal ischemia on diumine oxidase activity in rat intestinal tissue and blood[J].Gastroenterology,1981,80: 349-355.
[9]蔡元坤,秦新裕.D-乳酸与肠道屏障功能[J].国外医学外科学分册,2004,31:331-335.
[10]Kamei H,Hachisuka T,Nakao M,et al.Quick recovery of serumdiamine oxidase activity in patients undergoing total gastrectomy by oral enteral nutrition [J].Am J Surg,2005,189:38-43.
Changes of Intestinal Barrier Function of Rats with Acute Cerebral Hemorrhage


Objective:To observe the changes of intestinal barrier function of rats with acute cerebral hemorrhage.Methods:Sixty Wistar rats were randomly divided into cerebral hemorrhage group and control group with 30 rats in each group.The cerebral hemorrhage model was established by stereotactic infusing 50 μL autologous caudate artery blood.The control group were only infused with equal normal saline.The concentration of plasma diamine oxidase(DAO)and activity of D-lactate(D-lac)in plasma were measured before operation and 0.5,3,6,12,24 h after operation.The concentration of plasma Lipopolysaccharide (LPS)was measured before operation and 12,24 h after operation.The jejunums(1 cm)of the both groups were taken at 24 h after operation,and light microscopic examination was performed for morphological measurement of intestinal epithelial cells.Results:Compared with those in the control group,the DAO and LPS concentrations at 12,24 h and the D-lac levels at 6,12,24 h after operation were significantly increased in the cerebral hemorrhage group (<0.05 or 0.01).Under the light microscope,intestinal mucosal injuries were observed in the cerebral hemorrhage group whereas no obvious changes occurred in the control group.Conclusion:Intestinal barrier function was damaged in the early stage of cerebral hemorrhage.
acute cerebral hemorrhage;intestinal barrier function;diamine oxidase;D-lactate;Lipopolysaccharide
R741;R743.34
A DOI 10.3870/sjsscj.2014.02.005
武汉市第一医院急诊科武汉430022
2014-01-21
武国艳zhangjilong73@163. com

