环氧合酶-2基因-1195G>A多态性位点与缺血性脑卒中患者阿司匹林抵抗的相关性
陈忠云,李珊珊,李婧,徐志伟,杨旭
阿司匹林广泛应用于卒中的一、二级预防。研究表明,高危险因素的脑血管病患者,服用阿司匹林可降低25%的非致死性卒中[1]。然而,部分长期服用阿司匹林的患者,心脑血管事件的发生率并未降低,可能在一定程度上存在阿司匹林抵抗(aspirin resistance,AR)现象[2,3]。研究表明,遗传因素在抗血小板药物实验室反应中起重要作用[4]。环氧合酶(cyclooxygenase,COX)为阿司匹林的主要作用靶点,近年有关COX-2基因多态性与AR的相关报道较多,但大多研究基于-765G>C位点[5],关于-1195G>A位点的研究较少。基于此,本研究探讨COX-2基因-1195G>A多态性与缺血性脑卒中(ischem ic stroke,IS)患者AR的相关性。
1 资料与方法
1.1 一般资料
收集2011年12月至2013年6月我科收治的IS患者210例,均符合2010年中华医学会神经病学分会发布的急性IS诊断标准[6],并经头颅CT和/或MRI证实,均为中国北方汉族,男123例,女性87例;平均年龄(64.96±12.57)岁;排除感染及血液系统性疾病,近1周未使用其他抗血小板药物,如氯吡咯雷、华法林等。本研究经我院伦理委员会审查批准,所有患者均签署知情同意书。
1.2 方法
参考Gum等[7]提出的实验室诊断标准,以 10μmoL/L二磷酸腺苷(adenosine diphosphate,ADP)诱导的血小板聚集率≥70%;以0.5mg/m L花生四烯酸(arachidonic acid,AA)诱导的血小板聚集率≥20%。2项都符合,为AR(n=17);符合其中1项,为阿司匹林半抵抗(aspirin sem i-resistance,ASR)(n=46);2项都不符合,为阿司匹林敏感(aspirin sensitive,AS)(AS组,n=147)。因AR患者较少,故与ASR患者合并为非AS组。全部患者住院次日清晨空腹抽取肘静脉血,用全自动分析仪测定甘油三酯(triglyceride,TG)、胆固醇(Cholesterol,Cho)、低密度脂蛋白(low-density lipoprotein,LDL)、高密度脂蛋白(high-density lipoprotein,HDL)等指标。受试者清晨另空腹采肘静脉血2m L,枸橼酸钠-K2抗凝,按照DNA提取试剂盒(购于北京天根公司)操作,提取全血标本DNA,-80℃保存备用。采用TaqExpress软件(购于美国ABI公司)设计引物和探针,由北京赛百盛生物技术公司合成。测定的基因型均通过测序法进行验证。-1195 G>A点突变扩增片段长度119 bp,引物3′端-2位引入错配碱基“T”(正配碱基应为“A”)。运用扩增阻滞突变系统(Ampli cation refractorymutation system,ARMS)结合TaqMan荧光探针的方法(ARMS-Taq-Man)检测基因型,其中,野生引物为5′AAC AAA AGC AAA GAT GAA ATT CCTA 3′,突变引物为 5′ACA AAA GCA AAG ATG AAA TTC CTG 3′(序列中下划线碱基是引入的错配碱基,用以增加引物特异性),TaqMan序列为 5′HEL-TCT CCC TTC CAT CTA ATT AAT TCC TCA T-3′-BHQ。ARMS-TaqMan法的反应体系及测定条件:反应体系为20μL,反应液8μL,上、下游引物各1μL,增强液1μL,模板 2 μL,探针 1μL,H2O 6μL,使用 7 500荧光定量PCR测定仪(美国ABI公司)检测探针羧基荧光素的荧光信号。-1195G>A点突变反应条件为 94℃ 5m in,94℃ 25 s,60℃35 s40个循环,以2~9个循环为基线,阈值为0.02确定循环阈值(Ct值)。ARMS-Taq-Man方法检测不同基因型判定标准的建立:利用引物3′端与模板正配与错配扩增效率不同,以已知浓度梯度不同基因型质粒标准品为模板,按上述反应条件,通过荧光信号检测确定PCR反应有无指数扩增期和Ct值,确定可区分点突变检测的浓度范围。在可区分点突变检测的浓度范围内,以不同拷贝数的野生引物Ct值(Wct)和突变引物Ct值(Mct)差值Δct(Δct=Wct-Mct),根据总体均数计算 Δct的 99%可信区间(Δct±2.58 s)及PCR扩增时有无指数增长期,建立各种等位基因型的判定标准。1.3统计学处理
采用SPSS13.0软件包进行统计分析。计数资料以百分数表示,组间比较用x2检验;定量资料以(均数±标准差)表示,采用t检验或W ilcoxon秩和检验。Hardy-Weinberg平衡检验,2组SNPs的基因型和等位基因的频率差异采用x2检验或Fisher精确检验。多因素分析采用多元Logistic回归分析。所有资料采用双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 基线资料比较
①AS组 147例,男 90例(61.2%);年龄(64.39±12.45)岁;吸烟史 50例(34.0%),饮酒史36例(24.5%);原发性高血压91例(61.9%),糖尿病 53例(36.1%),冠心病 71例 (48.3%);TG (1.46±0.71)mmol/L,Cho(4.49±1.17)mmol/L,HDL (1.13±0.29)mmol/L,LDL(2.83±0.84)mmol/L;②非AS组63例,男33例(52.4%);年龄(66.29±12.83)岁;吸烟史 24例(38.1%),饮酒史17例(27.0%);原发性高血压40例(63.5%),糖尿病 17例(27.0%),冠心病 28例 (44.4%);TG (1.31±0.59)mmol/L,Cho(4.51±1.11)mmol/L,HDL (1.11±0.28)mmol/L,LDL(2.76±0.71)mmol/L。各项指标组间比较差异均无统计学意义(P>0.05)。
2.2 COX-2基因-1195G>A基因型和等位基因频率分布
COX-2基因-1195G>A基因型分布符合Hardy-Weinberg平衡(P>0.05),具有群体代表性。应用x2检验比较-1195G>A位点基因型、显性模型在2组间的分布频率差异,结果提示差异均无统计学意义(P>0.05)。非 AS组中 -1195G>A位点(GA+AA)基因型频率及A等位基因频率高于AS组,差异均有统计学意义(x2=4.96,P=0.03;x2=5.50,P=0.02),见表 1。
2.3 多因素Logistic回归分析
进一步采用多元Logistic回归模型校正年龄、性别、吸烟史、饮酒史、原发性高血压、糖尿病、冠心病、TG、TC、LDL及HDL后,结果显示,与GG基因型相比,COX-2的-1195G>A位点(GA+AA)基因型发生AR可能性更大 (OR=2.41,95%CI为1.09~5.37,P=0.03)。
3 讨论
根据检测手段及研究人群的不同,AR发生率在国内外研究中差异很大,为5%~40%[7-9]。本研究中AR及ASR的发生率分别为8.1%和21.9%,与既往报道一致[10]。
COX-2位于1号染色体q25.2-q25.3,长约8.3 kb,由10个外显子和9个内含子组成。COX-2为诱导型酶,在正常情况下,COX-2低表达或不表达,但在炎性介质、生长因子等体内外因素诱导下表达,可将AA转化为前列腺素H2,前列腺素H2可增加血栓素A2的生成,从而诱导血小板聚集、粘附和血管收缩。本研究结果表明,与GG基因型及G等位基因相比,COX-2基因-1195G>A位点(GA+AA)基因型及携带等位基因A的IS患者发生AR的可能性更大。校正相关危险因素后,(GA+AA)基因型仍与AR的发生呈显著相关(P=0.03),提示其可能是AR发生的独立危险因素。这与国内徐旭等[11]的研究相一致。然而,国内亦有相反结论的报道,王毅盟等[12]研究发现-1195G>A位点基因型分布频率在AS组及非AS组中存在统计学差异(P=0.02),但多因素分析提示-1195G>A位点与AR的发生无关。这些矛盾的结果可能与纳入研究对象不同有关,既往研究对象包括冠心病、IS、肺梗死等患者,而本研究对象仅为IS患者,避免了病因不同所引起的偏移。此外,Chen等[13]研究提示,-1195G>A位点(GA+AA)基因型与IS密切相关,那么,-1195G>A位点突变的IS患者是否更易发生AR呢,仍需进一步研究。
-1195G>A位于启动子区,启动子区含多个转录因子结合位点,因此,其基因多态性可能改变基因的转录活性,进而影响COX-2的表达。Zhang等[14]研究发现,-1195G>A多态性改变可产生一个新的c-MYB的转录因子,从而增强COX-2基因的转录活性。既往研究提示,COX-2在动脉粥样硬化的形成过程中发挥重要作用,并与粥样斑块的稳定性有关[15]。COX-2的表达上调可促进巨噬细胞产生基质金属蛋白酶对血管胶原的分解作用,从而使粥样斑块的稳定性降低,进而导致患者对阿司匹林不敏感,从而产生AR。
综上,本研究显示,COX-2基因-1195G>A位点多态性可能是造成AR及ASR原因之一。因此,检测COX-2基因-1195G>A位点多态性,对临床实施个体化药物治疗,预防心脑血管病的发生具有重要意义。但仍需进行大样本的前瞻性研究,进一步明确-1195G>A位点基因多态性与IS患者发生AR的相关性。
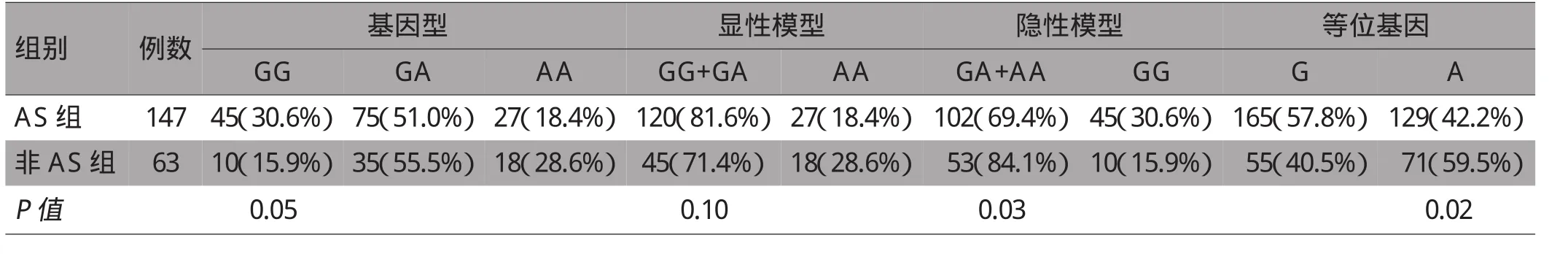
表1 COX-2基因-1195G>A基因型、显隐性模型及等位基因分布频率(n,%)
[1]Antithrombotic Trialists'Collaboration.Collaborative meta-analysis of random ised trials of antiplatelet therapy for prevention of death,myocardial infarction,and stroke in high risk patients[J].BMJ,2002,324:71-86.
[2]McKee SA,Sane DC,Deliargyris EN.Aspirin resistance in cardiovascular disease:a review of prevalence,mechanisms,and clinical significance[J].Thromb Haemost,2002,88:711-715.
[3]Zheng AS,Churilov L,Colley RE,etal.Association ofaspirin resistancew ith increased stroke severity and infarctsize[J].JAMA Neurol,2013,70:208-213.[4]O'Donnell CJ,Larson MG,Feng D,etal.Genetic and environmental contributions to platelet aggregation:the Framingham heart study[J].Circulation,2001,103:3051-3056.
[5]Sharma V,Kaul S,A l-Hazzani A,etal.Association of COX-2 rs20417 w ith aspirin resistance[J].J Thromb Thrombolysis,2013,35:95-99.
[6]中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2010[J].中华神经科杂志,2010,43:146-153.
[7]Gum PA,Kottke-Marchant K,Poggio ED,et al.Profile and prevalence of aspirin resistance in patients
w ith cardiovascular disease[J].Am JCardiol,2001,88:230-235.
[8]Patrono C.Aspirin resistance:definition,mechanisms and clinical read-outs[J].JThromb Haemost,2003,1:1710-1713.
[9]Narvaez I,Sagastagoitia JD,Vacas M,et al.Prevalence and biologic profile of aspirin resistance in patientsw ith angiographically proven coronary artery disease[J].Thromb Res,2007,120:671-677.
[10]Canivano Petrenas L,Garcia Yubero C.Resistance to aspirin:prevalence,mechanismsof action and association w ith thromboembolic events.A narrative review[J].Farm Hosp,2010,34:32-43.
[11]徐旭,陈忠云,李婧,等.335例心脑血管病患者阿司匹林抵抗与环氧化酶2基因多态性位点的相关性 [J].中华老年心脑血管病杂志,2013,15:602-606.
[12]王毅盟,倪培华,杨蓉,等.环氧化酶-2启动子区基因单核苷酸多态性与老年人阿司匹林抵抗的关系 [J].上海交通大学学报(医学版),2012,32:301-306.
[13]Chen GZ,Shan XY,Cheng GP,etal.Cyclooxygenase-2 genetic polymorphism and stroke subtypes in Chinese[J].JMolNeurosci,2013,51:467-473.
[14]Zhang X,Miao X,Tan W,etal.Identification of functional genetic variants in cyclooxygenase-2 and their association w ith risk of esophageal cancer[J].Gastroenterology,2005,129:565-576.
[15]Cuccurullo C,Fazia ML,Mezzetti A,et al.COX-2 expression in atherosclerosis:the good,the bad or the ugly?[J].Curr Med Chem,2007,14:1595-1605.

