自动乳腺全容积扫描技术的临床应用研究进展
郑逢洋 黄备建
Chin Comput Med Imag, 2014, 20: 570-574
Department of Ultrasound, Zhongshan Hospital, Fudan University;Shanghai Institute of Medical Imaging
Address:180 Fenglin Rd.,Shanghai 200032,P.R.C.
Address Correspondence to HUANG Bei-jian, (huang.beijian@zs-hospital.sh. cn)
近年来,我国乳腺癌发病率逐年上升,并有年轻化趋势[1]。乳腺影像检查技术作为乳腺癌诊断、随访及治疗疗效评价的主要手段在临床上正发挥着日益重要的作用。乳腺钼靶X线摄影是迄今公认的首选影像学检查方法[2],它具有准确性高、费用低、操作简便等优点,但对较小或致密型乳腺病灶的敏感性及特异性较低[2-3],而且还有一定的电离辐射,不适合年轻及哺乳期女性。乳腺超声检查无辐射更安全,可以显示钼靶探测不清的乳腺肿块[4],目前已成为乳腺钼靶的有力补充手段[5]。但传统手持式超声(handheld ultrasonography,HHUS)有操作者依赖性、可重复性差,没有标准化的数字图像资料,操作者的临床经验、操作技巧、扫查切面是否全面标准等都会影响其诊断的准确性[4]。自动乳腺全容积扫描成像技术(automated bre ast volume scanner, ABVS)是最近才引进的一种可对整个乳腺进行自动三维重建,并标准化储存图像数据的成像系统,因此无操作者依赖性、可重复性好,在一定程度上弥补了HHUS的不足,因此得以快速发展。本文将对ABVS的成像系统、目前临床研究现状及其在乳腺癌新辅助化疗疗效评价中的应用前景进行综述。
1. ABVS仪器及其扫描方式简介
采用Acuson S2000 ABVS系统(Siemens Medical Solutions, Mountain View, CA, USA),该系统由主机、5~14 MHz宽频自由臂探头及工作站构成。扫描探头长15.4mm,一次扫描距离为16.8mm,最大扫描深度为6mm,因此每次扫查可获得最大为16.8cm×15.4cm×6 cm(1552.3 cm3)的容积数据。扫描所获图像数据自动保存并传输到工作站进行实时三维重建。诊断医师可随时根据需要从多个方位对重建后的图像进行动态观察。扫描时患者采取仰卧位,检查者根据患者乳房的大小(A-D杯)选择机器的最佳预设扫描条件,系统自动调整深度、增益、聚焦范围等以获得最佳图像质量。目前文献报道较多的是采用三次扫描方法,即每侧乳房常规完成正中位、内侧位和外侧位三个方位的扫描,乳房较大时另加上方位和下方位,每次扫描都包含乳头在内。Tozaki等[5]提出四次扫描是最好的扫描方式,即对乳腺进行四个方位的扫查(包括外上位、外下位、内上位和内下位)。此外,也有学者采用两次扫描方法[6-7],即只扫描内侧位和外侧位,对较大乳腺另再扫查腋尾。每个方位的扫查时间约55~65s,采集图像的层间距为0.5mm。每例患者(两侧乳腺)平均扫查时间约8~10min[7](两次扫描法)、10~15min[8-10](三次或四次扫描法),图像评估时间依诊断医师临床经验不同而异,约需5~15min[8-9]。
2. ABVS临床应用研究现状
近年来对ABVS成像系统的临床研究才刚开展,主要集中在诊断乳腺癌的敏感性及特异性研究、对病灶检出率的研究、对病灶大小的评估、诊断医师(观察者)之间的一致性及冠状面图像特征等方面。以下根据最近相关文献就以上几个方面分别进行相关阐述。
2.1 ABVS诊断乳腺癌的敏感性与特异性研究:ABVS图像评估还缺乏统一标准,目前多数研究者都采用北美放射学会的乳腺影像报告和数据系统(BIRADS)诊断分类[11]标准:2级为良性,3级为良性可能性大,4级为可疑恶性,5级为恶性可能性大。根据目前文献报道,ABVS诊断乳腺癌的敏感性很高(82%-100%),而特异性相对稍低(68%~95%)(表1)。但其准确性并不低于HHUS[8,9,12,13]。与一般研究不同的是,Wojcinski等[6]以HHUS检查结果作为参考标准发现ABVS诊断恶性病变(即BI-RADS®-US 5级)的特异性很低,仅为52.8%,敏感性及准确性分别为100%、66%。随后又进行了类似研究,虽然特异性有所提高(78.1%)但仍低于多数文献报道结果,考虑其主要原因是研究对象中无乳腺病变的健康女性相对更多,容易导致假阳性而降低了特异性(其他研究大多是针对有明确乳腺病变或有相关临床症状的患者)。此外,由于缺少图像评估标准,诊断医师为了避免漏诊对稍把握不准的病变都要求再次HHUS检查而导致更高的假阳性率(其实验方法所规定),降低了特异性。因此需要综合考虑这些研究结果。
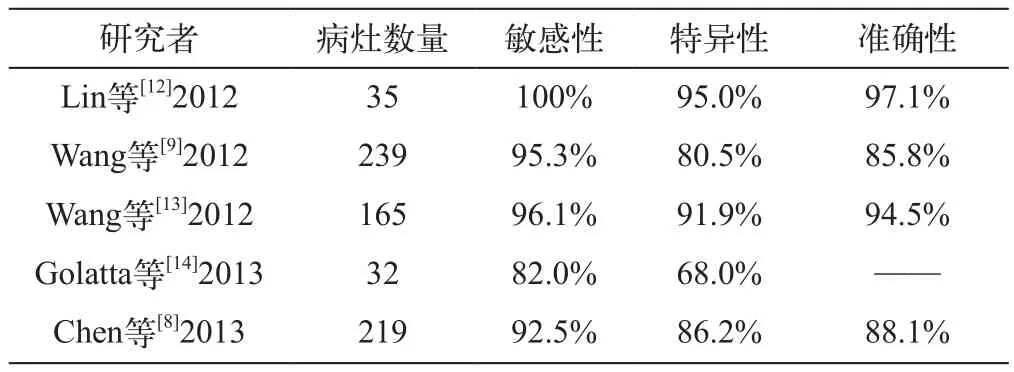
表1 各组研究者ABVS的敏感性与特异性研究
2.2 ABVS对病灶检出率的研究:Zhang等[15]对81例就诊患者同时进行ABVS和HHUS检查,两名观察者用ABVS发现的病灶数均多于HHUS,且差异有统计学意义。Wang等[13]研究了165个病灶,结果显示ABVS的病灶检出率与HHUS无统计学差异(分别为95.8%、97.6%),说明ABVS对病变的敏感性不低于HHUS。Wang等[9]的研究结果表明ABVS对探测小于1cm病灶的敏感性优于HHUS,而对大于1cm的病灶无此差异,从而提示ABVS在探查小病灶上比HHUS有优势。Shin等[16]认为HHUS有操作者依赖性,当病变较小、患者乳房较大时,经验不足的医生因扫查过快或没有扫查完全而易漏诊,而ABVS工作站可重复动态慢速回放重建图像从而避免漏诊小病灶,提高了诊断的准确性。Lin等[12]也认为ABVS对病灶的探查具有优势,可以探测到不同象限所有乳腺病灶,包括乳头下及腋窝的病灶。此外,由于受扫描野的限制HHUS对较大的弥漫性病变显示不理想,而ABVS具有更大的扫描野且可连续动态显示多平面图像,观察者对病变的占位感有更直观的感受,因此有助于评估弥漫性病变并帮助区分真正的病灶与乳腺增生或其它不均质组织[9]。
2.3 ABVS对病灶大小的评价:目前,应用ABVS评估病灶大小的研究较少。Tozaki等[17]回顾性研究40例病理证实的乳腺癌患者发现ABVS术前评估肿瘤范围的准确性达98%(以病理评估的大小为金标准,误差允许在2cm以内),所以认为ABVS有助于术前评估肿瘤大小,可为术前制定治疗计划提供准确信息。Li等[18]对33例病理证实的单纯导管原位癌(ductal carcinoma in situ, DCIS)进行前瞻性研究,发现ABVS术前评估DCIS病灶的大小与组织病理学评估结果无统计学差异且优于HHUS(ABVS、HHUS与病理结果的相关系数分别为0.720、0.371)。由于ABVS冠状面图像上更有利于观察乳腺整体解剖结构(尤其是输乳管走行),易于观察病变输乳管(如异常扩张)的范围,因此ABVS可以准确评估弥漫性DCIS病变的大小[18]。以上研究提示ABVS三维重建图像可以从多个方位更全面地观察病变而有利于病灶大小的评估。
2.4 观察者之间的一致性:由于ABVS扫查层间距仅0.5mm,分辨率足以显示极小病变,且自动扫描过程保证了储存图像信息的标准性及可靠性。因此,所有观察者都可以在工作站上真实再现病变的完整动态扫查过程,真正实现对同一乳腺进行同样方式的扫查,避免了HHUS的操作者依赖性。因此,理论上观察者对ABVS图像评估之间的一致性应优于HHUS。
Zhang等[4]使用乳腺影像和数据报告系统(BIRADS)术语及三维乳腺超声特有术语描述ABVS图像并进行诊断,对两名观察者间一致性进行评估,发现BI-RADS术语中“形态”、“纵横比”、“边缘”、“回声”、“后方回声”、“钙化”以及“最终诊断”的观察者间一致性均达良好(Kappa值为0.68~0.79),优于或近似于近期HHUS的相关研究结果[19-20],与上述推测相符。而三维乳腺超声特有术语“纠集征”的观察者间一致性为中等(Kappa值为0.54),考虑可能是由于ABVS在临床应用时间较短,观察者对冠状面图像还不熟悉。此外,“纠集征”还未纳入BI-RADS,对其尚未进行准确定义,观察者仅凭个人理解对“纠集征”进行判断主观性较大,也会导致一致性下降。相信随着ABVS在临床上的应用普及,对冠状面上的“纠集征”将有更深入的认识从而做出更准确更客观的评价。
对于ABVS鉴别良恶性乳腺病变一致性的研究中,Wang等[6]与Wojcinski等[13]研究了两名观察者之间的一致性,分别得出了一致性中等和较弱的结果(Kappa值分别为0.44和0.37)。Golatta等[14]研究了6名不同资历观察者之间的一致性,结果为一致性中等(多重Kappa值为0.52),其中Wojcinski等[13]得出一致性较弱的可能原因是其研究方法导致了更大的主观性。
2.5 冠状面图像特征:许多研究指出冠状面上具有不规则边缘的“纠集征”是乳腺癌的重要特征,其病理基础可能是结缔组织增生导致周围乳腺组织向肿块收缩并破坏周围正常组织[12]。近年来研究表明,“纠集征”对乳腺癌的特异性很高(表2),具有很重要的临床价值。但目前还缺乏对“纠集征”的准确定义,且敏感性相对较低,有待进一步多样本研究。
Chen等[8]研究表明冠状面上高回声环对诊断良性病变的特异性、阴性预测值、准确性分别为92.8%、95.3%、95.9%,并发现10.5%(7/67)的恶性病变表现不连续性高回声环而没有“纠集征”。Wang等[13]研究发现67.7%(42/62)的良性病灶在冠状面上有连续性高回声环。

表2 各组研究者“纠集征”的敏感性与特异性研究
导管内病变常为多发病灶,可累及多个导管并呈节段性分布[21],当受累导管较多或受累节段较长而有分支时,常规超声仅能显示单个导管的长轴,因此空间定位较差且可能显示不全。由于乳腺导管的走行近似平行皮肤,与ABVS冠状面一致,所以冠状面图像上更有利于观察导管走行,且观察者可通过拖动鼠标重建出与标准冠状面有不同夹角的近冠状面图像,因此ABVS可较完整地显示乳腺病变导管,观察受累导管的数目、扩张导管的放射状分布及导管内的异常回声(当其内为囊性成分时则更敏感)而有助于评估导管病变的程度及范围[9]。
以上可以看出,ABVS冠状面上具有显示“纠集征”、高回声环及导管改变的优势,能够提供新的诊断信息而有助于提高医师的诊断信心。此外,冠状面与外科医生手术时的视觉方向一致,对外科医生更加直观,有助于手术方案的制定[9]。
3. ABVS对评估乳腺癌新辅助化疗疗效的应用前景
随着新辅助化疗在乳腺癌临床治疗中的广泛应用,新辅助化疗已成为乳腺癌综合治疗的重要组成部分,如何评价新辅助化疗的疗效亦是目前临床研究的重要课题。目前临床上评价化疗疗效的影像学检查方法主要包括乳腺钼靶X线摄影、PET/CT、MRI及超声等。由于乳腺癌侵袭性生长的特点及致密型乳腺使得钼靶X线对肿块大小的评估较差,虽然钼靶对病灶内微钙化显示较佳,但研究表明新辅助化疗后病灶内钙化无明确改变,且钙化形式与病理完全缓解没有相关性,所以乳腺钼靶对疗效评价的价值不大[23]。MRI软组织分辨率高,对病灶大小的评估更准确,但其费用昂贵,在临床上难以普及应用。超声检查因其经济、简便已广泛应用于新辅助化疗的疗效评价,但超声对病灶大小及疗效评价的准确性低于MRI[24-26],且可重复性较差,易受检查医师主观因素影响。ABVS的发展为超声在新辅助化疗方面的应用带来不容小觑的潜能。如前所述,ABVS不但克服了传统超声可重复性差及操作者依赖的缺点,而且具有三维成像的优势,可以分别在横轴位、冠状位及矢状位测量肿块最大直径,从而有望对病灶大小进行更准确的评估。Marinovich等[26]通过系统回顾新近文献发现MRI测量病灶体积变化比最大直径变化对化疗疗效的评价更准确,因此推测用ABVS测量病灶体积变化也可以获得更高的准确性。就笔者所了解,目前只有传统三维超声成像对新辅助化疗疗效评价的研究,Warm等[27]研究了病变在三维超声图像上的圆球度(即最大直径与最小直径之比)对新辅助化疗疗效的评估价值,认为圆球度可以预测新辅助化疗后反应。Roubidoux等[28]发现三维图像上病灶最大直径与病理结果相关性较好(相关系数为0.716),对大于7mm残留病灶的敏感性为100%。这些研究都为ABVS在新辅助化疗疗效评价上的应用提供了一定的基础。
4. 不足
ABVS法也有一些不足,如无法获得淋巴结、病灶血流及弹性等其他重要诊断信息。扫描过程中无法实时调整探头压力及方向,无法根据需要对可疑病变进行更仔细的观察。对较大乳房(D杯或以上)的患者扫查不理想。对腋窝区的检查缺乏经验,并可能漏诊腋尾病变。由于缺乏图像评价标准,因此有一定主观性,观察者之间的诊断一致性不是非常理想。目前对最佳扫描方式尚未达到统一认识,操作医师对仪器的使用也不够熟练,在扫描和图像评估时间上可能会比HHUS长。此外,ABVS诊断病变假阳性率高,可能造成不必要的活检或再次HHUS及其他检查,不仅给病人带来时间和经济上的损失,也给病人造成了不必要的痛苦。目前对ABVS的相关研究还不充分,有待进一步前瞻性、多中心性更大样本的研究,选择最佳扫描方式、制定图像评价标准是亟待解决的问题。但其临床应用价值还是值得肯定,可作为一种补充手段纳入乳腺常规检查。
5. 展望
ABVS具有标准化储存图像数据的特点,因此无操作者依赖性、可重复性好。可进行全乳动态扫描,直观全面地显示乳房解剖结构,能准确显示病灶位置和特征,尤其是冠状面上的一些特征性改变,因此ABVS可提供比HHUS更多更有价值的诊断信息,从而提高了医师的诊断信心。由于ABVS对病灶检出率较高,对恶性病变敏感而不易漏诊,有望成为一种很好的筛查方法。此外,ABVS有望在手术方案的制定中发挥重要作用,具有评价乳腺癌新辅助化疗疗效的巨大潜能。
[1] 陈 林, 陈 悦, 庞 芸, 等. 全自动乳腺容积扫描鉴别诊断乳腺肿块的价值. 中华超声影像学杂志, 2013,22:149-153.
[2] Youk JH, Kim EK, Kim MJ, et al. Performance of hand-held whole-breast ultrasound based on BI-RADS in women with mammographically negative dense breast. Eur Radiol, 2011,21:667-675.
[3] Berg WA. Supplemental screening sonography in dense breasts.Radiol Clin North Am, 2004,42:845-851.
[4] Zhang J, Lai XJ, Zhu QL, et al. Interobserver agreement for sonograms of breast lesions obtained by an automated breast volume scanner. Eur J Radiol, 2012,81:2179-2183.
[5] Tozaki M, Isobe S, Yamaguchi M, et al. Optimal scanning technique to cover the whole breast using an automated breast volume scanner. Jpn J Radiol, 2010,28:325-328.
[6] Wojcinski S, Gyapong S, Farrokh A, et al. Diagnostic performance and inter-observer concordance in lesion detection with the automated breast volume scanner (ABVS). BMC Med Imaging,2013,13:36.
[7] Wojcinski S, Farrokh A, Hille U, et al. The Automated Breast Volume Scanner (ABVS): initial experiences in lesion detection compared with conventional handheld B-mode ultrasound: a pilot study of 50 cases. Int J Womens Health, 2011,3:337-346.
[8] Chen L, Chen Y, Diao XH, et al. Comparative study of automated breast 3-D ultrasound and handheld B-mode ultrasound for differentiation of benign and malignant breast masses. Ultrasound Med Biol, 2013,39:1735-1742.
[9] Wang HY, Jiang YX, Zhu QL, et al. Differentiation of benign and malignant breast lesions: a comparison between automatically generated breast volume scans and handheld ultrasound examinations. Eur J Radiol, 2012,81:3190-3200.
[10] Tozaki M, Fukuma E. Category assessment based on 3D volume data acquired by automated breast ultrasonography. Jpn J Radiol,2012,30:185-191.
[11] Vanel D. The American College of Radiology (ACR) Breast Imaging and Reporting Data System (BI-RADS): a step towards a universal radiological language?. Eur J Radiol, 2007,61:183.
[12] Lin X, Wang J, Han F, et al. Analysis of eighty-one cases with breast lesions using automated breast volume scanner and comparison with handheld ultrasound. Eur J Radiol, 2012,81:873-878.
[13] Wang ZL, Xu JH, Li JL, et al. Comparison of automated breast volume scanning to hand-held ultrasound and mammography.Radiol Med, 2012,117:1287-1293.
[14] Golatta M, Franz D, Harcos A, et al. Interobserver reliability of automated breast volume scanner (ABVS) interpretation and agreement of ABVS findings with hand held breast ultrasound(HHUS), mammography and pathology results. Eur J Radiol,2013,82:e332-e336.
[15] Zhang Q, Hu B, Hu B, et al. Detection of breast lesions using an automated breast volume scanner system. J Int Med Res,2012,40:300-306.
[16] Shin HJ, Kim HH, Cha JH, et al. Automated ultrasound of the breast for diagnosis: interobserver agreement on lesion detection and characterization. AJR Am J Roentgenol, 2011,197:747-754.
[17] Tozaki M, Fukuma E. Accuracy of determining preoperative cancer extent measured by automated breast ultrasonography. Jpn J Radiol,2010,28:771-773.
[18] Li N, Jiang YX, Zhu QL, et al. Accuracy of an automated breast volume ultrasound system for assessment of the pre-operative extent of pure ductal carcinoma in situ: comparison with a conventional handheld ultrasound examination. Ultrasound Med Biol, 2013,39:2255-2263.
[19] Abdullah N, Mesurolle B, El-Khoury M, et al. Breast imaging reporting and data system lexicon for US: interobserver agreement for assessment of breast masses. Radiology, 2009,252:665-672.
[20] Lee HJ, Kim EK, Kim MJ, et al. Observer variability of Breast Imaging Reporting and Data System (BI-RADS) for breast ultrasound. Eur J Radiol, 2008,65:293-298.
[21] Sydnor MK, Wilson JD, Hijaz TA, et al. Underestimation of the presence of breast carcinoma in papillary lesions initially diagnosed at core-needle biopsy. Radiology, 2007,242:58-62.
[22] 苏昆仑, 徐海滨, 张正贤, 等. 自动乳腺全容积扫查系统对乳腺高危小病灶的诊断价值. 中华肿瘤杂志, 2013,35:703-707.
[23] Li JJ, Chen C, Gu Y, et al. The role of mammographic calcification in the neoadjuvant therapy of breast cancer imaging evaluation.PLoS One, 2014,9:e88853.
[24] Croshaw R, Shapiro-Wright H, Svensson E, et al. Accuracy of clinical examination, digital mammogram, ultrasound, and MRI in determining postneoadjuvant pathologic tumor response in operable breast cancer patients. Ann Surg Oncol, 2011,18:3160-3163.
[25] Shin HJ, Kim HH, Ahn JH, et al. Comparison of mammography,sonography, MRI and clinical examination in patients with locally advanced or inflammatory breast cancer who underwent neoadjuvant chemotherapy. Br J Radiol, 2011,84:612-620.
[26] Marinovich ML, Sardanelli F, Ciatto S, et al. Early prediction of pathologic response to neoadjuvant therapy in breast cancer:systematic review of the accuracy of MRI. Breast, 2012,21:669-677.
[27] Warm M, Duda V, Eichler C, et al. 3D breast ultrasound: a significant predictor in breast cancer reduction under pre-operative chemotherapy. Anticancer Res, 2011,31:4039-4042.
[28] Roubidoux MA, LeCarpentier GL, Fowlkes JB, et al. Sonographic evaluation of early-stage breast cancers that undergo neoadjuvant chemotherapy. J Ultrasound Med, 2005,24:885-895.

