绿茶提取物对人肝癌细胞株SMMC-7721 体外凋亡的影响
蒲 霞,郭庆喜,任美萍,杨成万,龙汉安*
1泸州医学院病理教研室;2 泸州医学院药理学教研室 泸州 646000
绿茶在我国有着悠久的种植和饮用历史,其主要成分是茶多酚,而茶多酚中大部分为儿茶素(catechin),其中表没食子儿茶素没食子酸酯[(-)epigallocatechin-3-gallate,EGCG]含量最高,是绿茶最主要的功效成分[1]。最近的研究表明,EGCG 不仅具有抗菌、抗病毒、抗氧化、降血糖、神经保护等多种生物学活性和药理作用,而且还对多种肿瘤具有抑制作用[2,3],但具体作用机制尚不清楚。本实验选择在人肝癌细胞凋亡过程中发挥重要作用的Survivin和P53 进行研究,旨在探讨EGCG 对体外培养的肝癌细胞凋亡的作用及其可能机制。
1 材料与方法
1.1 材料
1.1.1 细胞株人肝癌细胞株SMMC-7721 购于中国科学院上海生物研究所细胞库。
1.1.2 主要试剂与仪器
EGCG 标准品购自Sigma 公司;流式细胞仪凋亡试剂盒Annexin V-FITC Kit 购自BECKMAN 公司;免疫细胞化学试剂购自美国Bioworld Technology公司;RT-PCR 相关试剂购自北京天根科技有限公司;PCR 引物购自上海生工生物工程有限公司;主要实验仪器包括Binary HPLC Pump 高压液相色谱仪(JEOL)、德国BT8100 液相色谱分析仪、美国Beckman Coulter 流式细胞仪、德国Eppendorf PCR仪等。
1.2 实验方法
1.2.1 EGCG 单体的制备
将商品茶多酚溶解于pH 4.0(柠檬酸酸化)的蒸馏水,再加入三倍于蒸馏水的乙酸乙酯,振荡摇匀混合液,静置。约10 min 后,溶液分层,上层棕色溶液即为第一次萃取的酯层。重复萃取两次,过滤酯层,用制备色谱流动相将得到的滤液配制成一定浓度的制备样品溶液,进色谱柱收集相应馏分,馏分再经P-1 大孔树脂吸附脱溶剂,低沸点无毒溶剂洗脱,相应低沸点组分经旋转蒸发浓缩(温度控制在25℃,真空度为1 kPa),浓缩液冷冻干燥后,得到EGCG 白色粉末。经外标法测定[4],所得EGCG 单体浓度达98.6%。
1.2.2 细胞培养
SMMC-7721 细胞培养于含10%特级胎牛血清、链霉素和青霉素各100 U/mL、pH 7.3 的DMEM 培养液,37 ℃,饱和湿度,5% CO2的培养箱中培养。每日倒置相差显微镜观察细胞形态及生长情况,约3 d 传代一次。
1.2.3 流式细胞仪Annexin V-FITC/PI 法检测肝癌细胞的凋亡情况
将对数生长期的SMMC-7721 细胞以2.0 ×105个/mL 的浓度接种于6 孔板,每孔2 mL,待细胞贴壁后参照既往实验[5]加入EGCG,分为对照组(0 μg/mL)、EGCG 低浓度组(32 μg/mL)、EGCG 高浓度组(128 μg/mL)。孵育48 h 后用0.25%的胰蛋白酶消化,吹打细胞为单细胞悬液。用4 ℃PBS 液洗涤细胞两次,4 ℃下1000 rpm 离心5 min,弃上清。100 μL PBS 液重悬细胞,使细胞密度为5 ×105~5×106个/mL,放置冰盒上。每100 μL 细胞悬液中加入Annexin V-FITC 5μL 和PI(0.25 mg/mL)2.5 μL,300 μL 结合缓冲液,轻柔混匀,冰上避光孵育10 min 后上机测定分析。此外制备A 孔为正常待测细胞,B 孔正常待测细胞中加入1 mL 3%多聚甲醛(PFA)PBS 固定,冰上孵育30 min 后离心,100 μL PBS 液重悬。A、B 孔加入PI(0.2 mg/mL)2.5 μL,300 μL 结合缓冲液。视A 孔为正常细胞,B 孔为死亡细胞,调节适合的补偿参数,完成凋亡检测前的参数设定,上机测定。
1.2.4 免疫细胞化学检测SMMC-7721 细胞Survivin、P53 蛋白表达
将SMMC-7721 细胞以1.0 ×105个/mL 接种于12 孔培养板中,每孔1 mL,待细胞贴壁后分别加入终浓度为0、32、128 μmol/L 的EGCG 培养48 h 后终止培养。取出细胞爬片,按免疫细胞化学SABC法进行Survivin、突变型P53 标记,DAB 显色,苏木精复染,乙醇梯度脱水,封片,光镜观察。以试剂提供的阳性表达切片作阳性对照,以PBS 代替第一抗为阴性对照。阳性显色为棕黄色颗粒,Survivin 阳性表达于胞浆,P53 阳性表达于细胞核。高倍视野下(×400)随机选取图像,运用Image Pro Plus 6.0 软件分析Survivin、P53 阳性表达的积分光密度(Integral Optical Density,IOD)值。
1.2.5 RT-PCR 检测SMMC-7721 细胞Survivin、P53 mRNA 表达
用Oligo 6.71 Pemo 引物设计软件,设计目的基因Survivin、突变型P53 及内参GAPDH 特异性引物。
Survivin 上游引物:5’-CCTGGCAGCCCTTTCTCA-3’
下游引物:5’-TCAGTGGGGCAGTGGATG-3’
突变型P53 上游引物:5’-CGTGTTTGTGCCTGTCCT-3’
下游引物:5’-TGCTCGCTTAGTGCTCCCT-3’
GAPDH 上 游 引 物:5’-ATGCTGGCGCTGAGTACGTC-3’
下游引物:5’-GGTCATGAGTCCTTCCACGATA-3’
SMMC-7721 细胞以2.0 ×105个/mL 接种于6孔培养板中,每孔2 mL,待细胞贴壁后分别加入终浓度0、32、128 μmol/L 的EGCG 培养48 h 后终止培养。按照RNA simple Total RNA Kit 试剂盒说明提取细胞总RNA,并验证总RNA 完整性及总RNA样品纯度和浓度后,逆转录合成cDNA,PCR 扩增30个循环,取5 μL PCR 产物在1.6%琼脂糖凝胶中以100 mv 恒压电泳45 min,在紫外线凝胶成像系统成像,使用BIO-RAD Quantity One 4.6 软件分析DNA条带,并与内参GAPDH 吸光值比较,得到目的基因mRNA 的相对表达量。
1.2.6 统计学方法
结果采用SPSS16.0 软件进行分析。计量资料用均数±标准差()表示,检测结果经方差齐性检验,组间两两比较采用单因素方差分析(One Way Anova)SNK 法,以P<0.05 视为有统计学差异。
2 实验结果
2.1 流式细胞仪检测肝癌细胞的凋亡
流式细胞仪检测,EGCG 各实验组凋亡均增加,其凋亡指数(%)与对照组相比差异有显著性。散点图上可见代表凋亡细胞的右下象限细胞数随EGCG 浓度增高而明显增加,见表1、图1。结果显示绿茶提取物EGCG 单体对人肝癌SMMC-7721 细胞的凋亡有明显诱导作用。
表1 不同浓度EGCG 对人肝癌细胞株SMMC-7721 凋亡的影响(,n=6)Table 1 The effect of EGCG on the apoptosis of SMMC-7721 cells in vitro (,n=6)
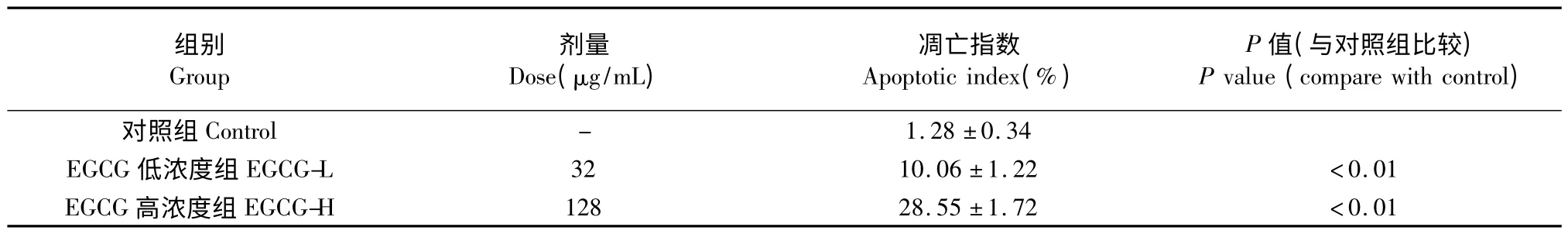
表1 不同浓度EGCG 对人肝癌细胞株SMMC-7721 凋亡的影响(,n=6)Table 1 The effect of EGCG on the apoptosis of SMMC-7721 cells in vitro (,n=6)

图1 EGCG 对SMMC-7721 凋亡的影响(,n=6)Fig.1 The apoptosis of SMMC-7721 cells treated with EGCG
2.2 免疫细胞化学法检测SMMC-7721 细胞中Survivin、P53 蛋白表达
随着EGCG 浓度的增加,SMMC-7721 细胞中Survivin、突变型P53 的蛋白表达降低。见表2。
表2 EGCG 对SMMC-7721 细胞中Survivin、P53 蛋白表达的影响(,n=10)Table 2 The expression of Survivin and P53 proteins in SMMC-7721 cells treated with EGCG (,n=10)

表2 EGCG 对SMMC-7721 细胞中Survivin、P53 蛋白表达的影响(,n=10)Table 2 The expression of Survivin and P53 proteins in SMMC-7721 cells treated with EGCG (,n=10)
注:与对照组相比,▲P<0.05;与32 μg/mL 组比较,★P<0.05。Note:Compare with control,▲P<0.05;compare with 32 μg/mL group,★P<0.05.
2.3 RT-PCR 检测SMMC-7721 细胞中Survivin、P53 mRNA 表达
实验结果显示,EGCG 能下调Survivin mRNA、P53 mRNA 表达,而且随着药物剂量的增加,下调趋势更加明显(P<0.05)。见表3,图2。
表3 EGCG 对Survivin、P53mRNA 表达的影响(,n=6)Table 3 The expression of Survivin and P53 mRNA in SMMC-7721 cells treated with EGCG (,n=6)
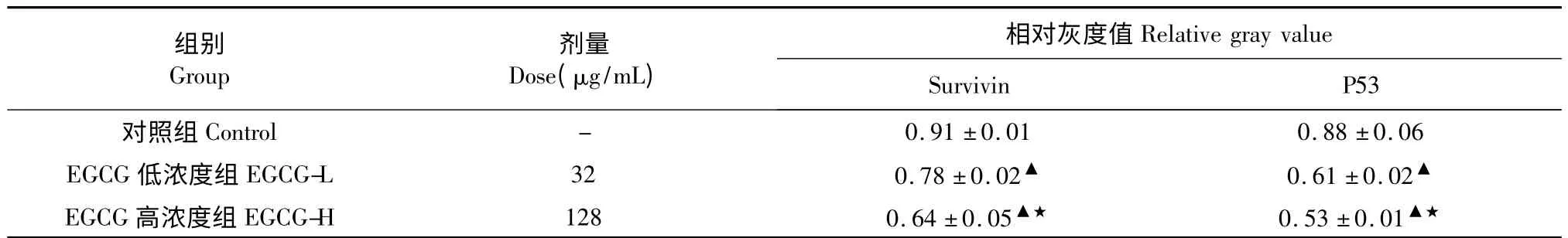
表3 EGCG 对Survivin、P53mRNA 表达的影响(,n=6)Table 3 The expression of Survivin and P53 mRNA in SMMC-7721 cells treated with EGCG (,n=6)
注:与对照组相比,▲P<0.05;与32 μg/mL 组比较,★P<0.05。Note:Compare with control,▲P<0.05;compare with 32 μg/mL group,★P<0.05.

图2 EGCG 对突变型Survivin mRNA、P53 mRNA 表达的影响Fig.2 The expression of Survivin and P53 mRNA in SMMC-7721 cells treated with EGCG
3 讨论
肝细胞肝癌在我国具有较高的发病率和死亡率,一直是肿瘤治疗研究的重点之一,寻找价廉易得低毒副作用的植物药也一直是肿瘤治疗的重要方向。绿茶提取物经实验证实对肝细胞肝癌具有抑制作用[6],但具体作用机制不明,制约了绿茶提取物EGCG 运用于临床肝癌治疗的前景。本实验旨在探讨EGCG 对体外培养的肝癌细胞凋亡的作用和其可能的机制,为EGCG 运用于临床抗肝癌治疗提供更多实验依据。
Survivin 是凋亡抑制蛋白(inhibitor of apoptosis proteins,IAP)家族中分子量最小的蛋白,分子结构由一个N 端的BIR 结构域和一个长的C 端(螺旋结构组成,其中BIR 结构域被认为是Survivin 发挥抗凋亡作用的关键部位[7]。正常情况下Survivin 仅在胚胎组织中高表达,且其表达还具有细胞周期依赖性,在细胞周期G2/M 期高表达,能够精确调控姐妹染色体的分离。同时,Survivin 可以通过线粒体途径和死亡受体途径,最终作用于Caspase-3 和Caspase-7 起到抗凋亡作用。也可能通过阻断Caspase-9 依赖的细胞凋亡信号传导起到间接抗凋亡作用。有大量的研究表明Survivin 在大多数的癌组织中有不同程度的表达,并且Survivin 的过表达导致细胞凋亡减少,与肿瘤的临床分期、组织分化等具有相关性。由于Survivin 基因表达特异性强,在肿瘤组织中表达率高,因此成为了肿瘤基因治疗的理想靶点。本实验结果证实,在人肝癌细胞株SMMC-7721 凋亡增加的过程中,的确存在Survivin 基因的表达抑制,这一结果与既往实验结果一致[8]。因此可以推测绿茶提取物EGCG 可以作用于Survivin 基因,通过抑制Survivin 基因的表达达到诱导凋亡的目的。
野生型的P53 基因具有重要的抑癌作用,主要通过检测G1 和G2/M 期校正点并阻滞细胞周期、抑制肿瘤血管生成和促进细胞凋亡等发挥作用。其中抑制Survivin 的表达可能是野生型P53 促进细胞凋亡的主要途径,但抑制表达的机制复杂,目前尚无定论。大多数人认为野生型P53 可与Survivin 启动子结合,从而抑制Survivin 表达。Survivin 表达与P53 状态及启动子多态性有关,也有研究认为P53与Survivin 外显子去甲基化状态有关。当野生型P53 发生基因缺失、杂合和(或)突变时,将对机体产生不同程度的影响。比如由于突变型的P53 缺乏在转录水平对Survivin 表达的抑制,会使得Survivin 过度表达,从而抑制肿瘤细胞的凋亡,促进肿瘤的发生发展。已有的研究表明,人类大多数肿瘤都存在P53 基因的突变,并且Survivin 和突变型P53 表达具有相关性,对抑制肿瘤细胞的凋亡起着协同作用。下调Survivin 和突变型P53 表达可以诱导肿瘤细胞凋亡并使肿瘤细胞出现有丝分裂阻滞而抑制增殖[9]。Chang 等[10]也 认 为,当p38MAPK-p53-survivin 信号通路受到抑制时可以诱导人结直肠癌细胞株HCT116 的凋亡。以上实验均证明,通过抑制Survivin 或突变型P53 的表达,可以达到诱导肿瘤细胞凋亡的作用,与本实验结果基本一致。
综上所述,Survivin 和突变型P53 都在肿瘤细胞的凋亡过程中起到了重要的作用,而绿茶提取物EGCG 可以通过抑制Survivin 和突变型P53 的表达,诱导人肝癌细胞株SMMC-7721 凋亡,进而发挥抗肿瘤作用。
1 Li B(李博),Wu YY(吴媛媛),Tu YY(屠幼英).Research progress of (-)-epigallocatechin-3-gallate transformation in vitro and in vivo and bioactivities of its products.Nat Prod Res Dev(天然产物研究与开发),2010,2:351-355.
2 Jiang T(姜涛),Li L(李岚),Du Y(杜阳),et al.Inhibitory effect of crude extract from green tea on mycobacterium smegmatis mc2155.Nat Prod Res Dev(天然产物研究与开发),2012,1:84-88.
3 Gu JW,Kristina LM,Kevan BT,et al.EGCG,a major green tea catechin suppresses breast tumor angiogenesis and growth via inhibiting the activation of HIF-1α and NFκB,and VEGF expression.Vasc Cell,2013,5:9.
4 Zhong SA(钟世安),Zhou CS(周春山),Yang JY(杨娟玉).Separation and preparation of ester catechins by high performance liquid chromatography.Chem World(化学世界),2003,5:237-239,245-249.
5 Pu X(蒲霞),Xiao XL(肖秀丽),Guo QX(郭庆喜),et al.The effect of green tea extractive EGCG on the proliferation ability and apoptosis of human hepatoma carcinoma cell line.Sichuan Med(四川医学),2009,30:627-629.
6 Di C,Sheng BW,Huan JY,et al.EGCG,green tea polyphenols and their synthetic analogs and prodrugs for human cancer prevention and treatment.Adv Clin Chem,2011,53:155-177.
7 Altieri DC.Survivin,cancer networks and pathway-directed drug discover.Nat Rev Cancer,2008,8:61-70.
8 Fang YQ(方艳秋),Qi YL(齐亚灵),Bai X(白晓),et al.Effect of survivin-ASODN on growth of hepatocellular carcinoma cells.J Jilin Univ,Med Ed(吉林大学学报·医学版),2013,2:278-281.
9 AI Dhaheri Y,Eid A,AbuQamar S,et al.Mitotic arrest and apoptosis in breast cancer cells induced by Origanum majorana extract:upregulation of TNF-α and downregulation of survivin and mutant p53.PLoS One,2013,8(2):e56649.
10 Chang HL,Chen CY,Hsu YF,et al.Simvastatin induced HCT116 colorectal cancer cell apoptosis through p38MAPKp53-survivin signaling cascade.Biochim Biophys Acta,2013,1830:4053-4064.

