羊耳菊中咖啡酰基奎宁酸类化学成分研究
关焕玉,兰燕宇,廖尚高,刘俊宏,韩 瑜,郑 林,李勇军*
1贵阳医学院药学院,民族药与中药开发应用教育部工程研究中心;2贵州省药物制剂重点实验室,贵阳 550004
羊耳菊Inula cappa 为菊科旋覆花属植物,在我国四川、贵州、广西、广东、江西、浙江等地均有分布。以全草或根入药,主要用于除痰定喘、活血调经及跌打损伤等[1]。目前已有研究报道[2-5]羊耳菊中主要含有三萜、甾醇、蒽醌、黄酮、芳香化合物、酰胺类、有机酸、倍半萜内酯等化学成分。而咖啡酰基奎宁酸类化合物是一类由奎宁酸和一个或多个咖啡酸通过酯化反应缩合而成的酚酸类天然化合物,广泛存在于植物之中,具有多种药理活性,如抗氧化、抗炎、抗微生物、酶抑制及肝细胞保护等作用[6]。就以上研究现状,本实验对羊耳菊植物中咖啡酰基奎宁酸类化合物进行了系统研究,分离得到8个咖啡酰基奎宁酸类化合物,分别为:1,5-O-二咖啡酰基奎宁酸(1)、1,3,5-O-三咖啡酰基奎宁酸(2)、3,5-O-二咖啡酰基奎宁酸甲酯(3)、3,4-O-二咖啡酰基奎宁酸甲酯(4)、3,4-O-二咖啡酰基奎宁酸乙酯(5)、4,5-O-二咖啡酰基奎宁酸乙酯(6)、3,5-O-二咖啡酰基奎宁酸(7)、3,4-O-二咖啡酰基奎宁酸(8),其中化合物1~8 的结构式见图1。为进一步探索羊耳菊中咖啡酰基奎宁酸类化合物的药理活性奠定基础。
1 仪器与材料
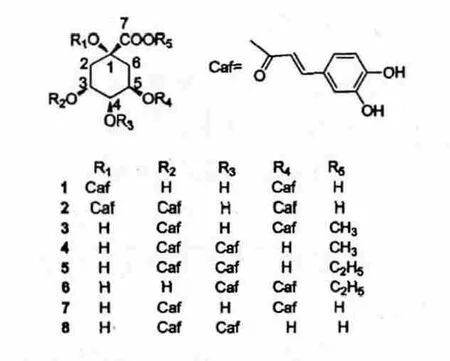
图1 化合物1~8 结构式Fig.1 Chemical structure of compounds 1-8
X-4 数字显微熔点仪(温度未校正);美国Varian INOVA-500 型核磁共振波谱仪(TMS 内标);美国HP 公司HP5973-MSD 型质谱仪;Agilent 1100 高效液相色谱仪(美国安捷伦科技公司);BS-100A 自动部分收集器(上海沪西分析仪器厂);BUCHI B-490旋转蒸发仪为瑞士生产;硅胶(200~300 目),硅胶H(10~40 μm),硅胶G(10~40 μm)均为青岛海洋化工厂产品;葡聚糖凝胶Sephadex LH-20(40~70 μm)为Amersham Pharmacia Biotech AB 公司产品;反相Rp-18 薄层色谱板及柱色谱用硅胶(40~60 μm)均为德国MERCK 公司生产;所用仪器均为分析纯或色谱纯。
实验用药材采自贵州省赤水市,由贵阳中医学院陈德媛教授鉴定为菊科植物羊耳菊Inula cappa(Buch.-Ham.ex D.Don)DC.的干燥全草。
2 提取与分离
羊耳菊干燥药材粗粉5 kg,80%乙醇回流提取2 次,每次1.5 h,过滤,合并滤液,减压浓缩,加水使之分散,用正丁醇萃取并减压浓缩,得正丁醇层浸膏182g。正丁醇萃取物经硅胶(200~300 目)色谱柱,用石油醚-乙酸乙酯梯度洗脱,薄层色谱检测,合并组成相似的洗脱液,浓缩后得到4个部分(Fr.1~Fr.4)。其中Fr.3(35.2 g)再次经硅胶(200~300目)色谱柱,氯仿-甲醇-冰醋酸(9∶1∶0.1~7∶3∶0.1)梯度洗脱,得到5个次流份(Fr.3.1~Fr.3.5)。Fr.3.1(300 mg)先后经硅胶柱(10~40 μm)层析,分别用氯仿-甲醇(100∶2)和石油醚-乙酸乙酯(7∶3)洗脱,Sephadex LH-20(甲醇),制备HPLC(甲醇∶0.1%H3PO4=62 ∶38),得到化合物5(13 mg)。Fr.3.2(450 mg)先后经硅胶柱(10~40 μm)分离,石油醚-乙酸乙酯(3 ∶7)洗脱,制备HPLC(甲醇∶0.1%H3PO4=40∶60),得到化合物7(20 mg)、2(17 mg)、1(19 mg)和8(87 mg)。Fr.3.5(210 mg)先后经硅胶柱(10~40 μm)层析,分别用石油醚-乙酸乙酯(7∶3),氯仿-甲醇-乙酸乙酯(9∶0.5∶2)洗脱,Sephadex LH-20(甲醇)和硅胶柱(10~40 μm)层析(石油醚-乙酸乙酯=7∶3),得到化合物3(21 mg)。Fr.4(49.7 g)经硅胶柱(200~300 目)层析,氯仿-甲醇梯度洗脱,得到7个次流份(Fr.4.1~Fr.4.7)。Fr.4.5(240 mg)先后经Sephadex LH-20(甲醇),反相硅胶柱层析(甲醇-水梯度洗脱),经制备HPLC(甲醇∶0.1% H3PO4水=30∶70),得到化合物6(35 mg)。Fr.4.6(195 mg)先后经正相硅胶柱(10~40 μm)层析,氯仿-甲醇-乙酸乙酯(8∶2∶2)洗脱,Sephadex LH-20(甲醇),反相硅胶柱层析(甲醇-水梯度洗脱),Sephadex LH-20(丙酮∶水50∶50),制备HPLC(甲醇∶0.1% H3PO4水=48∶52),得到化合物4(20 mg)。
3 结构鉴定
化合物1 淡黄色粉末;ESI-MS m/z:515.0[MH]–;1H NMR(500 MHz,CD3OD)δ:7.62(2H,d,J=16.0 Hz,H-7',7''),7.09(2H,d,J=2.0 Hz,H-2',2''),6.99(2H,dd,J=8.1,2.0 Hz,H-6',6''),6.80(2H,d,J=8.1 Hz,H-5',5''),6.35,6.32(各1H,d,J=16.0 Hz,H-8',8''),5.43(1H,m,H-5),4.31(1H,m,H-3),3.82(1H,dd,J=8.5,2.9 Hz,H-4),2.62(1H,dd,J=12.1,3.0 Hz,H-6a),2.54(1H,dd,J=13.8,4.0 Hz,H-2a),2.43(1H,dd,J=13.8,2.9 Hz,H-2b),2.07(1H,m H-6b);13C NMR(125 MHz,CD3OD)δ:178.0(C-7),168.6,168.0(C-9',C-9''),149.6 (C-4',C-4''),147.3,147.2 (C-7',C-7''),146.8 (C-3',C-3''),127.9,127.3 (C-1',C-1''),123.0,123.1 (C-6',C-6''),116.4 (C-5',C-5''),115.7,115.3(C-8',C-8''),115.4,(C-2',C-2''),81.7(C-1),73.4(C-4),71.8(C-5),69.8(C-3),37.4(C-6),36.0(C-2)。上述数据与文献报道[7]的1,5-O-二咖啡酰基奎宁酸一致。
化合物2 淡黄色粉末;ESI-MS m/z:677.0[MH]–;1H NMR(500 MHz,CD3OD)δ:7.64,7.56,7.51(各1H,d,J=16.0 Hz,H-7',7'',7'''),7.07,6.96,6.84(各1H,d,J=2.0 Hz,H-2',2'',2'''),6.97,6.83,6.64(各1H,dd,J=8.0,2.0 Hz,H-6',6'',6'''),6.75,6.65,6.54(各1H,d,J=8.0 Hz,H-5',5'',5'''),6.34,6.30,6.25(各1H,d,J=16.0 Hz,H-8',8'',8'''),5.44(1H,m,H-5),5.37(1H,d,J=3.5,H-3),3.99(1H,dd,J=8.4,3.9 Hz,H-4),2.88(1H,d,J=16.8 Hz,H-2a),2.45(1H,dd,J=16.8,3.5 Hz,H-2b),2.55(1H,dd,J=13.9,3.4 Hz,H-6a),2.10(1H,dd,J=13.9,10.2 Hz,H-6b);13C NMR(125 MHz,CD3OD)δ:173.5(C-7),167.3,167.2,166.5,(C-9',9'',9'''),148.3(C-7',7'',7'''),146.2,146.0 (C-4',4'',4'''),145.6,145.4(C-3',3'',3'''),126.4,126.3 (C-1',1'',1'''),121.8,121.7(C-6',6'',6'''),115.2,115.1(C-5',5'',5'''),113.7,113.6 (C-2',2'',2'''),114.3,114.2(C-8',8'',8'''),79.5(C-1),70.2(C-5),71.0(C-3),70.7(C-4),35.5(C-6),34.3(C-2)。上述数据与文献报道[8]的1,3,5-O-三咖啡酰基奎宁酸一致。
化合物3 淡黄色粉末;ESI-MS m/z:529.2[MH]–,553.2[M+Na]+;1H NMR(500 MHz,CD3OD)δ:7.62,7.55(各1H,d,J=16.1 Hz,H-7',7''),7.07,7.02(各1H,d,J=2.3 Hz,H-2',2''),6.98(2H,dd,J=8.4,2.3 Hz,H-6',6''),6.78(2H,d,J=8.4 Hz,H-5',5''),6.35,6.22(各1H,d,J=16.1 Hz,H-8',8''),5.40(1H,m,H-3),5.31(1H,m,H-5),3.98(1H,dd,J=8.0,3.5 Hz,H-4),3.69(3H,s,-OCH3),2.30(2H,m,H-6),2.19(2H,m,H-2);13C NMR(125 MHz,CD3OD)δ:175.6(C-7),168.7,167.9(C-9',9''),149.8,149.5(C-4',4''),147.4,147.1(C-7',7''),146.8(C-3',3''),127.8,127.6(C-1',1''),123.1,123.0(C-6',6''),116.5,116.4(C-5',5''),115.3,115.1(C-8',8''),115.1,114.9(C-2',2''),74.7(C-1),72.3(C-3),72.0(C-4),69.5(C-5),52.8(-OCH3),36.8(C-6),35.8(C-2)。
上述数据与文献报道[9]的3,5-O-二咖啡酰基奎宁酸甲酯一致。
化合物4 黄色粉末;ESI-MS m/z:529.2[MH]–,553.0[M +Na]+;1H NMR(500 MHz,DMSOd6)δ:9.39 (2H,brs,2OH),9.28(2H,brs,2OH),7.51,7.42(各1H,d,J=16.0 Hz,H-7',7''),7.04,7.02(各1H,d,J=2.0 Hz,H-2',2''),6.99,6.97(各1H,dd,J=8.0,2.0 Hz,H-6',6''),6.76,6.75(各1H,d,J=8.0 Hz,H-5',5''),6.25,6.13(各1H,d,J=16.0 Hz,H-8',8''),5.26(1H,m,H-3),4.98(1H,dd,J=7.0,3.0 Hz,H-4),4.15(1H,m,H-5),3.59(3H,s,-OCH3),2.26-1.86 (4H,m,H-2,6);13C NMR(125 MHz,DMSO-d6)δ:173.4(C-7),165.9,165.2(C-9',9''),148.6,148.5(C-4',4''),145.7(C-7',7''),145.8,145.7(C-3',3''),125.6,125.5(C-1',1''),121.5,121.4(C-6',6''),115.8,115.0(C-5',5''),114.9,114.8(C-2',2''),113.9,113.5(C-8',8''),73.4(C-1),72.4(C-4),67.8(C-3),65.4(C-5),52.0(-OCH3),37.7(C-2),36.3(C-6)。上述数据与文献报道[10]的3,4-O-二咖啡酰基奎宁酸甲酯一致。
化合物5 淡黄色块晶;ESI-MS m/z:543[MH]–;1H NMR(500 MHz,CD3OD)δ:7.58,7.50(各1H,d,J=16.0 Hz,H-7',7''),7.02,7.01(各1H,d,J=2.0 Hz,H-2',2''),6.89,6.86(各1H,dd,J=8.0,2.0 Hz,H-6',6''),6.74,6.71(各1H,d,J=8.0 Hz,H-5',5''),6.25,6.20(各1H,d,J=16.0 Hz,H-8',8''),5.58(1H,m,H-3),5.09(1H,dd,J=9.0,3.0 Hz,H-4),4.36(1H,m,H-5),4.15(3H,q,J=7.0 Hz,-OCH2-),2.28-2.01(4H,m,H-2,6),1.24(1H,t,J=7.0 Hz,-CH3);13C NMR(125 MHz,CD3OD)δ:174.9(C-7),168.5,168.0(C-9',9''),149.0(C-4',4''),147.4,147.3(C-7',7''),146.5,146.4(C-3',3''),127.4(C-1',1''),123.0(C-6',6''),116.5,116.3(C-5',5''),115.6,115.5(C-2',2''),114.8,(C-8',8''),75.8(C-1),74.9(C-4),68.9(C-3),68.7(C-5),62.0(-OCH2-),38.0(C-6),38.9(C-2),14.3(-CH3)。上述数据与文献报道[11]的化合物5 基本一致,并将上述数据与文献[10,12]报道的3,4-O-二咖啡酰基奎宁酸甲酯进行对比,发现除了成酯部分有差异之外,其他数据基本一致,证实该化合物为3,4-O-二咖啡酰基奎宁酸乙酯。
化合物6 黄色粉末;ESI-MS m/z:543[MH]–;1H NMR(500 MHz,CD3OD)δ:7.58,7.51(各1H,d,J=16.0 Hz,H-7',7''),7.03,7.00(各1H,d,J=2.0 Hz,H-2',2''),6.91,6.89(各1H,dd,J=8.0,2.0 Hz,H-6',6''),6.76,6.74(2H,d,J=8.0 Hz,H-5',5''),6.30,6.20(各1H,d,J=16.0 Hz,H-8',8''),5.62(1H,m,H-5),5.13(1H,m,H-4),4.37(1H,m,H-3),4.13(2H,q,J=7.0 Hz,-OCH2-),2.29-2.10(4H,m,H-2,6),1.24(3H,t,J=7.0 Hz,-CH3);13C NMR(125 MHz,CD3OD)δ:177.5(C-7),169.0,168.5(C-9',9''),148.9,148.7(C-4',4''),149.6(C-7',7''),147.9,147.7(C-3',3''),116.6(C-5',5''),124.1,124.0(C-1',1''),123.6(C-6',6''),115.9(C-2',2''),115.5,115.4(C-8',8''),76.2(C-1),74.8(C-4),69.8(C-5),69.2(C-3),62.8(C-8),39.9(C-6),39.6(-OCH2-),38.5(C-2),14.2(-CH3)。上述数据与文献报道[13]的化合物4基本一致,并将上述数据与文献[14]报道的4,5-O-二咖啡酰基奎宁酸甲酯进行对比,发现除了成酯部分有差异之外,其他数据基本一致,证实该化合物为4,5-O-二咖啡酰基奎宁酸乙酯。
化合物7 淡黄色粉末;ESI-MS m/z:515.0[MH]–;1H NMR(500 MHz,CD3OD)δ:7.56,7.43(各1H,d,J=16.3 Hz,H-7',7''),7.05,7.01(各1H,d,J=2.0 Hz,H-2',2''),6.95,6.94(各1H,dd,J=8.1,2.0 Hz,H-6',6''),6.78(2H,d,J=8.1 Hz,H-5',5''),6.29,6.18(各1H,d,J=16.3 Hz,H-8',8''),5.44(1H,m,H-3),5.41(1H,m,H-5),3.96(1H,dd,J=7.5,3.5 Hz,H-4),2.24(2H,m,H-6),2.17(2H,m,H-2);13C NMR(125 MHz,CD3OD)δ:176.0(C-7),168.1(C-9',C-9''),147.9,147.7(C-4',C-4''),147.1,147.0(C-7',C-7''),146.8,146.7(C-3',C-3''),127.9,127.8(C-1',C-1''),123.1,123.0(C-6',C-6''),116.4,116.2 (C-5',C-5''),115.7,115.6(C-2',C-2''),115.2,115.1(C-8',C-8''),73.0(C-1),72.9(C-5),72.1(C-3),71.6(C-4),35.7(C-2),36.9(C-6)。上述数据与文献报道[15]的3,5-O-二咖啡酰基奎宁酸一致。
化合物8 淡黄色粉末;ESI-MS m/z:515.0[MH]–;1H NMR(500 MHz,CD3OD)δ:7.60,7.53(各1H,d,J=16.0 Hz,H-7',7''),7.03,7.00(各1H,d,J=2.0 Hz,H-2',2''),6.93,6.90(各1H,dd,J=8.1,2.0 Hz,H-6',6''),6.75,6.73(各1H,d,J=8.1 Hz,H-5',5''),6.29,6.18(各1H,d,J=16.0 Hz,H-8',8''),5.62(1H,m,H-3),5.11(1H,dd,J=9.1,3.5 Hz,H-4),4.37(1H,m,H-5),2.32(1H,m,H-6a),2.26(2H,m,H-2),2.17(1H,m,H-6b);13C NMR(125 MHz,CD3OD)δ:176.8 (C-7),168.5,168.2(C-9',C-9''),149.7 (C-4',C-4''),147.7,147.6(C-7',C-7''),146.8(C-3',C-3''),127.7(C-1',C-1''),123.1,123.0(C-6',C-6''),116.5,116.4(C-5',C-5''),115.3,115.2(C-2',C-2''),114.8,114.7(C-8',C-8''),76.1(C-1),75.8(C-4),69.4(C-5),69.0(C-3),39.4(C-2),38.4(C-6)。上述数据与文献报道[10]的3,4-O-二咖啡酰基奎宁酸一致。
4 讨论
本实验分离得到的一系列咖啡酰基奎宁酸类化合物,大多为位置异构体,结构鉴定可通过奎宁酸母体中各取代位置上氢的化学位移、偶合常数和偶合类型确定。通常,对奎宁酸母核而言,如果OH-1 未酯化,H-2 和H-6 四个氢质子会在δH2.1~2.3 处以一个多重峰的形式出现[16];当OH-1 酯化后,H-2 和H-6 中的四个氢的共振频率会出现明显差异,以四个化学位移不同的双二重峰质子形式(δH2.0~3.5)出现在氢谱中[16]。化合物1 中,从所观察到的质子信号[2.62(1H,dd,J=12.1,3.0 Hz,H-6a),2.54(1H,dd,J=13.8,4.0 Hz,H-2a),2.43(1H,dd,J=13.8,2.9 Hz,H-2b),2.07(1H,m H-6b)]来看,化合物1 为1-O-咖啡酰基取代的二咖啡酰基奎宁酸类化合物。H-4 由于紧邻H-3 和H-5,通常以双二重峰的形式出现。对没有酯化的OH-4 来说,其H-4通常出现在δH3.7~4.1 之间;当OH-4 酯化后,H-4会向低场位移δH1.0~1.6[16]。化合物8 中,由于H-4 出现在δH5.11,化合物8 可确定为4-O-咖啡酰基取代的二咖啡酰基奎宁酸类化合物。H-3(或H-5)由于同时与H-2(或H-6)和H-4 偶合,一般以多重峰的形式出现。对没有酯化的OH-3(或OH-5)来说,其H-3(或H-5)通常出现在δH4.0~4.6 之间;当OH-3(或OH-5)酯化后,H-3(或H-5)会向低场位移δH1.0~1.6[16]。由于相对于二咖啡酰基奎宁酸8,位置异构体7 的H-5 由δ 4.37 低场位移到了δH5.41,而H-4 由δH5.11 高场位移到了δ 3.96,表明化合物7 和8 分别应该是3,5-和3,4(或4,5)-二咖啡酰基奎宁酸。
对3,4-二咖啡酰基奎宁酸异构体来说,C-3 位上的咖啡酰基处在直立键上,H-4 和H-5 保持邻位ax-ax 的偶合状态,从而H-4 出现双二重峰;对于4,5-二咖啡酰基奎宁酸异构体,由于邻二咖啡酰基的空间效应,影响H-4 和H-5 的邻位ax-ax 偶合,使偶合常数变小,而H-4 出现类似多重峰的窄峰[12,15,17],通过观察到的信号,可判断化合物8 为3,4-二咖啡酰基奎宁酸,从而也可判断化合物5 和6 的取代位置。
1 Editorial Committee of the Administration Bureau of Chinese Plant Medicine(中国科学院中国植物志编辑委员).Chinese Flora(中国植物志).Beijing:Science Press,1985.Vol.75,271-272.
2 Guo QL(郭启雷),Yang JS(杨峻山),Liu JX(刘建勋).Chemical constituents of Inula cappa.Chin Tradit Pat Med(中成药),2007,29:887-889.
3 Guo QL(郭启雷),Yang JS(杨峻山),Liu JX(刘建勋).Studies on the chemical constituents from Inula cappa (II).Chin Med Mat(中药材),2007,30:35-37.
4 Yang Y(杨雁),Wang YF(王于方),Zhao L(赵雷),et al.Chemical constituents of Inula cappa flowers.Chin Tradit Herb Drugs(中草药),2011,42:1083-1086.
5 Zhi JW,Lei S,Min L,et al.Chemical constituents from Inula cappa.Chem Nat Compd,2010,46:298-300.
6 Zhao Y(赵昱),Zhao J(赵军),Li XP(李湘萍),et al.Advances in caffeoylquinic acid research.Chin J Chin Mate Med(中国中药杂志),2006,31:869-874.
7 Maha AA,Abdalla ME,Maged SA,et al.New quinic acid derivatives from hepatoprotective Inula crithmoides root extract.Helv Chim Acta,2012,95:61-66.
8 Cheng BC,Seung KJ,Yeon SL,et al.Inhibitory activity of caffeoylquinic acids from the aerial parts of Artemisia princeps on rat lens aldose reductase and on the formation of advanced glycation end products.J Korean Soc Appl Biol Chem,2009,52:655-662.
9 Yang XX(杨昕昕),Wang GC(王国才),Wu C(吴春),et al.The phenolic compounds of Elephantopus mollis.J Jinan Univ,Nat Sci(暨南大学学报,自科版),2011,32:489-492.
10 Tang D(汤丹),Li HY(李会军),Qian ZM(钱正明),et al.Study on cafeoylquinic acid derivatives from Lonicera fulvotomentosa Hsu et S.C.Cheng.China J Chin Mate Med(中国药学杂志),2007,42:1573-1539.
11 Ying W,Matthias H,Joseph G,et al.Cyclohexanecarboxylicacid derivatives from Psiadia trinervia.Helv Chim Acta,1992,75:269-275.
12 Liu YF(刘玉峰),Yang XW(杨秀伟),Wu B(吴滨).Studies on chemical constituents in the buds of Tussilago farfara.Chin J Chin Mate Med(中国中药杂志),2007,32:2378-2381.
13 Lie CL,Yuh CK,Cheng JC.Immunomodulatory principles of Dichrocephala bicolor.J Nat Prod,1999,62:405-408.
14 Agung N,Kang RL,Md BA,et al.Isolation and quantitative analysis of Peroxynitrite Scavengers from Artemisia princeps var.orientalis.Arch Pharm Res,2010,33:703-708.
15 Irene D,Gian CT,Antonio D.New polyphenol derivative in Ipomoea batatas tubers and its antioxidant activity.J Agric Food Chem,2006,54:8733-8737.
16 Zhang DM(张东明).Chemistry of Phenolic Acids(酚酸化学).Beijing:Chemical Industry Press,2009.217-218.
17 Wu D(吴笛),Zhang M(张勉),Zhang CF(张朝凤),et al.Flavonoids and phenolic acid derivatives from flos farfarae.China J Chin Mate Med(中国中药杂志),2010,35:1142-1144.

