环庚三烯酚酮类化合物的研究进展
刘小玲,李 力,黄建忠*
福建师范大学生命科学学院 工业微生物教育部工程研究中心,福州 350108
真菌的次级代谢产物中含有大量的聚酮化合物,它们大都具有抗细菌、抗真菌、抗寄生虫、甚至抗肿瘤的生物活性,具有巨大的新药物开发潜质而受到广泛关注[1]。这些真菌的次级代谢产物中存在一类具有独特化学结构的非苯环芳香族化合物——环庚三烯酚酮(tropolone)。
1942 年Raistrick 等[2]从一株青霉菌属(Penicillium stipitatum)中提取并分离得到真菌代谢产物——stipitatic acid(密挤青霉酸),环庚三烯酚酮由于其结构的特殊性,功能的广泛性,一直受到研究者的关注,但其结构特殊性给解析工作带来了困难。1945 年Dewar 意识到这种物质的结构可能是非苯环的芳香族系统[3],Todd 等对其提供了化学依据[4],人们才确定了环庚三烯酚酮的结构为七元的环状结构,Dewar 将这个七元环的结构(图1)命名为环庚三烯酚酮(tropolone)[5]。随着从植物、细菌等多种生物中分离到了多种环庚三烯酚酮的化合物,开创了非苯环芳香族化合物的新领域。本文主要从环庚三烯酚酮类物质结构的多样性、生物活性及其合成研究进行阐述。
1 环庚三烯酚酮结构的多样性
1.1 环庚三烯酮(tropone)
环庚三烯酮(图2)是脱羟基环庚三烯酚酮,目前已知的环庚三烯酮有从藻类中分离得到的A 和B[6],其结构的主要区别是丁基链的连接位置不同。另一个是1964 年从日本香柏中分离得到的C[7],它与A、B 结构的不同是环庚三烯酮环上连接的是异丙基。

图1 tropolone 的化学结构Fig.1 The chemical structure of tropolone

图2 tropone 的化学结构Fig.2 The chemical structure of tropone
1.2 简单的二环环庚三烯酚酮
2001 年Seephonkai 等报导从一种真菌病原体冬虫夏草Cordyceps sp.BCC 1681 中分离得到cordytropolone(图3,A),其结构由一个环庚三烯酚酮和一个呋喃环构成[8]。1965 年,Divekar 等从真菌黄瘤孢属Sepedonium chrysospermum 分离得到黄瘤孢素(图3,B)[9],它的结构由一个环庚三烯酚酮单元连接一个吡喃环构成。另一种二环环庚三烯酚酮类化合物manicol(图3,C)是1983 年Polpnsky 等从圭亚那的一种树Dalacia guanensis 中分离得到,它是一种类倍半萜烯化合物[10]。

图3 二环环庚三烯酚酮的化学结构Fig.3 the structure of simple bicyclic troplone

图4 具有一个环庚三烯酚酮单元的多环结构Fig.4 polycyclic structures of one tropolone unit
1.3 具有一个环庚三烯酚酮单元的多环结构
2003 年Angawi 等[11]从一种无孢子生殖的真菌Mycelia sterilia NRRL 29110 中分离得到的一种聚酮代谢物malettinin A(图4,A),是具有一个环庚三烯酚酮单元的三环结构。2005 年他们又报导了malettinin A 的结构类似物malettinin B[12](图4,B),以及malettinin B 的另一种同分异构体。Raggatt 等在研究xenovulene A 的生物合成时,从枝顶孢霉Acremonium strictum 中分离得到了具有一个环庚三烯酚酮单元四环结构的两种化合物(图4,C,R=H 或OH)[13]。
1.4 具有两个环庚三烯酚酮单元的多环结构
一种植物病原体真菌串珠镰刀菌(Fusarium moniliforme)产生大量的毒素,其中就包含环庚三烯酚酮类的珠链孢菌素(图5)[14],它是由两个环庚三烯酚酮—吡喃环单元经丁二烯单元连接起来的。1976 年Karlsson 等报导从一种树Juniperus utahensis分离得到utahin(图5),它的结构具有两个环庚三烯酚酮单元中间由一个呋喃环聚合而成[15]。

图5 珠链孢菌素和utahin 的化学结构Fig.5 The chemical structures of fusariocin and utahin
1.5 含硫的环庚三烯酚酮
据报导天然的含有硫原子的环庚三烯酚酮衍生物4 种物质。一个是Kawano 等从柄细菌属的PK654 菌株中分离出一种抗生素thiotropocin(图6,A)[16]以及收录在抗生素及其相关物质字典中的另一种抗生素troposulfenin(图6,B)[17]。含有硫的环庚三烯酚酮的另外两种物质是从海洋细菌玫瑰杆菌的进化枝中分离得到具有抑菌作用的tropodithietic acid(图6,C)和hydroxytropodithietic acid(图6,D)[18]。

图6 含硫的环庚三烯酚酮的化学结构Fig.6 The structures of tropolones containing sulfur

图7 rubrolone 的化学结构Fig.7 The structure of rubrolone
1.6 含氮的环庚三烯酚酮
1978 年,Palleroni 等对链霉菌属X-14077 菌株产生的水溶性色素复合物毒理性研究,发现其为一个新的菌种,命名为Streptomyces echinoruber sp.nov。其主要代谢产物是一种名为rubrolone(图7)的红色素,其结构由包含环庚三烯酚酮单元的五个环构成,它具有很低的毒性,是一种潜在的食用色素[19]。
1.7 真菌的羟基环庚三烯酚酮酸
前面已经提到青霉菌属产生密挤青霉酸(stipitatic acid,图8)[2],它是最早发现的环庚三烯酚酮类物质之一。随后人们又在另一种真菌蓝状霉菌属中提取出了stipitatonic acid(图8)其结构是在stipitatic acid 的基础上,将C-5 的H 被羧基取代,并可以与C-4 的羧基经过缩合形成酸酐[20]。以及人们在研究真菌环庚三烯酚酮类物质生物合成的过程中先后发现的stipitalide(图8)与stipitaldehydic acid(图8)[21]。

图8 stipitatic acid,stipitatonic acid,stipitalide 和stipitaldehydic acid 的化学结构Fig.8 The structures of stipitatic acid,stipitatonic acid,stipitalide and stipitaldehydic acid
2 环庚三烯酚酮的生物活性
环庚三烯酚酮类化合物是次级代谢产物,大多具有抑菌、抗病毒、抗肿瘤、杀虫、抗炎以及酶抑制等活性。
2.1 环庚三烯酚酮的抑菌活性
2.1.1 环庚三烯酚酮对细菌的抑制活性
大多数环庚三烯酚酮类化合物都具有抑制细菌的活性。Trust 对环庚三烯酮抗细菌活性研究发现,环庚三烯酚酮对多种细菌具有抑菌和杀菌活性,它主要作用于所有的细胞的细胞壁或膜,而使细胞溶解达到抗菌的效果[22]。
另外,Morita 等报道了环庚三烯酚酮的类似物α-thujaplicin(图9)具有抑制粪肠球菌Enterococcus faecalis IFO-12965 的活性,MIC 为1.56 μg/mL,其抑制活性高于庆大霉素(MIC 为6.25 μg/mL)[23]。并且,他们也报道了α-thujaplicin 对细菌Legionella pneumophila SG1 和SG3 具有明显的抑制作用,其MIC 在6.25~50 μg/mL 之间[24]。
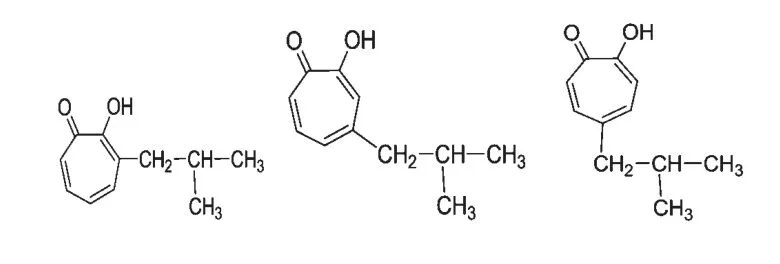
图9 α,β,γ-thujaplicin 的化学结构Fig.9 The structures of α,β,γ-thujaplicin

图10 DBMTr 的化学结构Fig.10 The structure of DBMTr
2.1.2 环庚三烯酚酮对真菌的抑制活性
Morita 等研究发现环庚三烯酚酮类化合物(α,β,γ-thujaplicin,图9)具有很强的抗真菌活性[25]。他们报道了α-thujaplicin 对七种植物病原菌真菌的MIC 在6.0~50.0 μg/mL 之间,并且还报道了环庚三烯酚酮对真菌Pythium aphanidermatum IFO-32440也具有很强的抑制作用,其MIC 为6.0 μg/mL[26]。
Nakano 等对环庚三烯酚酮类化合物的抗真菌活性研究发现,β-thujaplicin 也可以用于治疗犬的外耳炎疾病。他们进行的体外试验表明,与常用的药物(例如酮康唑和特比萘芬)相比,β-thujaplicin 对可引起狗的外耳炎疾病的真菌Malassezia pachydermatis 也有很强的抑制作用[27]。
2.2 环庚三烯酚酮的抗病毒活性
环庚三烯酚酮类化合物的抗毒活性主要体现在对人类免疫缺陷病毒(human immunodeficiency virus,HIV)及丙型肝炎病毒(Hepatitis C virus,HCV)的抑制作用。
Yamato 等最早报道了环庚三烯酚酮类化合物具有抗HIV 的活性。2005 年Scott 等进一步研究发现β-thujaplicin 和manicol 具有潜在的并选择性地抑制HIV-1 反转录酶核糖核酸酶H(RNase H)的活性,并且体外试验结果表明β-thujaplicin 和manicol对HIV-1 RNase H 的半抑制率IC50值分别为0.2 μM 和1.5 μM[28]。近年,Chung 等合成了14 种manicol 的衍生物,它们都保留了与二价金属离子螯合的基团,并提高了α-hydroxytropolones 抗HIV-1 的活性及特异性[29]。Brian 用瞬态动力学分析β-thujaplicin 对HV-1 反转录酶RNase H 的抑制活性[30]。
HCV 感染能引起肝炎、肝硬化及肝癌等疾病,据世界卫生组织统计全球有3%的人口感染HCV病毒,HCV 病毒被认为是最危险的病原体之一。Boguszewska 等合成了3,7-dibromo-5-morpholinomethyltropolone(DBMTr,图10),它对HCV 解旋酶具有很强的抑制作用,其IC50值为17.56 μM[31]。近年,Bernatouicz 等也报道了合成新的抗HCV 的环庚三烯酚酮类似物,其中,3,5,7-tri[(4'-methylpiperazin-1'-yl)methyl]tropolone 对HCV 解旋酶的抑制作用最强,IC50值为3.4 μM[32]。
2.3 环庚三烯酚酮的抗肿瘤活性
早在20 世纪50 年代,Leiter 就报道了环庚三烯酚酮类化合物具有抗恶性肿瘤37 的活性[33]。后来,Yamato 等做了大量实验来研究环庚三烯酚酮衍生物(如monotropolone 和bistropolone)的抗肿瘤活性。他们利用小鼠的白血病细胞P388 作为研究材料,发现环庚三烯酚酮类物质可以与某些酶所必需的金属产生螯合物,从而可以抑制酶的活性。例如其与催化DNA 合成的核糖核苷酸还原酶所需的金属螯合从而达到阻断DNA 合成的效果[34]。
最近,Bosca 研究发现抗肿瘤的环庚三烯酚酮类化合物可以与人的血清蛋白结合产生强的荧光,因此可将这种药物作为生物标记[35]。
2.4 环庚三烯酚酮的杀虫活性
在2001 年,Moussa 等发现从北美香柏(Thuja occidentalis)分离得到的环庚三烯酚酮类似物thujaplicinol 对昆虫Callosobruchus maculatus 具有杀虫效果[36]。2004 年,Chisty 等用透射显微镜法研究发现β-thujaplicin 对吸血虫幼虫具有明显的杀虫活性[37]。2005 年,韩国的Jang Young-su 等从日本扁柏树叶中分离得到质谱检测为β-thujaplicin,发现它可以杀死3 种蚊子幼虫,而且对Aedes aegypti 幼虫的半数致死浓度LC50为2.91 ppm、对Ochlerotatus togoi 幼虫的LC50值为2.60 ppm 以及对Culex pipiens幼虫的LC50值为1.33 ppm[38]。
2.5 环庚三烯酚酮的抗炎活性
早在1971 年,日本的Ozawa 等对环庚三烯酚酮的药理学研究就发现其具有止痛、抗炎及体温过低等活性[39]。2010 年Koc 等用小鼠试验研究发现环庚三烯酚酮衍生物2,5-dihydroxycyclohepta-2,4,6-trienone(AD-4)具有抗炎的活性,并且它比一般消炎药的毒性更低,并且推测AD-4 的抗炎活性可能与它增强血管通透性的功能有关[40]。
2.6 环庚三烯酚酮的酶抑制活性
环庚三烯酚酮类化合物对多种酶具有很强的抑制作用,主要是因为它们可以与酶所需的金属离子例如Mg2+、Cu2+、Zn2+及Fe2+螯合,从而抑制酶的活性。前面也提到了环庚三烯酚酮可以抑制病毒核糖核酸酶及整合酶的活性,此外,环庚三烯酚酮类化合物也可抑制其他酶的活性。
例如,环庚三烯酚酮类化合物β-thujaplicin 可抑制人的血小板型脂加氧酶12-lipoxygenase 的活性,IC50为0.1 μm[41],红茶中提取的环庚三烯酚酮衍生物茶黄素(theaflavins)也可抑制脂加氧酶的活性[42]。最近,Fullagar 等报道了通过形成一个独特的金属螯合结构,环庚三烯酚酮特异性地抑制依赖Zn2+的金属蛋白酶Pseudomonas aeruginosa elastase[43]。此外,天然产物环庚三烯酚酮类化合物还可以作为引起恶性肿瘤的组蛋白脱乙酰酶(histone deacetylase,HDAC)及其同工酶的抑制剂,从而可以发展成为抗癌的药物[44]。
2.7 环庚三烯酚酮的其他生物活性
Iwatsuki 等研究发现青霉菌属中提取的环庚三烯酚酮类物质有潜在的抗疟疾活性,可用作抗疟疾的药物[45]。Yamane 等报道了β-thujaplicin 具有抗糖尿病的功能,它可以与Zn(Ⅱ)形成复合物[46]。Murakami 等也从药理学和动力学方面研究了抗糖尿病的(β-thujaplicin)Zn(Ⅱ)复合物与Zn(S2O2)的配位模式[47]。Koufaki 等合成了β-thujaplicin 衍生物,它能够保护HT22 海马神经元免受氧化应激导致的细胞死亡[48]。另外,环庚三烯酚酮类化合物还具有抗辐射的功能[49]。
3 环庚三烯酚酮的生物合成
环庚三烯酚酮由于其结构的特殊性以及多样性,其衍生物的抑菌、降血压、抗肿瘤活性等,因此,越来越多的人对其合成感兴趣。环庚三烯酚酮的合成目前研究最多的包括化学合成以及生物合成。
3.1 环庚三烯酚酮的化学合成
环庚三烯酚酮的合成是复杂并且多步的,许多学者对其合成做了大量的研究,其中影响最大的就是在1965 年Stevens 以环戊二烯和二氯乙烯酮为起始原料合成了一个中间体即7,7-二氯二环[3.2.0]庚-2-烯-6 酮,然后消除了包含乙酸、乙酸盐及水的Grob 片段后形成了环庚三烯酚酮[50],如图11 所示。

图11 环庚三烯酚酮的化学合成Fig.11 chemical synthesis of tropolone
3.2 环庚三烯酚酮的生物合成途径
3.2.1 环庚三烯酚酮类化合物生物合成早期的研究
早在1950 年,Robinson 就提出环庚三烯酚酮可以由多酚和甲醛等物质缩合而成的假设[51]。1963年Bentley 使用14C 同位素标记显示了stipitatic acid的合成前提物质是乙酸、丙二酸和一个C1 物质,类似于聚酮化合物[52]。1971 年,Scott 等用青霉菌属菌株实验证明了3-甲基苷色酸3-methylorsellinic acid 是stipitatonic acid 和密挤青霉酸stipitatic acid的前体物质[53]。后来Robert 等也用实验证明了3-甲基二羟基甲基苯甲醛3-methylorcylaldehyde 也是stipitatic acid 的合成前体物,并分离得到前面提到的新的环庚三烯酚酮类物质stipitaldehydic acid[21],如图12。因此可以证明乙酸、丙二酸合成聚酮后的环化是先形成六元的苯环结构,然后再经过氧化反应来使环扩增形成了七元的环庚三烯酚酮结构。
2007 年Cox 等从一种植物病原体紧密枝顶孢霉(Acremonium strictum)中克隆到一个聚酮合成酶(polyketide synthase,PKS)基因簇,在米曲霉中异原表达得到了合成环庚三烯酚酮类物质的前体3-甲基二羟基苯甲醛3-methylorcylaldehyde,因此这个基因又被称为MOS(3-methylorcinaldehyde synthase),测序发现它是一种真菌的NR-PKS(non-reducing polyketide synthase)[54]。2010 年Cox 等研究了MOS的C 端结构域的催化作用,研究了甲基化发生的时间以及链长的控制[55]。
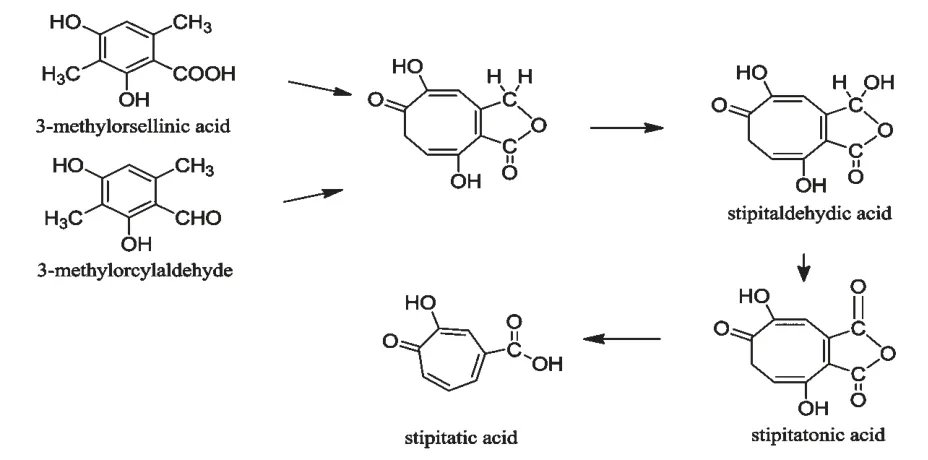
图12 环庚三烯酚酮的生物合成途径Fig.12 biosynthesis of tropolone
3.2.2 近期环庚三烯酚酮生物合成研究的成果
在2012 年Davison 等从遗传、分子、生化基础对真菌的环庚三烯酚酮的生物合成做了进一步的研究[51],阐述了真菌中合成环庚三烯酚酮基本骨架的最基本的三个基因是tropA、tropB、tropC,tropA 编码合成3-甲基二羟基苯甲醛的酶,即MOS;tropB 编码的是一个依赖FAD 的催化3-甲基二羟基苯甲醛C-3位羟基氧化的单氧化酶;tropC 编码的是一个非亚铁血红素依赖的催化环氧化扩增形成环庚三烯酚酮骨架的双氧酶。这些确定了功能的基因可以作为微生物基因组发掘的工具,而且使得环庚三烯酚酮类化合物的生物合成的研究有了实质性的飞跃,并对其他真菌的天然产物生物合成的研究起到促进的作用[56]。
4 总结与展望
环庚三烯酚酮化合物的化学结构具有多样性,并且大多具有抑菌、抗病毒、抗肿瘤、杀虫、抗炎及酶抑制剂等各种生物活性。目前,在识别新的天然环庚三烯酚酮类化合物、化学合成和性质、生物活性、生物合成和代谢等方面已经取得了很大的进步[57]。但是,由于这类化合物结构的复杂性及多样性,要把它们应用于临床诊断还需要更多的努力。因此,今后的研究应注重通过各种筛选和结构修饰等策略发现并合成更多新的环庚三烯酚酮类衍生物,研究它们的生物合成途径以发现新的衍生物,降低这类化合物的毒性,将这类化合物发展为新的临床诊断药物。
1 Sun YH(孙宇辉),Deng ZX(邓子新).Polyketides and combinatorial biosynthetic approaches.Chin J Antibiot(中国抗生素杂志),2006,Vol 36,1.
2 Birkinshaw JH,et al.Studies in the biochemistry of micro-organisms:Stipitatic acid,C8H6O5,a metabolic product of Penicillium stipitatum Thom.Biochem J,1942,36:242.
3 Dewar M.Structure of stipitatic acid.Nat,1945,155:50.
4 Corbett R,Johnson A,Todd A.The structure of stipitatic acid.J Chem Soc,1950,147-149.
5 Dewar M.Tropolone.Nat,1950,166:790-1.
6 Moore RE,Yost G.Dihydrotropones from Dictyopteris.J Chem Soc,Chem Commun,1973,937-938.
7 Banwell M,et al.Synthesis of the Troponoid Natural Product Nezukone Via Sequential Rearrangement of Two Isomeric Precursors.Aust J Chem,1993,46:1941-1954.
8 Seephonkai P,et al.A new tropolone from the insect pathogenic fungus Cordyceps sp BCC 1681.J Antibiot,2001,54:751-752.
9 Divekar P,et al.A tropolone metabolite of sepedonium chrysospermum fries.Can J Chem,1965,43:1835-1848.
10 Polonsky J,et al.Manicol:A sesquiterpenoid hydroxytropolone from dulacia guianensis;a revised structure (x-ray analysis).Tetrahedron,1983,39:2647-2655.
11 Angawi RF,et al.Malettinin A:a new antifungal tropolone from an unidentified fungal colonist of Hypoxylon stromata(NRRL 29110).Tetrahedron Lett,2003,44:7593-7596.
12 Angawi RF,et al.Malettinins BD:new polyketide metabolites from an unidentified fungal colonist of Hypoxylon stromata(NRRL 29110).J Nat Prod,2005,68:212-216.
13 Raggatt ME,et al.Biosynthesis of Xenovulene A:formation of a cyclopentenone via a unique ring expansion-ring contraction mechanism.Chem Commun,1997.2245-2247.
14 Ito T,et al.Structure of fusariocin C,a cytotoxic metabolite from Fusarium moniliforme.Agric Biol Chem,1981,45:1689-1692.
15 Karlsson B,et al.Utahin,a ditropolonofuran.Acta Crystallographica Section B:Structural Crystallography and Crystal Chemistry,1976,32:3118-3121.
16 Kawano Y,et al.Production of thiotropocin by a marine bacterium,Caulobacter sp.and its antimicroalgal activities.J Mar Biotechnol,1997,5:225-229.
17 Bycroft BW.Dictionary of Antibiotics & Related Substances.Nottingham University,England,1987.
18 Brinkhoff T,et al.Antibiotic production by a Roseobacter clade-affiliated species from the German Wadden Sea and its antagonistic effects on indigenous isolates.Appl Environ Microbiol,2004,70:2560-2565.
19 Palleroni N,et al.Production of a novel red pigment,rubrolone,by Streptomyces echinoruber sp.nov.J Antibiot,1978,31:1218-1225.
20 Segal W.A new mould tropolone from Penicillium stipitatum Thom.J Chem Soc,1959,2847-2851.
21 Bryant Jr RW,Light R.Stipitatonic acid biosynthesis.Biochemistry,1974,13:1516-1522.
22 Trust T.Antibacterial activity of tropolone.Antimicrobiol Agents Chemother,1975,7:500-506.
23 Morita Y,et al.Biological activity of α-thujaplicin,the minor component of Thujopsis dolabrata Sieb.Biol Pharm Bull,2001,24:607-611.
24 Morita Y,et al.Biological activity of α-thujaplicin,the isomer of hinokitiol.Biol Pharm Bull,2004,27:899-902.
25 Morita Y,et al.Biological activity of β-dolabrin,γ-thujaplicin,and 4-acetyltropolone,hinokitiol-related compounds.Biol Pharm Bull,2004,27:1666-1669.
26 Morita Y,et al.Biological activity of tropolone.Biol Pharm Bull,2003,26:1487-1490.
27 (a)Nakano Y,et al.Effects of beta-thujaplicin on anti-Malassezia pachydermatis remedy for canine otitis externa.J Vet Med Sci,2005,67:1243-1247.(b)Nakano Y,Matsuo S,Tani H,et al.Therapeutic effects of beta-thujaplicin eardrops on canine Malassezia-related otitis externa.J Vet Med Sci,2006,68:373.
28 Budihas SR,et al.Selective inhibition of HIV-1 reverse transcriptase-associated ribonuclease H activity by hydroxylated tropolones.Nucleic Acids Res,2005,33:1249-1256.
29 Chung S,et al.Synthesis,activity,and structural analysis of novel α-hydroxytropolone inhibitors of human immunodeficiency virus reverse transcriptase-associated ribonuclease H.J Med Chem,2011,54:4462-4473.
30 Brian DH,Nicolas S-C.Transient kinetic analyses of the ribonuclease H cleavage activity of HIV-1 reverse transcriptase in complex with efavirenz and/or a beta-thujaplicinol analog.Biochem J,2013.
31 Boguszewska-Chachulska AM,et al.Searching for a new anti-HCV therapy:Synthesis and properties of tropolone derivatives.Biochem Biophys Res Commun,2006,341:641-647.
32 Najda-Bernatowicz A,et al.Studies on the anti-hepatitis C virus activity of newly synthesized tropolone derivatives:identification of NS3 helicase inhibitors that specifically inhibit subgenomic HCV replication.Biorg Med Chem,2010,18:5129-5136.
33 Leiter J,et al.Damage induced in sarcoma 37 with chemical agents.VI.Biphenyl,fluorene,phenanthrene,and tropolone derivatives.J Natl Cancer Inst,1953,14:365-374.
34 Yamato M,et al.Synthesis and antitumor activity of tropolone derivatives(1-7).J Med Chem,1992,35:267-273.
35 Boscá F,Tormos R.Antineoplastic Tropolone Derivatives as Useful Biomarkers:Fluorescence Enhancement Upon Binding to Biological Targets.RSC Adv,2013,3:12031.
36 Moussa Kéïta,et al.Insecticidal effects of Thuja occidentalis(Cupressaceae)essential oil on Callosobruchus maculatus(Coleoptera:Bruchidae).Canadian J Plant Sci,2001,81:173-177.
37 Chisty MM,et al.Transmission electron microscopy of Schistosoma mansoni cercariae treated with hinokitiol (β-thujaplicin),a compound for potential skin application against cercarial penetration.The Tohoku J Experimental Med,2004,202:63-67.
38 Jang YS,et al.Mosquito larvicidal activity of active constituent derived from Chamaecyparis obtusa leaves against 3 mosquito species.J Am Mosq Control Assoc,2005,21:400-403.
39 Ozawa H,et al.Pharmacological studies of troponoids.I.Hypothermic,analgesic and anti-inflammatory actions of troponoids.Yakugaku zasshi:J Pharma Soci Japan,1971,91:550.
40 Koc F,et al.Anti-inflammatory activity of 2,5-dihydroxycyclohepta-2,4,6-trienone in rats.Med Chem Res,2010,19:84-93.
41 (a)Suzuki H,et al.Hinokitiol,a selective inhibitor of the platelet-type isozyme of arachidonate 12-lipoxygenase.Biochem Biophys Res Commun 2000,275:885-889.(b)Yamamoto S,Katsukawa M,Nakano A,et al.Arachidonate 12-lipoxygenases with reference to their selective inhibitors.Biochem Biophys Res Commun,2005,338:122-127.
42 Huang MT,et al.Inhibitory effects of black tea theaflavin derivatives on 12-O-tetradecanoylphorbol-13-acetate-induced inflammation and arachidonic acid metabolism in mouse ears.Mol Nutr Food Res,2006,50:115-122.
43 Fullagar JL,et al.Antagonism of a zinc metalloprotease using a unique metal-chelating scaffold:tropolones as inhibitors of P.aeruginosa elastase.Chem Commun,2013,49:3197-3199.
44 Ononye SN,et al.Tropolones as lead-like natural products:the development of potent and selective histone deacetylase inhibitors.ACS.Med Chem Lett,2013,4:757-761.
45 Iwatsuki M,et al.In vitro and in vivo antimalarial activity of puberulic acid and its new analogs,viticolins A-C,produced by Penicillium sp.FKI-4410.J Antibio,2010,64:183-188.
46 Yamane M,et al.A new anti-diabetic Zn (II)-hinokitiol (βthujaplicin)complex with Zn (O4)coordination mode.Chem Lett,2005,34:1694-1695.
47 Murakami H,et al.Pharmacological and Pharmacokinetic Studies of Anti-diabetic Tropolonato-Zn (II)Complexes with Zn (S2O2)Coordination Mode.Chem Pharm Bull,2012,60:1096-1104.
48 Koufaki M,et al.Synthesis of tropolone derivatives and evaluation of their in vitro neuroprotective activity.Eur J Med Chem,2010,45:1107-1112.
49 Kantoh K,et al.Hormetic and anti-radiation effects of tropo-lone-related compounds.In Vivo,2010,24:843-851.
50 Stevens HR.et al.A new tropolone synthesis via dichloroketene.J Am Chem Soc,1965,87:5257-5259.
51 Davison J,et al.Genetic,molecular,and biochemical basis of fungal tropolone biosynthesis.Proc Nat Acad Sci,2012,109:7642-7647.
52 (a)Bentley R.Biosynthesis of Tropolones in Penicillium stipitatum.J Biol Chem 1963,238:1880-1888.(b)Bentley R.Biosynthesis of tropolones in Penicillium stipitatum.J Biol Chem,1963,238:1895-1902.
53 Scott A,Guilford H,Lee E.Biosynthesis of the fungal tropolones.Stipitatic and stipitatonic acids.J Am Chem Soc,1971,93:3534-3536.
54 Bailey AM,et al.Characterisation of 3-methylorcinaldehyde synthase (MOS)in Acremonium strictum.Chem Commun,2007,39:4053-4055.
55 Fisch KM,et al.Catalytic role of the C-terminal domains of a fungal non-reducing polyketide synthase.Chem Commun,2010,46:5331-5333.
56 Crawford JM,Clardy J.Microbial genome mining answers longstanding biosynthetic questions.Proceedings of the National Academy of Sciences,2012,109:7589-7590.
57 Zhao J.Plant troponoids:Chemistry,biological activity,and biosynthesis.Curr Med Chem,2007,14:2597-2621.

