刺五加多糖对断奶仔猪外周血淋巴细胞信号传导的影响
韩 杰,边连全,刘显军,张 飞
沈阳农业大学畜牧兽医学院,沈阳 110866
受免疫系统尚未发育成熟以及断奶引发的断奶应激的影响,仔猪特别容易受到环境中病原微生物的侵袭而发生免疫应激,免疫应激使仔猪在行为上表现为嗜睡、采食量减少;代谢上则使机体将用于生长的营养物质转向用于参与免疫防御,最终导致仔猪出现生长抑制[1]。由于长期添加抗生素促生长剂引发的畜禽产品安全和人体健康等问题,禁止在畜禽生产中使用抗生素的呼声越来越高,开发绿色环保型饲料添加剂具有重要意义。刺五加多糖(Acanthopanax senticosuspolysaccharide,ASPS)是从传统中草药刺五加中分离出的生物大分子多糖,其在体内、外对人类和啮齿类动物的免疫调节活性已经被一些研究所证实。但在断奶仔猪饲料中添加ASPS调节仔猪生长和免疫功能的研究鲜有报道。我们课题组前期的研究表明饲料添加ASPS 能缓解免疫应激仔猪的生长抑制,改善断奶仔猪的免疫机能[2],但ASPS 调解断奶仔猪免疫功能的作用机制尚不清楚。本试验在前期研究基础上,通过体外培养仔猪外周血淋巴细胞,从淋巴细胞内信号传导的角度初步探讨ASPS 影响仔猪免疫功能的作用机制,旨在为ASPS 这种绿色饲料添加剂在养猪生产上的应用提供理论参考资料。
1 材料与方法
1.1 不同浓度刺五加多糖溶液的配制
取刺五加根,采用热水浸提乙醇分级沉淀工艺提取,苯酚-硫酸法测得多糖纯度为92.7%。气相色谱表明该多糖主要由葡萄糖和半乳糖组成。称取320 mg ASPS 溶解于适量含10%胎牛血清的RPMI-1640 完全培养液中,用5% NaHCO3调pH 至7.2~7.4,定容至100 mL 容量瓶中,0.22 μm 滤器过滤除菌,配制成含3.2 mg/mL ASPS RPMI-1640 细胞培养液,于4 ℃保存备用。临用前取1 mL 上述ASPS 细胞培养液,用含10%胎牛血清的RPMI-1640 完全培养液分别稀释至8、4、2、1 mL,配制成浓度分别为400、800、1600、3200 μg/mL ASPS 细胞培养液。
1.2 体外培养细胞的来源
取自1 头28 d 断奶、体重约8 kg 的健康仔猪的外周血。
1.3 外周血淋巴细胞悬液的制备及T、B 淋巴细胞的分离
取2 mL 肝素抗凝全血与生理盐水1∶1 混匀后,缓缓加入4 mL 淋巴细胞分离液,2000 rpm 离心20 min,取乳白色淋巴细胞层约0.6 mL,加入5 mL RPMI-1640 完全培养液混匀,2000 rpm 离心20 min,沉淀经2 次离心洗涤后即得所需的淋巴细胞。将细胞悬浮于RPMI-1640 完全培养液中,用0.5%台盼蓝染色计数活细胞数(>95%),调整细胞浓度为1 ×106个/mL。T、B 淋巴细胞的分离参照高巍等(2007)方法[3]。
1.4 测定指标
1.4.1 淋巴细胞增殖试验
取0.08 mL T 细胞悬液含Con A(终浓度为5 mg/L)或B 细胞悬液含LPS(终浓度为20 mg/L),加入到96 孔平底培养板中,再加入预先稀释成不同浓度的ASPS 溶液0.01 mL、RPMI-1640 完全培养液0.01 mL,使培养体系ASPS 终浓度分别为0、40、80、160、320 μg/mL,每组设5 个重复。将细胞板置于5%、37 ℃CO2培养箱培养72 h。培养结束前6 h,每孔加入10 μL MTT(初始浓度为5 mg/mL)继续培养。结束每孔加入80 μL 10% SDS-0.04 mol/L HCl溶液再培养2 h,使紫色结晶完全溶解,酶联免疫检测仪测定570 nm 波长OD 值。
1.4.2 白细胞介素-2(IL-2) 和白细胞介素-4(IL-4)的测定
将淋巴细胞悬液进行细胞培养,步骤同1.4.1淋巴细胞增殖试验,在培养的第24、48 和72 h,取上清液用IL-2 和IL-4 试剂盒(美国R&D)测定。
1.4.3 T 淋巴细胞分泌可诱导一氧化氮合成酶(iNOS) 水平测定
96 孔平底培养板中每孔加入含Con A(终浓度为5 mg/L)的T 细胞悬液0.08 mL、0.01 mL anti-TLR4(初始浓度为50 μg/mL),孵育1 h 后加入不同浓度ASPS 溶液0.01 mL,使培养体系ASPS 终浓度分别为0、40、80、160、320 μg/mL,置细胞板于5%CO2,37 ℃培养箱中培养6 h,取上清液用iNOS 试剂盒(美国R&D)测定,严格按照试剂盒说明书进行。
1.4.4 淋巴细胞分泌NO 的测定
细胞培养同1.4.3,37 ℃培养箱中培养24 h,取50 μL 上清液加入等体积Greiss 试剂反应20 min,测定550 nm OD 值。将6.9 mg NaNO2溶于1000 mL 双蒸水中,分别取200、160、120、80、40、20、10、0 μL 于酶标板中,再对应分别加入0、40、80、120、160、180、190、200 μL Greiss 试剂反应20 min 后测定550 nm OD 值。以OD 值为纵坐标,浓度为横坐标做标准曲线。
1.4.5 核转录因子(NF-κB) 活性和肿瘤坏死因子α(TNF-α) 的测定
细胞板加样同iNOS 的测定,将加样后的细胞板置于5% CO2,37 ℃培养箱中培养72 h,测定采用NF-κB 和TNF-α 试剂盒(美国R&D)。
1.5 数据统计分析
数据经Excel 初步处理后,采用SPSS 13.0 统计软件的ANOVA 进行不同处理间的单因素方差分析,采用Ducan 法进行多重比较检验,以P<0.05为显著性标准。
2 结果与分析
2.1 刺五加多糖对外周血淋巴细胞转化率的影响
由图1 可知,ASPS 显著提高了仔猪外周血T 淋巴细胞转化率(P<0.05)。与对照组相比,较高剂量的ASPS(160、320 μg/mL)显著促进了T 淋巴细胞转化率(P<0.05),而低剂量的ASPS(40、80 μg/mL)对T 淋巴细胞转化率无显著影响(P>0.05);不同浓度的ASPS 对体外培养的仔猪外周血B 淋巴细胞转化率均无显著影响(P>0.05)。

图1 刺五加多糖对体外培养的仔猪外周血淋巴细胞转化率的影响(n=5)Fig.1 Effect of ASPS on lymphocytes proliferation of cultured peripheral blood of weaned pigs (n=5)
2.2 刺五加多糖对淋巴细胞分泌IL-2 和IL-4 水平的影响
由表1 可知,在作用第24 和48 h,ASPS 处理虽使仔猪外周血淋巴细胞IL-2 产生量显著增加(P<0.05),但与对照组相比,只有160 μg/mL 和320 μg/mL ASPS 处理组达到了显著水平(P<0.05);在作用第72 h 时,ASPS 处理显著提高了淋巴细胞IL-2 的分泌量,并呈二次的剂量依赖关系(P<0.05)。在作用第24、48 和72 h,ASPS 处理对体外培养的仔猪外周血淋巴细胞分泌IL-4 的影响均不显著(P>0.05)。
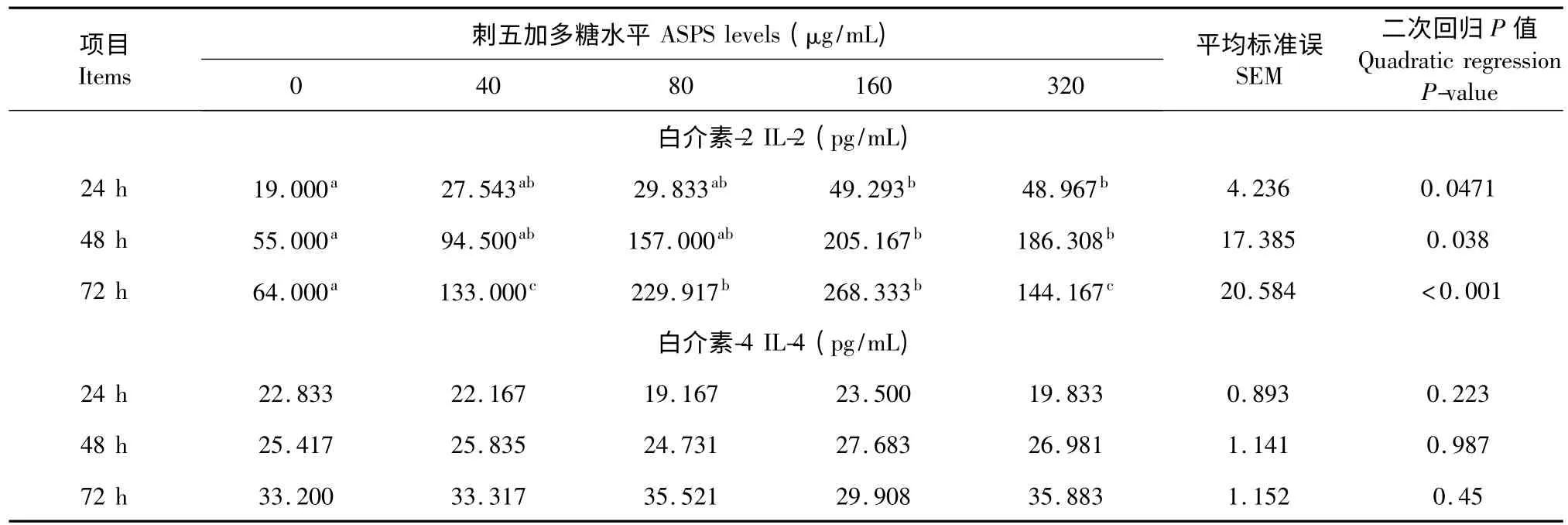
表1 刺五加多糖对体外培养的仔猪外周血淋巴细胞分泌IL-2 和IL-4 的影响(n=5)Table 1 Effect of ASPS on the concentration of IL-2 and IL-4 secreted by cultured peripheral blood lymphocytes of weaned pigs (n=5)
2.3 刺五加多糖对淋巴细胞分泌TNF-α、NO、iNOS和NF-κB 水平的影响
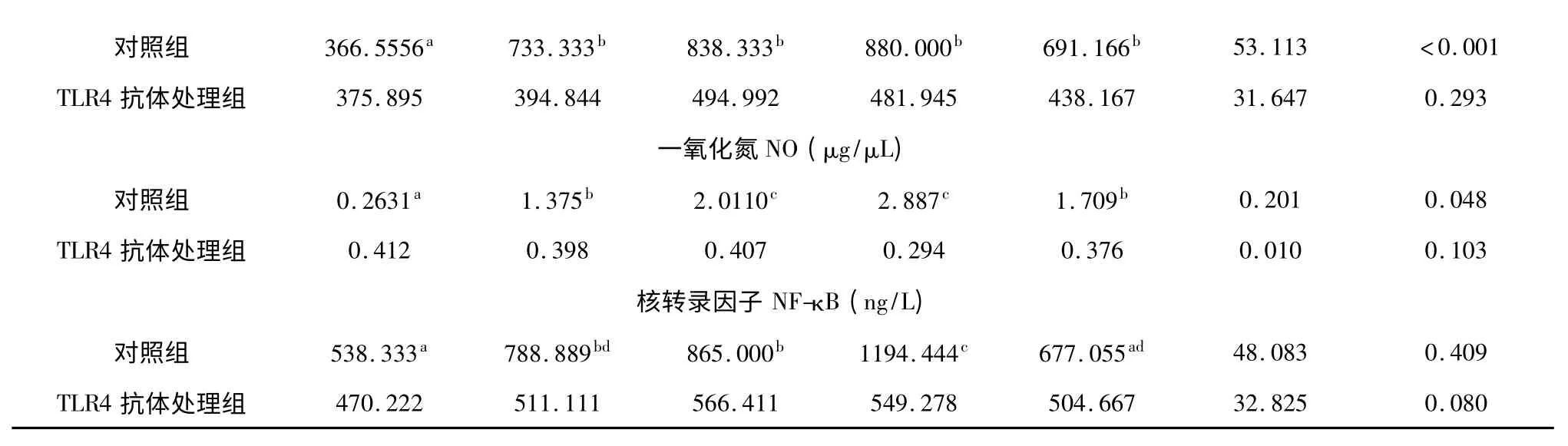
由表2 可知,当培养体系无TLR4 抗体时,ASPS处理对淋巴细胞分泌TNF-α、NO、iNOS 和NF-κB 水平有显著影响(P<0.05)。与对照组比较,40、80、160、320 μg/mL ASPS 处理显著提高了淋巴细胞分泌iNOS 水平(P<0.05),160 μg/mL ASPS 组仔猪外周血淋巴细胞iNOS 分泌量最高。40、80、160 μg/mL ASPS 显著增加了淋巴细胞NF-κB 分泌水平(P<0.05)。80、160 μg/mL ASPS 显著增加了淋巴细胞分泌TNF-α 的水平(P<0.05)。当培养体系含TLR4 抗体时,不同浓度ASPS 对淋巴细胞TNF-α、iNOS 和NF-κB 的分泌量均无显著影响(P>0.05)。
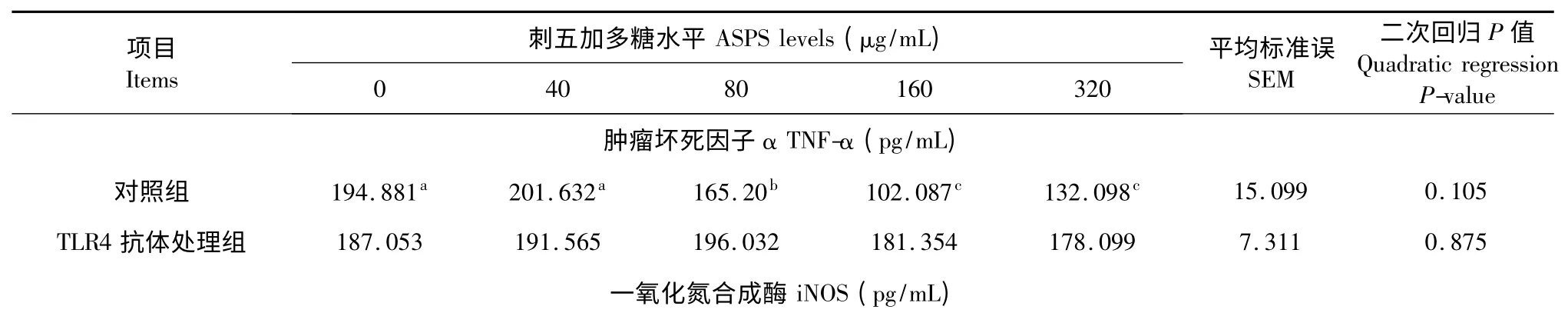
表2 刺五加多糖对体外培养的仔猪外周血淋巴细胞分泌iNOS、NO、NF-κB 和TNF-α 水平的影响(n=5)Table 2 Effect of ASPS on the concentration of iNOS,NO,NF-κB and TNF-α secreted by cultured peripheral blood lymphocytes of weaned pigs (n=5)
3 讨论
淋巴细胞增殖是检测淋巴细胞免疫功能的常用指标之一,T 细胞受促分裂素Con A 刺激或B 细胞受LPS 刺激时的增殖情况在一定程度上可以分别反映细胞免疫和体液免疫的功能变化。本试验结果发现ASPS 能协同Con A 促进外周血T 细胞增殖但不能协同LPS 促进B 细胞增殖,提示T 细胞可能是ASPS 作用的直接靶细胞之一。辅助性T 细胞(Th)作为T 细胞重要的亚型之一,其Th1 型细胞分泌的细胞因子IL-2 能有效促进T 淋巴细胞增殖、刺激细胞免疫和介导炎症反应;Th2 型细胞产生的IL-4 可促进B 细胞增殖,刺激体液免疫,诱导抗体产生[4]。本研究发现ASPS 能促进Thl 型细胞因子IL-2 的分泌而对Th2 型细胞因子IL-4 分泌无影响,此结果与以往曹丽等(2004)[5]和杨铁虹等(2005)[6]的报道相似,提示了ASPS 可能通过作用于T 细胞分泌IL-2 影响机体的细胞免疫功能。
NO 由淋巴细胞内可诱导iNOS 催化生成,是在调节免疫功能上具有广泛生物活性的信息分子。以往很多关于多糖影响iNOS 的报道表明多糖能促进iNOS 基因表达,提高iNOS 活性进而促进NO 分泌,多糖提高iNOS 活性可能与激活NF-κB 因子有关[7]。侯敢等(2006)报道了芦荟多糖能促进小鼠Mφ NO 合成酶基因的表达,促进NO 合成,用NF-κB抑制剂预先处理细胞,可抑制芦荟多糖诱导的iNOS酶基因表达,表明芦荟多糖促进的NOS 基因表达与NF-κB 因子的激活有关[8]。本试验表明,ASPS 显著提高了体外培养的外周血淋巴细胞内iNOS 水平、NO 分泌量和NF-κB 因子水平,160 μg/mL ASPS 组这些指标的水平均为最高,提示NO 可能是ASPS 作用于仔猪外周血淋巴细胞的信息分子,同时,ASPS提高iNOS 水平可能与激活NF-κB 因子有关。
以往研究已经证明了多糖调节免疫功能是通过首先与细胞表面受体结合介导免疫反应[9]。TLR4受体是Toll 受体超家族中最早被发现的成员之一,多糖受TLR4 受体介导通过信号分子将胞外信号传导至胞内,使NF-κB 迅速从胞浆移位到胞核促进细胞因子释放,从而调节免疫功能[10]。Yoon 等(2003)在研究桔梗根多糖时发现TLR4 抗体预先与Mφ 作用能使NF-κB 迅速从胞浆移位到胞核与DNA结合,提示桔梗根多糖通过TLR4/NF-κB 通路起作用[9]。本试验同Yoon 等(2003)的试验结果相似。从本试验结果看,培养体系中无TLR4 抗体时,淋巴细胞分泌TNF-α、NO、iNOS 和NF-κB 因子水平均显著升高,但这种作用在培养体系中含TLR4 抗体时被抑制,提示TLR4 可能是ASPS 作用于淋巴细胞表面的受体之一,ASPS 通过TLR4 受体介导由NO 将细胞外信号传导至细胞内,从而调节NF-κB 因子活性而促进细胞因子TNF-α 的释放,ASPS 影响淋巴细胞免疫功能与TLR4/NF-κB 信号传导系统密不可分。
综上所述,ASPS 能促进体外培养的仔猪外周血T 细胞增殖和IL-2 的分泌,其作用可能是受到淋巴细胞表面受体TLR4 介导,通过TLR4/NF-κB 信号通路起作用。
1 Spurlock ME.Regulation of metabolism and growth during immune challenge:An overview of cytokine function.J Anim Sci,1997,75:1773-1783.
2 Han J (韩杰),Bian LQ(边连全),Zhang YR(张一然),et al.Effects ofAcanthopanax senticosuspolysaccharide on growth performance and blood physiology and biochemistry indexes of weaned piglets challenged with lipopolysaccharide.Chin J Ani Nut(动物营养学报),2013,25:1054-1061.
3 Gao W(高巍),Qin AJ(秦爱建),Jin WJ(金文杰),et al.The establishing of purification method for T lymphocytes and B lymphocytes in chicken.Chin Vet Sci(中国兽医科学),2007,37:807-810.
4 Yi GF,Carroll JA,Allee GL,et al.Effect of glutamine and spray-dried plasma on growth performance,small intestinal morphology,and immune responses of Escherichia coli K88+challenged weaned pigs.J Anim Sci,2005,83:634-643.
5 Cao L(曹丽),Luo CN(罗崇念),Bian QY(卞庆亚),et al.Promotive effect ofCodonopsis pilosulapolysaccharide on IL-2 inductive activity and lymphocyte proliferative reaction in chickens.J Tradi Chin Vet Med(中兽医医药杂志),2004,5:2-3.
6 Yang TH(杨铁虹),Jia M(贾敏),Mei QB(梅其炳).Effect ofAngelica sinensispolysaccharide on lymphocyte proliferation and cytokine induction.J Chin Med Mat(中药材),2005,28:405-407.
7 Karaca K,Sharma JM,Nordgren R.Nitric oxide production by chicken macrophages activated by Acemannan,a complex carbohydrate extracted from Aloe vera.Int J Immunopharmaeol,1995,17:183-188.
8 Hou G(侯敢),Huang DN(黄迪南),Yang M(杨明),et al.Effects of aloe polysaccharides on the nitric oxide production and iNOS activity of mice peritoneal macrophages.J Hunan Col Tradi Chin Med(湖南中医学院学报),2006,26:20-22.
9 Yoon YD,Han SB,Kang JS,et al.Toll-like receptor 4-dependent activation of macrophages by polysaccharide isolated from the radix ofplatycodon grandiflorum.Int Immunopharmacol,2003,3:l873-1882.
10 Brown GD,Herre J,Williams DL,et al.Dectin-1 mediates the biological effects of β-glucans.J Exp Med,2003,197:1119-1124.

