马尾松胚性细胞悬浮增殖培养体系的建立
史 昆,杨模华,李志辉,张冬林 ,2,王 茜,丁贵杰
(1.中南林业科技大学 a.林业生物技术湖南省重点实验室;b.林学院,湖南 长沙 410004;2.乔治亚大学,美国 乔治亚州 30602;3.贵州大学 林学院,贵州 贵阳 550000)
马尾松胚性细胞悬浮增殖培养体系的建立
史 昆1a,1b,杨模华1a,1b,李志辉1b,张冬林1b,2,王 茜1b,丁贵杰3
(1.中南林业科技大学 a.林业生物技术湖南省重点实验室;b.林学院,湖南 长沙 410004;2.乔治亚大学,美国 乔治亚州 30602;3.贵州大学 林学院,贵州 贵阳 550000)
本研究利用马尾松未成熟胚诱导的胚性愈伤组织,首次建立马尾松胚性愈伤组织悬浮增殖培养体系。实验中定期对细胞生长参数沉淀细胞体积(SCV)、细胞活力进行了测定,研究了初始接种量,继代细胞密度对悬浮增殖培养体系建立的影响。研究结果表明:不同初始接种量、继代转接细胞密度显著地影响马尾松胚性细胞悬浮培养的效果;在悬浮培育过程中,胚性细胞的生长周期曲线呈“S”型,细胞活力呈现先急剧上升,后缓慢下降的趋势;本研究建立的马尾松胚性细胞悬浮增殖培养体系为:在30 mL的培养基中,初始接种1.0 g胚性细胞(平均增殖系数达12.097),继代培育以1/6作为继代细胞密度,且继代周期为8~12 d为宜。本研究为优化调控马尾松体细胞胚胎发生胚性愈伤组织稳定增殖提供了技术支撑,同时为采用遗传转化及细胞融合等技术进行马尾松新品种选育奠定了研究基础。
生物技术;马尾松;胚性细胞;悬浮培养;生长曲线
马尾松Pinus massonianaLamb.是我国南方亚热带地区最重要的人工造林先锋树种之一,是南方营建用材林、松脂林的主栽树种[1]。近30年来马尾松的遗传改良一直得到广泛地关注[2]。林木优良基因型的无性快繁及其利用在缩短林木育种周期,提高育种效率等方面具有绝对优势,体细胞胚胎发生植株再生是针叶树优良基因型无性扩繁的一种有效途径,马尾松无性快繁及体细胞胚胎发生也成为很多学者的研究热点[3-7]。本研究组在前期的研究中发现,马尾松胚性愈伤组织诱导率低(10%左右)[8-9],成为当前把马尾松体细胞胚胎发生技术应用于育种实践的首个限制因子。因此,在马尾松体细胞胚胎发生研究中,一方面继续探讨提高马尾松胚性愈伤组织诱导率的方法,另一方面寻找能把现已得到的有限胚性愈伤组织进行高效增殖培养的方式,也是弥补胚性愈伤组织诱导率低的一个可选途径。在已报道的马尾松胚性愈伤增殖研究中,常常采用固体培养基继代培养,增殖效率有限[7-9]。在林木体细胞胚胎发生中,胚性细胞系液体悬浮增殖培养是有效扩大增殖倍数,提高增殖效率的理想途径[10-11]。在建立胚性细胞悬浮培养体系中,初始接种量[12-14]及继代细胞密度[14]常常是影响悬浮培养细胞生长的重要因素,沉淀细胞体积[14](sediment cell volume,SCV)和细胞活力[15-16]常常作为衡量细胞生长增殖与细胞新陈代谢的检测指标,同时,掌握培养体系中细胞生长参数还是优化调控悬浮增殖培养细胞体系的技术基础。
本研究着重考察初始接种量、继代细胞密度(旧培养液体积/新旧培养液体积和)对马尾松胚性愈伤组织悬浮增殖培养的影响,测定马尾松胚性细胞悬浮培养周期中SCV和细胞活力的变化,绘制生长曲线,确定最佳初始接种量、继代细胞密度以及最佳的悬浮培养继代周期,从而建立高效稳定的马尾松胚性细胞悬浮增殖培养体系,为马尾松体细胞胚胎发生胚性愈伤组织的增殖、大规模生物反应器生产、马尾松基因工程遗传转化以及细胞融合新品种选育等提供技术支撑和研究基础。
1 材料与方法
1.1 试验材料
2012年7月中旬,采集湖南安化县国家及林木良种基地马尾松种子园自由授粉的马尾松球果,无菌剥取携带未成熟合子胚的雌配子体为外植体,诱导产生可稳定增殖、生长状态良好的马尾松胚性愈伤组织,作为悬浮培养的初始材料,期间分别对2个细胞系材料取样(即细胞系1-3-1和细胞系2-3-1)。基本培养基采用改良Litvay’s液体培养基[17-18],添加0.5 mg/L 2,4-D,0.5 mg/l 6-BA,置于(23±1)℃暗培养,摇床转速100 r/min。试验在中南林业科技大学林学院森林培育实验室于2013年3月至2013年8月进行。
1.2 试验方法
以悬浮培养一定时间后测定的沉降细胞体积(sediment cell volume,SCV)作为衡量细胞生长量大小的主要参数。SCV的测定:将培养瓶悬浮培养体系中的细胞充分悬起,无菌倒出均匀悬液10 mL于刻度试管中,室温下静置30 min,待沉淀细胞体积不再发生变化,读取沉淀细胞体积,得到该10 mL悬浮培养液中的SCV,每个母瓶中的SCV按各自比例计算得到。
1.2.1 初始接种量对悬浮培养细胞增殖的影响
对生长状态良好的胚性细胞系1-3-1愈伤组织,分别取0.5、1.0、2.0 g,接种于含30 mL新鲜液体培养基的100 mL三角瓶中,充分振荡混悬,置于恒温摇床上培养。培养7 d后,测定记录沉降细胞体积SCV1,吸取3 mL该悬液并接种于27 mL的新鲜液体培养基中,继续培养14 d后测定记录SCV2,根据2次间隔悬浮培养时间的生长量计算不同初始接种量下胚性细胞的增殖系数(SCV2×10/SCV1),每处理重复5次。
1.2.2 继代细胞密度对悬浮培养细胞增殖的影响
取生长状态良好的胚性细胞系1-3-1 1.0 g,接种于含30 mL新鲜液体培养基的100 mL三角瓶中,充分振荡混匀,置于摇床上暗培养7 d,测定并记录沉降细胞体积SCV3。随后,分别吸取该均一悬液(3、5、10 mL),用新鲜的液体培养基补足30 mL,继代转接旧培养液所占培养基总体积的比例分别为1/10,1/6,1/3。继续培养至14 d后测定并记录SCV4,分别计算不同继代细胞密度下胚性细胞的增殖系数,增殖系数=SCV4/(旧培养液所占比例×SCV3),每处理重复3次。
1.2.3 马尾松悬浮培养细胞活力的测定及其生长曲线的绘制
对细胞系1-3-1和2-3-3,分别取生长状态良好的胚性愈伤组织1.0 g,接种于含30 mL新鲜液体培养基的100 mL三角瓶中,在20 d的悬浮培养周期中,每2天测定SCV值1次,同时,采用TTC法[15-16]测定细胞活力参数OD值。每处理重复5次,每2 d测定1次,共测10次;然后根据20 d培养周期中细胞生长量参数SCV与细胞活力的动态变化绘制马尾松胚性细胞悬浮培养的生长曲线。
1.2.4 数据统计与分析
采用SPSS17.0对不同接种量以及不同继代细胞密度(新旧培养液比例)处理下的胚性细胞增殖系数进行方差分析,LSD多重比较。
2 结果与分析
2.1 初始接种量对悬浮培养细胞增殖的影响
研究表明,在30 mL液体培养基中培养14天,胚性细胞的初始接种量显著地影响马尾松胚性愈伤组织的增殖(见表1)。0.5 g的初始接种量处理,其平均增殖系数最小(7.469±0.346),初始接种量为1.0 g的处理,其平均增殖系数最大(12.097±1.754),且0.5 g与1.0 g初始接种量的两个处理间有显著性差异(P<0.05);当初始接种量增加到2.0 g时,其平均增殖系数较1.0 g时有所降低,但这两个处理间差异不显著。比较这3个处理培养14天时在悬浮培养体系中细胞悬液的外观表现,0.5 g的处理,其悬浮培养液呈白色、透明状,1.0 g的处理其悬浮培养液呈乳白色,粘稠状,而2.0 g的处理,此时悬浮培养液呈褐色、粘稠状,已出现胚性愈伤的老化状态。因此,从增殖系数的大小和悬浮细胞液外观表现来综合权衡,确定在30 mL培养基中悬浮培养14 d时,1.0 g的初始接种量是可取的,其单次重复的增殖系数最大可达16.232,且细胞悬液的培养状态好。
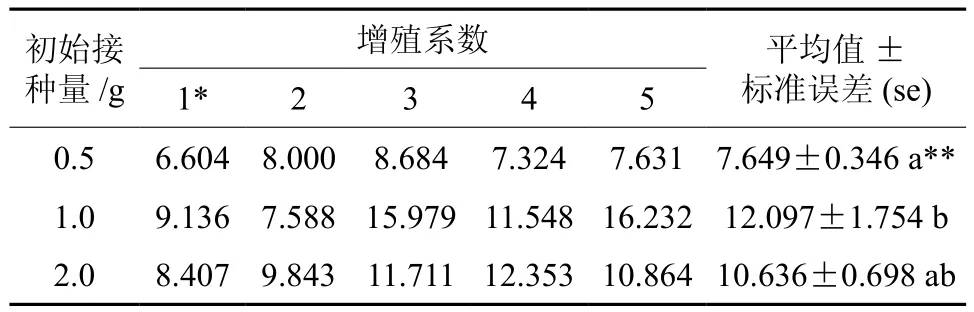
表1 初始接种量对马尾松胚性细胞系1-3-1悬浮培养增殖系数的影响†Table 1 Effects of initial embryogenic tissue weight on proliferation coefficients of suspension cultures of cell line 1-3-1
2.2 继代细胞密度对悬浮培养细胞增殖的影响
细胞系1-3-1悬浮培养的细胞增殖系数随着转接细胞密度的增加(1/10、1/6、1/3)而增加(见图1),且3个处理的继代细胞密度对悬浮细胞的增殖培养有显著性的影响。LSD多重比较结果表明,1/10与1/6的两处理间的增殖系数无显著性差异,而1/10与1/3的2个处理间有显著性差异,而1/6的处理分别与(1/10、1/3)处理间无显著性差异。在培养的过程中发现1/6转接细胞密度条件下,悬浮培养细胞的状态好,表现为悬浮液为乳白色澄清,细胞分散性较好,而1/3转接细胞密度培养条件下的悬浮液呈淡黄色,培养液略微浑浊,且细胞分散性较差。因此,在继代转接细胞密度的处理中,选择1/6的转接细胞密度处理既能获得较好的增殖,又能保持较好的细胞增殖培养状态。
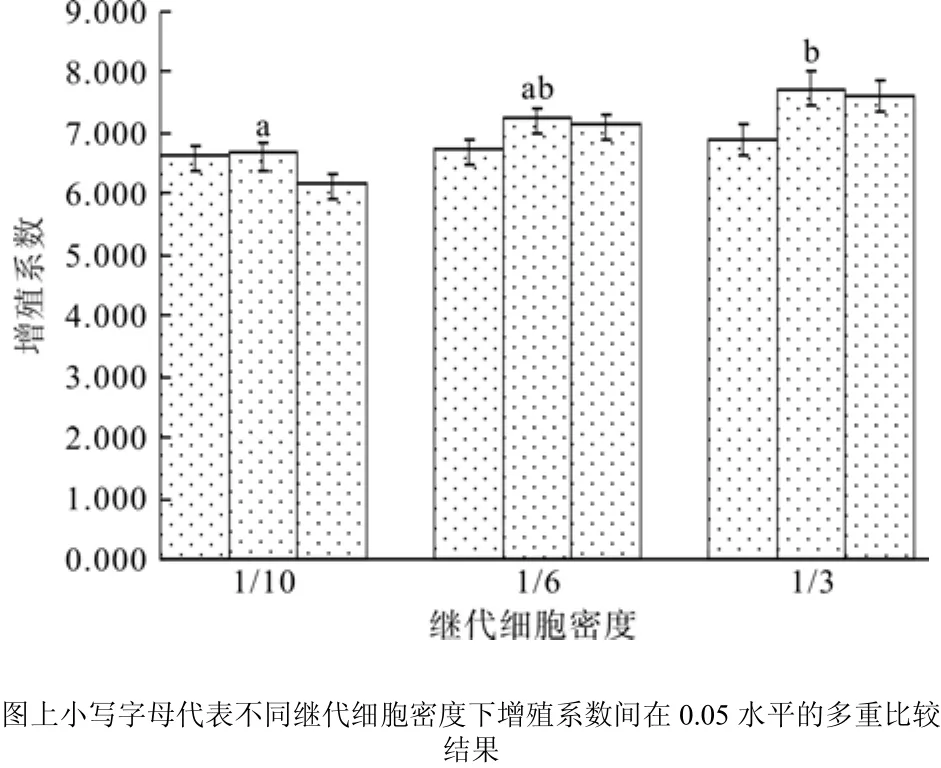
图1 继代细胞密度对马尾松胚性细胞系1-3-1悬浮培养增殖系数的影响Fig.1 Effects of cell density in subculture on proliferation coeff i cients of suspension cultures of embryogenic cell line 1-3-1
2.3 马尾松悬浮培养细胞活力测定及其悬浮培养细胞生长曲线的绘制
在30 mL液体培养基中悬浮培养20 d,每2 d定期测定细胞活力与沉淀细胞体积SCV,用其动态变化数据绘制2个细胞系(1-3-1和2-3-3)在该培养周期中的细胞生长曲线(见图2、图3),结果表明,悬浮培养细胞系的增殖生长基本上遵循“S”型生长曲线的规律。图2和图3中所示的SCV值(即悬浮细胞生长量)可以明显地划分为3个时期,缓慢生长期,快速生长期和稳定生长期,与此同时,细胞活力值(OD值)随着培养时间的推移,呈现出细胞活力先升后降的态势。这说明,悬浮培养继代初期,悬浮液培养环境中营养充足,细胞新陈代谢活动旺盛,细胞活力上升至一个峰值,随着细胞增殖,细胞数量增加,消耗培养基中的部分营养,此时培养细胞的新陈代谢活动受到一定程度的限制,表现为细胞活力OD值的降低,这也是细胞内外环境之间营养供给与生长动态平衡相适应的结果。
总体而言,在悬浮培养的前6 d期间,悬浮培养液中细胞数量和沉淀细胞体积逐渐增加,随之细胞活力大幅度上升,指示此时悬浮培养液中胚性细胞新陈代谢活动逐渐旺盛;在6~10 d(图2细胞系1-3-1)或6~12 d(图3细胞系2-3-3)期间,尽管胚性细胞SCV数量还在不断地增加,但细胞活力却由前期的活力峰值下降到与转接继代时几乎持平的细胞活力OD值水平;在12~20 d(图2细胞系1-3-1)或14~20 d(图3细胞系2-3-3)期间,悬浮培养细胞的SCV数量缓慢增加直至出现细胞SCV的静止期,此时沉淀细胞体积的增加达到一个平台峰值,而培养液中细胞活力却并不随细胞SCV量的增加而上升,反而出现低于初始继代培养时的细胞活力值水平,并保持逐渐降低的态势至较低的水平,这说明,在14~20 d的悬浮增殖期间,尽管细胞SCV值达到了该培养周期中的最高水平,但细胞的新陈代谢活动已经明显地受到了抑制,原培养液中的有效养分条件供给与细胞增殖与活力保持之间出现了不平衡,因此,综合分析,为既能较好的保持细胞活力,又能较好的维持细胞良好的增殖态势,8~12 d应为马尾松胚性细胞系悬浮增殖培养适宜的继代间隔周期。
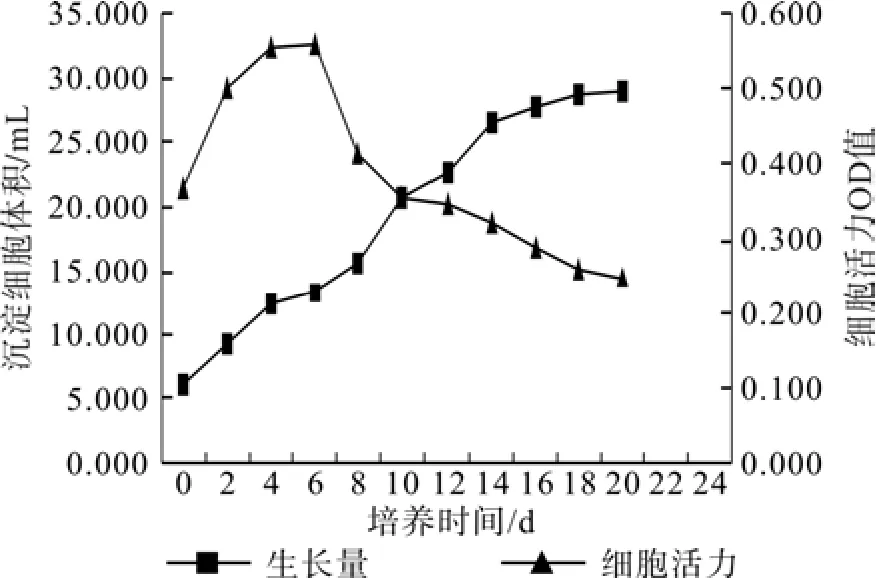
图2 细胞系1-3-1悬浮细胞生长曲线及细胞活力的动态变化Fig.2 Growth kinetic of cell line 1-3-1 and changes of cell viability in suspension culture
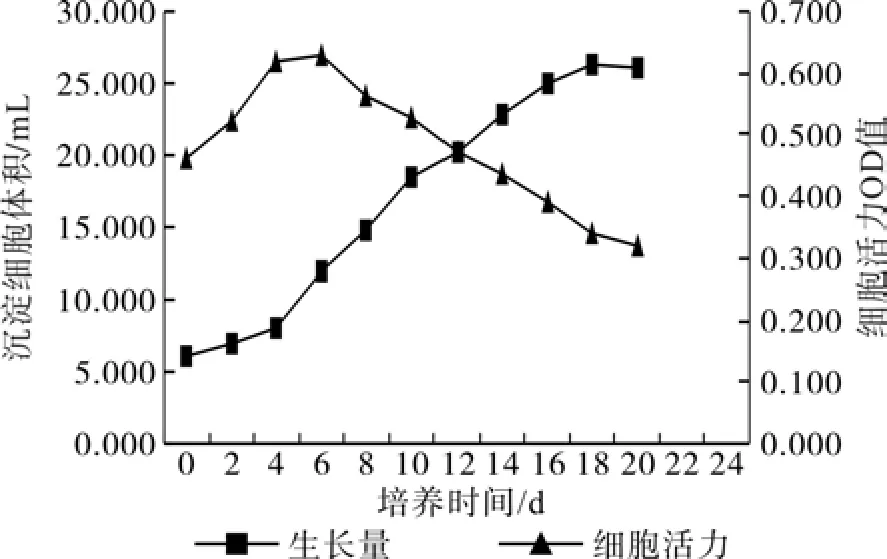
图3 胚性细胞系2-3-3悬浮细胞生长曲线及细胞活力的动态变化Fig.3 Growth kinetic of embryogenic cell line 2-3-3 and changes of cell viability in suspension culture
3 结论与讨论
建立一个稳定高效的马尾松胚性细胞悬浮培养体系,对马尾松体细胞胚胎发生快繁利用意义重大,也是进行马尾松基因工程遗传转化的良好平台。初始接种量、转接细胞密度,继代周期等都是影响一个细胞悬浮培养体系中的关键因子。初始接种量对悬浮细胞的生长和增殖产生显著性影响。马尾松胚性细胞悬浮培养细胞生长曲线的研究结果表明其增殖过程经历缓慢生长期,快速生长期,稳定生长期,甚至在细胞系2-3-3的后期出现了生长的衰退。本研究中在30 mL培养液中,分别设置3个不同的初始接种量0.5、1.0、2.0 g,结果表明,1.0 g的初始接种量,胚性愈伤组织增殖系数达到最大,培养液呈乳白色,粘稠状,悬浮培养细胞的整体状态良好,从而确定30 mL培养液中添加1.0 g胚性愈伤为马尾松悬浮培养体系的最佳初始接种量。较小的接种量(如0.5 g),悬浮细胞培养液呈澄清状,这说明细胞增殖的延迟期延长;而较大的接种量(如2.0 g),悬浮细胞培养液粘稠、颜色发褐,说明细胞很快结束对数增长期而进入静止期和衰亡期,细胞衰老,这将不利于保持胚性细胞良好的增殖态势。悬浮培养过程中初始接种量的确定,还与悬浮培养体系的大小以及悬浮培养细胞的类型有关,如Salaj等[14]在欧洲黑松Pinus nigraArn胚性细胞悬浮培养研究中表明:25 mL的培养液中1.0 g或2.5初始接种量均有利于黑松胚性细胞的生长;杨金玲等[12]在白杄Picea meyeriRehd. et Wils胚性愈伤组织的悬浮培养研究中表明,50 mL液体培养基中添加1.5 g(3%)白杄胚性愈伤组织最有利于其悬浮体系的建立;杨映根等[13]对青杄Picea wilsoniiMast 胚性细胞悬浮培养的研究结果表明,50 mL培养液中添加2%的胚性愈伤组织为其最佳的初始接种量。
继代细胞密度对马尾松悬浮细胞培养体系的建立有显著性影响,增殖系数随着继代细胞密度(1/10、1/6、1/3继代(旧/新)营养液的体积比)的增加而增加。Salaj等[14]对欧洲黑松的悬浮培养研究也表明,当继代SCV体积从3 mL增加到5 mL时,可以有效地提高增殖缓慢细胞系的增殖效率。本研究中的结果表明,过高的继代细胞密度(如1/3),容易出现悬浮培养液变浑浊,颜色变褐的现象,不利于马尾松胚性细胞系的稳定增殖与胚性保持,而中等水平的继代细胞密度(1/6),增殖系数高,且能维持细胞正常的生长状态,因此,本研究中选定1/6水平为马尾松悬浮培养的继代细胞密度。
1983年Mosmam[19]首次提出TTC比色法快速检测悬浮培养体系中活细胞线粒体琥珀酸脱氢酶活性,测得细胞活力OD值,作为表征细胞生长、增殖,新陈代谢旺盛程度的一个相对衡量指标。马尾松胚性细胞悬浮培养生长周期中,细胞体积的增加呈“S”型,并达到一个稳定期,而细胞活力呈先上升后下降的趋势。这一规律性变化,反映了培养周期内胚性培养物对培养基中养分的吸收和利用情况。在悬浮培养初期,培养基中营养丰富,细胞增殖,细胞数量不断增多,细胞新陈代谢较旺盛,与此同时,逐渐消耗培养基中的营养,因此,细胞体积增加,细胞活力呈快速上升状态;而当细胞增殖一定时间,细胞数量达到一定量时,培养液中有害代谢产物增多,有效养分减少,细胞的生长和增殖受到一定的抑制,新陈代谢逐渐变慢,细胞活力下降;细胞因为得不到充足养分,部分细胞老化或液泡化,导致细胞体积增长高峰延后的出现,细胞活力持续下降,直至出现细胞生长的停滞,甚至老化,悬浮培养液外观表现上由乳白色变得粘稠,褐化。因此,结合马尾松悬浮培养的细胞生长周期规律,为了让悬浮细胞活力状态表现良好,选择悬浮培养继代周期为8~12 d比较适宜。另外,当把该马尾松悬浮培养体系作为马尾松转基因操作,胚性细胞融合的技术平台时,最好选择悬浮培养4~6 d的胚性细胞,此时其细胞活力值最高,新陈代谢最为旺盛。
本研究首次建立了马尾松胚性愈伤组织悬浮培养体系,确定了30 mL液体培养基中最佳初始接种量为1.0 g新鲜的胚性愈伤组织;在继代培养时,以1/6的继代细胞密度为宜,在增殖系数较高的同时细胞增殖状态俱佳;通过定期测定2个胚性细胞系悬浮培养细胞的SCV和细胞活力,绘制出马尾松胚性细胞悬浮培养生长周期曲线的动态变化,确定了8~12 d为马尾松胚性细胞悬浮培养的最宜继代周期。本研究在马尾松体细胞胚胎发生中,利用悬浮增殖体系进一步扩繁所获得的马尾松胚性愈伤,为马尾松优良无性系的规模化扩繁提供了技术基础,并为马尾松基因工程遗传转化,以及采用细胞融合进行马尾松新品种选育提供了技术平台。
[1] 王 艺,丁贵杰. 外生菌根对马尾松幼苗生长的影响[J].中南林业科技大学学报,2011,31(4):74-78.
[2] 丁贵杰,周志春,王章荣,等.马尾松纸浆用材林培育与利用[M].北京:中国林业出版社,2006:1-10.
[3] 黄健秋,卫志明,许智宏.马尾松成熟合子胚的体细胞胚胎发生和植株再生[J].植物学报,1995,37(4):289-294.
[4] 张 宇,卫志明,席梦利,等.马尾松高效再生体系的建立[J].分子细胞生物学报, 2006,39(3):271-275.
[5] Zhu LH, Wu XQ, Qu HY, et al. Micropropagation of Pinus massoniana and mycorrhiza formation in vitro[J]. Plant Cell Tiss Organ Cult, 2010, 102:121–128.
[6] 杨模华,张冬林,杨 艳,等. 马尾松幼胚离体培养器官发生植株再生研究[J].中南林业科技大学学报,2011,31(3):90-96.
[7] 杨模华,张冬林,李志辉,等.马尾松幼胚体细胞胚胎发生研究[J].植物生理学报,2011,47(9):904-912.
[8] 杨 艳,李志辉,丁贵杰,等.马尾松幼胚培养愈伤组织诱导的初步研究[J].湖南环境生物职业技术学院学报, 2007, 13(1): 6-9.[9] 靳小翠,李志辉,杨模华,等.马尾松幼胚胚性愈伤组织诱导的研究[J].中南林业科技大学学报,2010,30(4):80-84.
[10] Tautorus T E, Lulsdorf M M, Kikcio S I, et al. Bioreactor culture of Picea mariana Mill. (black spuce) and the species complex picea gluca-engelmannii (interior spruce) somatic embryos. growth parameters[J]. Appl. Microbial Biotechnol., 1992, 38(1): 46-51.
[11] Deb C R, Tandon P. Establishment of an embryogenic suspension culture of Pinus kesiya (khasi pine) from various explants[J].Indian Journal of Biotechnology, 2004,3(3):445-448.
[12] 杨金玲,桂耀林,郭仲琛.白杄体细胞胚悬浮培养的动力学研究[J].生物工程学报,2000,16(2): 218-220.
[13] 杨映根,桂耀林,唐 巍,等.青杄愈伤组织在继代培养中的分化能力及染色体稳定性研究[J].植物学报,1994,36(12): 934-939.
[14] Salaj T, Blehova A, Salaj J. Embryogenic suspension cultures of Pinus nigra Arn.: Growth parameters and maturation ability[J].Acta Physiol. Plant, 2007,29(3):225-231.
[15] 刘 华.悬浮培养红豆杉细胞活力及存活率与生长周期的关系[J].生物学杂志,2002,18(1):19-20.
[16] 刘 华,梅兴国.TTC法测定红豆杉细胞活力[J].植物生理学通讯,2001,37(6):537-539.
[17] Litvay J D, Verma D C, Johnson M A. Inf l uence of loblolly pine(Pinus taeda L.). Culture mediun and its components on growth and somatic embryogenesis of the wild carrot (Daucus carota L.)[J].Plant Cell Research, 1985,4(6):325-328.
[18] Carneros E, Celestino C, Klimaszewska K, et al. Plant regeneration in Stone pine (Pinus pinea L.) by somatic embryogenesis[J]. Plant Cell Tiss. Organ Culture,2009,98(2):165-178.
[19] Mosmamn T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays[J].Journal of Immunol Methods,1983,65(1-2):55-63.
Establishment of embryogenic suspension cultures in somatic embryogenesis of Pinus massoniana Lamb.
SHI Kun1a,1b, YANG Mo-hua1a,1b, LI Zhi-hui1b, ZHANG Dong-lin1b,2, WANG Qian1b, DING Gui-jie3
(1a. Hunan Provincial Key Lab. of Forestry Biotechnology; b.College of Forestry, Central South University of Forestry and Technology,Changsha 410004, Hunan, China; 2. University of Georgia, GA 30602, USA; 3. College of Forestry, Guizhou University, Guiyang 550000, Guizhou, China)
The objective of the study was to establish the embryogenic tissues suspension proliferation system using the embryogenic tissues initiated from immature zygotic embryos inPinus massonianaLamb. (masson pine). The effects of initial tissues weight and cell density in subculture were investigated through measuring the sediment cell volume (SCV) and cell viability during the establishment of suspension proliferation system. The results showed that the growth of embryogenic tissues was signif i cantly inf l uenced by initial tissues weight and cells density in suspension cultures; the embryogenic cells growth basically accorded with the “S” growth curve, while the cells viability sharply increased at fi rst and gradually decreased in later. A better suspension proliferation system in masson pine embryogenic cultures was established: 1.0 g tissues per 30 mL fresh liquid media were the appropriate initial tissues weight (the mean growth rate was up to 12.097); then the better cell density in subculture was 1/6 and the appropriate subculture period was identif i ed as 8~12 days. This study provide basic information for optimization of mass propagation in masson pine somatic embryogenesis. The establishment of suspension system is also a basic technique for new variety breeding of masson pine through genetic transformation and cell fusion in masson pine breeding.
biological technology;Pinus massonianaLamb.; embryogenic cultures; suspension culture; growth curve
S791.248
A
1673-923X(2014)01-0064-05
2013-09-20
国家高技术研究发展计划(863计划)课题(2011AA100203),湖南省自然科学基金项目(11JJ3038),国家自然科学基金青年项目(31200481),教育部博士点基金博导类联合资助项目(20104321110002)
史 昆(1988-),男,山西大同人, 硕士研究生,研究方向:林木种苗培育与理论
杨模华(1974-),女,湖南常德人,副教授,博士,研究方向:林业生物技术、森林培育教学和科研;
E-mail:ymh163@163.com
[本文编校:吴 毅]

