共培养技术及化学絮凝法对小球藻C.vulgaris XJB絮凝的影响
周琳,刘龙,谢丽,王思雨,贺莹莹,徐小琳,王长海
(1石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室/省部共建国家重点实验室培育基地,石河子832003;2南京农业大学资源与环境科学学院,南京210095)
在人类主要的能源消耗中,化石能源占88%,这不仅造成一系列的能源危机,同时使气候变暖,产生温室效应[1-2]。所以迫切需要找到新型、清洁、可再生的能源代替化石燃料。生物柴油由于其可再生、可替代和可生物降解,同时对环境无害,成为化石燃料良好的替代品之一[3-4]。目前,生物柴油的生产原料以农作物油(如大豆油、菜籽油、葵花油等)为主,这影响到粮食安全、增加了粮食作物成本;而以餐饮废油、废弃动物油脂生产的生物柴油,则由于原料不稳定导致生物柴油低温流动性较差[5-6]。微藻,是一种光合自养型微生物,存在于地球的每个生态系统中,具有生长周期短、光合效率高,可在极恶劣环境中生长等特点[7]。微藻中的油脂也可用于生产生物柴油,已报道部分微藻油脂含量最高可达细胞干重的70%[8-9],是一类极具发展潜力的生物柴油原料[10]。
微藻细胞尺寸通常只有5-10 μm,细胞密度低,其细胞表面带负电荷,在分散状态时十分稳定,沉降速度低,这些特点使微藻采收比较困难,增加了生物柴油的生产成本[11-13]。据报道,在微藻培养过程中,采收花费占总成本的20%-30%,成为限制微藻大规模培养的一个重要因素[12,14]。目前,主要的采收方法包括离心、过滤、浮选、重力沉降、电泳、絮凝等,其中离心、过滤、浮选、重力沉降和电泳能耗大[13-15]。而絮凝法能耗低,操作简单,与其他采收方法一起使用,可提高采收率[16-17]。常用的絮凝方法有自絮凝法、化学絮凝法和生物絮凝法。化学絮凝法主要为调节 pH和添加絮凝剂。pH调节简单方便,Wu[18]等通过调节藻液pH改变微藻的絮凝率,研究表明,当普通小球藻,栅藻和绿球藻的pH增加到10.6,眼点拟微绿球藻和三角褐指藻的pH分别增加到9.0和9.3时,几株微藻的絮凝率均达到90%以上。FeCl3对微藻絮凝效果较好,是常用的无机絮凝剂之一,薛蓉[19]等采用9种絮凝剂絮凝采收小球藻,其中,FeCl3絮凝效果最好,加入0.3 g/L FeCl3后小球藻在90 min时的絮凝率可达92.3%。壳聚糖是一种天然高分子絮凝剂,当pH=5.5-7.0,壳聚糖浓度大于0.5 g/m3,壳聚糖浓度与藻浓度之比大于0.5 mg/(106个/mL)时,铜绿微囊藻的絮凝率达到90%以上[20]。
微藻如果本身自絮凝性好,则会很大程度上降低采收成本,但不是所有微藻都具有自絮凝性。化学絮凝法通常会引入一些有害化学物质,污染微藻。上述方法都有一定的缺点,而生物絮凝法在一定程度上克服了这些缺点,其中将不同微藻共培养是一种极具前景的生物絮凝法。Salim[21]等采用具有自絮凝性的镰形纤维藻和斜生栅藻絮凝小球藻,采用具有自絮凝性的四鞭片藻絮凝富油新绿藻,结果表明,三种具有自絮凝性的微藻都能极大增加不具有自絮凝效应微藻的絮凝性。
本实验所用微藻为实验室前期分离纯化得到的小球藻C.vulgarisXJB,该小球藻生长速率快,油脂含量高。本实验首先考察常用的3种化学絮凝方法,然后对比共培养技术对小球藻油脂产率及絮凝率的影响,以获得更有应用前景的絮凝方法。
1 材料与方法
1.1 材料
1.1.1 藻种
实验所用小球藻C.vulgarisXJB和斜生栅藻Scenedesmussp.-BH为实验室前期分离纯化得到的,分别分离于新疆博尔塔拉河和石河子北湖表层水样,现保存于石河子大学化学化工学院,新疆兵团化工绿色过程重点实验室。
1.1.2 培养基与培养条件
所用培养基为BG11培养基,配方如下:

微藻培养于2 L锥形瓶中,培养体积1.2 L,接种密度:1.0~2.0×106个 /mL,接种量10%,置于自制荧光灯光照培养架上培养,光照强度(3500±200)lx,光照周期 L:D 为 24:0 h,温度(24±2) ℃,每天振摇3次。微藻培养至稳定期后于4000 r/min离心5 min收获,冷冻干燥12 h后待用。
1.1.3 试剂与仪器
实验所用氢氧化钠、氯化铁、壳聚糖等试剂均为分析纯。主要仪器为:Primo Star显微镜,德国ZEISS公司;TES-1330A数位式光度计,泰仕电子工业股份有限公司;LXJ-IIB低速大容量离心机,上海安亭科学仪器厂;Centrifuge 58 10R高速冷冻离心机,德国 eppendorf公司;AL pHR 1-2 LD冷冻干燥仪,德国 Christ公司。
1.2 方法
1.2.1 微藻生长曲线和生物量的测定
生长曲线绘制:采用分光光度法每天测定混匀后藻液的吸光度,以培养时间为横坐标,吸光度为纵坐标绘制生长曲线。
生物量测定:微藻培养至稳定期后,4000 r/min离心5 min收获微藻,将湿藻体冷冻干燥12 h后得到干藻粉,所得干藻粉重量即为微藻细胞干重,生物量(mg/L)计算公式如下:

1.2.2 微藻油脂含量与油脂产率的测定
实验采用氯仿甲醇法提取微藻中油脂,具体方法如下:准确称取10 mg干藻粉,放入10 mL离心管中,加入 6 mL氯仿甲醇混合液(2∶1,V∶V)混匀,静置0.5 h。加入 1 m l蒸馏水,剧烈振荡30 s,静置2 h分层后4000 r/min离心5 min,吸取下层氯仿层至已知质量的试管(105℃烘箱烘干2 h)中。向含有残渣的离心管中加入4 mL氯仿甲醇混合液(2∶1,V∶V),剧烈振荡 30 s,静置 2 h分层后离心,吸取下层氯仿层至上述试管中。在通风橱中将试管70℃水浴蒸干,放入烘箱中105℃下烘干2 h,冷却至室温,称量试管的质量,试管前后质量之差即为微藻油脂质量。微藻油脂含量(%)和油脂产率(mg/(L·d)),计算公式如下:

1.2.3 微藻絮凝效果的测定
将微藻培养至稳定期,充分摇匀,静置并即刻用计时器计时,一定时间后提取上层藻液至比色皿中,在680 nm波长下测量其吸光度值。不同培养组的藻液提取位置应保持一致。参比溶液为高温灭菌过的BG11培养液。絮凝率(%)的计算公式如下:
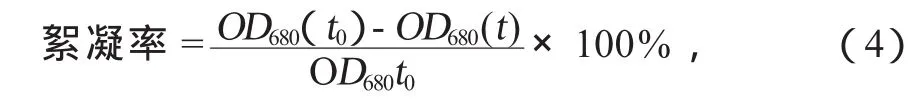
式(4)中:OD680(t0)为680 nm波长下藻液初始吸光度值,OD680(t)为680 nm波长下藻液絮凝时间为t时上层藻液的吸光度值。
1.3 实验设计
1.3.1 pH值对小球藻絮凝的影响
微藻在碱性环境中会出现絮凝现象,且本实验所用小球藻C.vulgarisXJB在稳定期时藻液pH为10.1-10.4,所以本实验采用1 mol/L的NaOH或HCl调节藻液pH值,设置pH值分别为 8、9、10、11、12,其中pH=10为空白对照(培养至稳定期的藻液,未用1 mol/L的NaOH或HCl调节pH值),同时与一直摇匀的未调pH的藻液做对比,每组实验设3个平行。用分光光度计测定藻液240 min内的吸光度,计算絮凝效率。
1.3.2 FeCl3对小球藻絮凝的影响
将微藻培养至稳定期后,加入不同浓度的FeCl3溶液,根据前期的实验研究,将FeCl3溶液浓度设置为0、0.05、0.10、0.15、0.20 和 0.25 g/L,充分摇匀后静置,测定上层清液60 min内不同时间的吸光度值。
1.3.3 壳聚糖对小球藻絮凝的影响
壳聚糖只能溶解于中性或偏酸性环境,其在1%冰醋酸溶液中溶解度较好且粘度较小,因此将壳聚糖溶解于1%冰醋酸中配置成溶液,由于溶剂(冰醋酸)对的pH略有影响,根据前期实验,设置壳聚糖溶液浓度分别为0、0.0010、0.0025、0.0040、0.0055 g/L,并在加入壳聚糖后调节藻液最终pH为6,充分摇匀后静置,测定絮凝效果。
1.3.4 共培养技术对小球藻絮凝的影响
实验室前期分离出的斜生栅藻Scenedesmussp.-BH具有很好的自絮凝性,由此设计实验:将斜生栅藻Scenedesmussp.-BH和小球藻C.vulgarisXJB稀释至浓度相当的接种藻液,按不同体积比进行实验,并设斜生栅藻Scenedesmussp.-BH和小球藻C.vulgarisXJB两个对照组,实验分组如表1所示。每天分别以小球藻C.vulgarisXJB(-Q)和斜生栅藻Scenedesmussp.-BH(-S)为基准测定微藻生长情况,绘制微藻生长曲线。将微藻培养至稳定期,充分摇匀后静置,测定其摇匀后 0、0.5、1.0、1.5、2.0、3、4、5、6、7、8 h时的吸光度A值。
2 结果与分析
2.1 小球藻C.vulgaris XJB生长及自絮凝情况
通过光学显微镜观察从博尔塔拉河中筛分出的藻种,根据微藻的细胞形态、大小、结构,并参照《中国淡水藻志》和《中国淡水藻类—系统、分类及生态》对微藻进行鉴定,鉴定结果该微藻为小球藻,将其命名为C.vulgarisXJB[4]。
对小球藻C.vulgarisXJB的生长及自絮凝情况进行测定,结果如图1所示。
图1a为小球藻C.vulgarisXJB的生长曲线。由图1a中可以看出,小球藻C.vulgarisXJB的延滞期很短,培养1 d后就进入对数生长期,经过6 d的培养,小球藻C.vulgarisXJB的生长趋于稳定。
图1b为小球藻C.vulgarisXJB的絮凝曲线,可以看出:絮凝率在最初的2 h内迅速上升后逐渐趋于稳定,经过8 h的静置,小球藻C.vulgarisXJB的絮凝率为51.7%。
对小球藻C.vulgarisXJB的生物量、油脂含量及油脂产率进行了测定,经过8 d的培养,小球藻C.vulgarisXJB的生物量为52.2 mg/L,说明小球藻C.vulgarisXJB生长迅速。小球藻C.vulgarisXJB的油脂含量和油脂产率分别为17.8%和1.33 mg/(L/d),油脂积累量多,是生物柴油理想的原料。
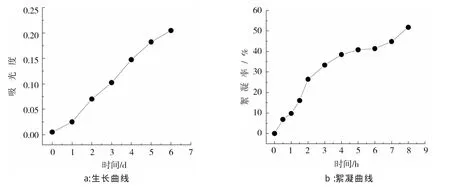
图1 小球藻C.vulgaris XJB的生长曲线(a)和絮凝曲线(b)Fig.1 The growth curve(a) and flocculation curve(b) of C. vulgaris XJB
2.2 不同絮凝剂对小球藻絮凝的影响
2.2.1 pH对小球藻絮凝率、生物量与油脂含量的影响
微藻细胞表面存在羟基、羧基、巯基等带负电荷的集团,培养液为碱性时可以中和微藻表面负电荷,使微藻团聚絮凝。
图2a为小球藻C.vulgarisXJB在不同pH条件下的絮凝曲线。
由图2a可知:调节pH为碱性后,小球藻C.vulgarisXJB的絮凝率在10 min内迅速增加,120 min后絮凝率基本保持不变。絮凝效果最好的是pH=12,该条件下微藻在240 min时的絮凝率可达93.8%。
图2b反映了不同pH对小球藻C.vulgaris生物量、油脂含量和油脂产率的影响。
由图2b可见:随着藻液pH的增加,小球藻C.vulgarisXJB的生物量、油脂含量和油脂产率逐渐增加。pH=12时的生物量、油脂含量和油脂产率比其他条件下高,所以,pH=12为小球藻C.vulgarisXJB的最佳絮凝pH,此时小球藻C.vulgarisXJB的生物量、油脂含量和油脂产率分别为 88.4 mg/L,18.5%和1.816 mg/(L·d),是未调节 pH 时的 2.03倍,1.05倍和2.14倍。
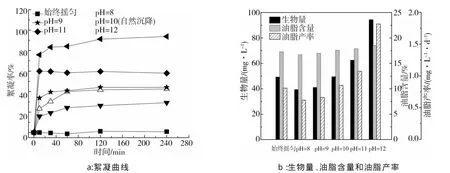
图2 不同pH对C.vulgaris XJB 的絮凝曲线(a)、生物量、油脂含量和油脂产率(b)的影响Fig.2 The effect of different pH on flocculation curve(a),biomass,lipid content and lipid productivity(b) from C.vulgaris XJB
2.2.2 FeCl3对小球藻絮凝率、生物量与油脂含量的影响
Fe3+可以中和微藻表面的负电荷使微藻絮凝,在一定条件下,Fe3+还可以形成胶体和沉淀,以吸附架桥和卷扫网捕的形式使微藻絮凝[22]。
图3是不同FeCl3浓度对C.vulgarisXJB的絮凝曲线(a)、生物量、油脂含量和油脂产率(b)的影响。
由图3a可以看出:FeCl3可明显促进小球藻C.vulgarisXJB的絮凝,在8 min内的絮凝率均迅速增加。随着FeCl3浓度的增加,小球藻C.vulgarisXJB的絮凝率逐渐增大,但继续增大FeCl3浓度,絮凝率反而降低。FeCl3浓度0.10 g/L时的絮凝效果最好,8 min时的絮凝率为85.5%,60 min时的絮凝率可达96.5%。
由图3b可以看出:向藻液中添加不同浓度的FeCl3后,小球藻C.vulgarisXJB生物量增加,油脂含量减少。5组不同浓度的FeCl3中,0.10 g/L的FeCl3油脂含量最高,为14.8%。综合考虑,0.10 g/L为FeCl3的最佳絮凝浓度。但实验过程中发现,向藻液中添加FeCl3,虽然会使小球藻C.vulgarisXJB迅速絮凝,但在收获小球藻C.vulgarisXJB时,残留在细胞上的FeCl3不易被清除干净,使藻粉发黄。同时FeCl3过多会使细胞破裂,使细胞内油脂流失。所以FeCl3虽然絮凝性好,但不宜用来絮凝小球藻C.vulgarisXJB。
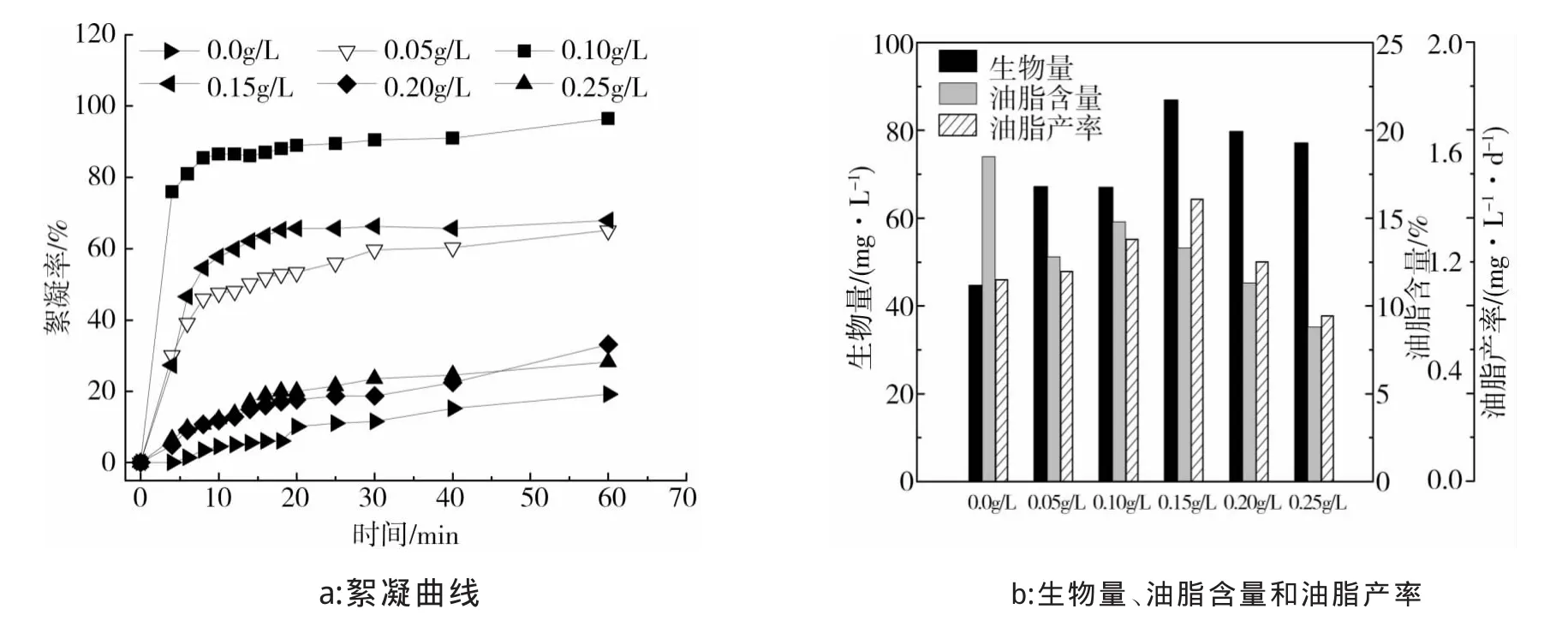
图3 不同FeCl3 浓度对C.vulgaris XJB 的絮凝曲线(a)、生物量、油脂含量和油脂产率(b)的影响Fig.3 The effect of different FeCl3 concentration on flocculation curve (a),biomass,lipid content and lipid productivity(b) from C.vulgaris XJB
2.2.3 壳聚糖对小球藻絮凝率、生物量与油脂含量的影响
图4是不同壳聚糖浓度对C.vulgarisXJB的絮凝曲线(a)、生物量、油脂含量和油脂产率(b)的影响。
由图4a可以看出,添加壳聚糖会使小球藻C.vulgarisXJB的絮凝率增加。随着壳聚糖浓度的增大,小球藻C.vulgarisXJB的絮凝率逐渐增加,当壳聚糖浓度增大到0.0040 g/L后,小球藻C.vulgarisXJB的絮凝率开始下降,说明壳聚糖浓度为0.0040 g/L对小球藻C.vulgarisXJB的絮凝效果最好,但60 min后小球藻C.vulgarisXJB的絮凝率只有72.9%。这是由于壳聚糖溶于烯酸时带正电荷,虽然可以通过聚合物架桥和电荷中和作用使微藻絮凝,但其所带正电荷较弱,所以絮凝效果稍差。
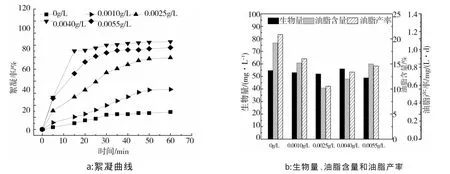
图4 不同壳聚糖浓度对C.vulgaris XJB 的絮凝曲线(a)、生物量、油脂含量和油脂产率(b)的影响Fig.4 The effect of different chitosan concentration on flocculation curve (a),biomass,lipid content and lipid productivity(b) from C.vulgaris XJB
由图4b可以看出,向藻液中添加壳聚糖溶液后,小球藻C.vulgarisXJB的生物量稍有下降,但壳聚糖浓度为0.0040 g/L时小球藻C.vulgarisXJB的生物量比未添加壳聚糖时高,为56.1 mg/L。添加壳聚糖溶液后,小球藻C.vulgarisXJB的油脂含量和油脂产率都比未添加时低。在不同的壳聚糖浓度中,壳聚糖浓度0.0010 g/L时小球藻C.vulgarisXJB的油脂含量和油脂产率最高,分别为15.2%和0.897 mg/(L·d),接下来依次是 0.0055、0.0040和 0.0025 g/L。综合考虑,壳聚糖浓度0.0055 g/L为最佳絮凝浓度,此时小球藻C.vulgarisXJB的生物量,油脂含量和油脂产率分别为48.9 mg/L、15%和0.815 mg/(L·d)。
2.3 斜生栅藻生长及自絮凝情况
通过光学显微镜观察从新疆北湖中筛出的纯藻,并通过分子生物学对其鉴定,鉴定结果该微藻为斜生栅藻,将其命名为Scenedesmussp.-BH[23]。
图5a为小球藻C.vulgarisXJB的生长曲线,可以看出:斜生栅藻Scenedesmussp.-BH的延滞期较短,经过6 d培养达到稳定期。图5b为斜生栅藻Scenedesmussp.-BH的絮凝曲线,可见:絮凝率在1 h即可达到63.6%,后逐渐趋于稳定,经过8 h的静置,斜生栅藻Scenedesmussp.-BH的絮凝率为95.0%,具有很强的自絮凝性。
经过8 d的培养,斜生栅藻Scenedesmussp.-BH的生物量、油脂含量和油脂产率分别为33.3 mg/L、14.4%和0.69 mg/(L·d)。
Salim[21]等对微藻絮凝机理的研究结果表明,带正电荷的聚合物是通过架桥和修补作用使微藻自絮凝或絮凝其他微藻,对于微藻,这种聚合物可能是多糖。郭锁莲[24]研究了使斜生栅藻自絮凝和絮凝其他微藻的物质,根据薄层板原位显色、紫外光谱和红外光谱等方法对该物质进行测定,结果表明该物质是多糖,且其中中性糖、酸性糖和氨基糖质量分数之比为16∶9∶1,单糖中的甘露糖含量多且分子量大。
2.4 共培养技术对小球藻絮凝率、生物量与油脂含量的影响
将有自絮凝效应的斜生栅藻Scenedesmussp.-BH与小球藻C.vulgarisXJB按不同体积比共培养,不同比例、不同基准下的微藻生长曲线如图6所示。
由图6可以看出:小球藻C.vulgarisXJB比斜生栅藻Scenedesmussp.-BH生长迅速,经过6 d的培养,小球藻C.vulgarisXJB的生物量是斜生栅藻Scenedesmussp.-BH的1.57倍。2种微藻共培养时,彼此相互影响,没有单独培养时生长快。
不同共培养比例下微藻的絮凝情况如图7a所示。由图7a可以看出,对照组斜生栅藻Scenedesmussp.-BH(S)的自絮凝性非常好,8 h后的絮凝率是对照组小球藻C.vulgarisXJB(Q)絮凝率的1.84倍。斜生栅藻Scenedesmussp.-BH与小球藻C.vulgarisXJB 73.2%。
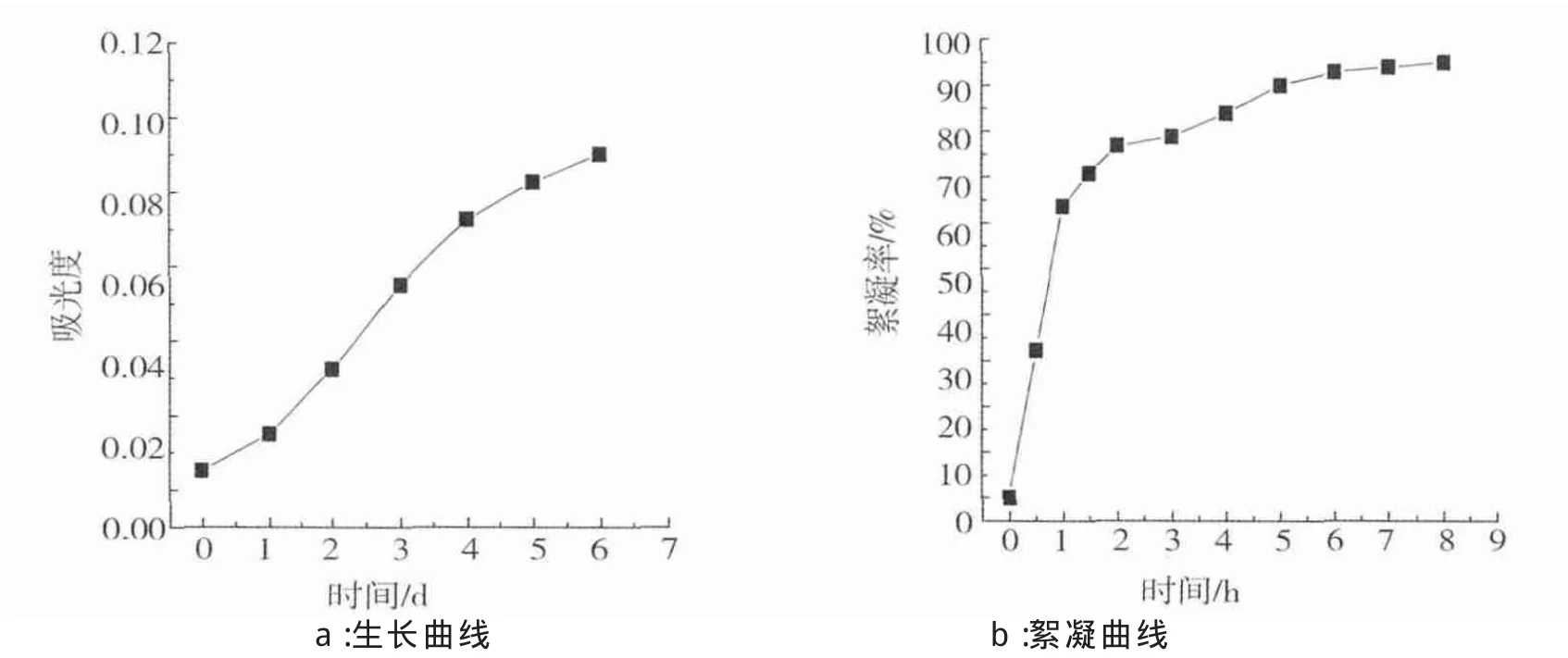
图5 斜生栅藻Scenedesmus sp.-BH的生长曲线(a)和絮凝曲线(b)Fig.5 The growth curve(a)and flocculation curve(b)of Scenedesmus sp.-BH
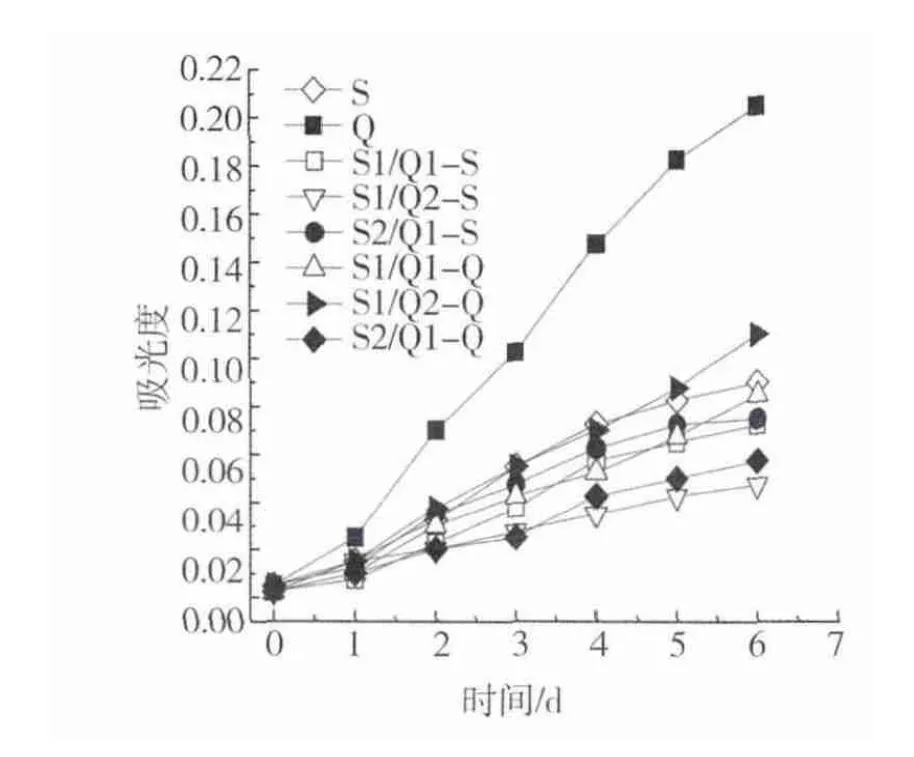
图6 不同比例下共培养微藻的生长曲线Fig.6 The microalgae growth curve under the different coculture ratio
(2)斜生栅藻Scenedesmussp.-BH与小球藻C.vulgarisXJB共培养时的絮凝率虽然稍低于化学絮凝法,但该方法不会引入有害化学物质,后期的采收、油脂提取过程不需要增加额外的步骤,且环境友好,是一种具有潜在应用前景的絮凝方法。
[1]Brennan L,Owende P.Biofuels from microalgae-A review of technologies for production processing and extractions of biofuels and coproducts[J].Renewable and Sustainable Energy Reviews,2010,14(2):557-577.
[2]Yoo C,Choi G G,Kim S C,et al.Ettliasp.YC001 showing high growth rate and lipid content under high CO2[J].Bioresource Technology,2013,127:482-488.
[3]Pragya N,Pandey P K,Sahoo P K.A review on harvesting,oil extraction and biofuels production technologies from microalgae[J].Renewable and Sustainable Energy Reviews,2013,24:159-171.
[4]王思雨,徐小琳,贺莹莹,等.三吲哚乙酸对Chlorella vulgarisXJB生长及产油能力的影响[J].石河子大学学报:自然科学版,2013,31(4):499-503.
[5]Singh B,Guldhe A,Rawat I,et al.Towards a sustainable approach for development of biodiesel from plant and microalgae[J].Renewable and Sustainable Energy Reviews,2014,29:216-245.
[6]Rawat I,Kumar R R,Mutanda T,et al.Biodiesel from microalgae:A critical evaluation from laboratory to large scale production[J].Applied Energy,2013,103:444-467.
[7]贺莹莹,徐小琳,王思雨,等.响应面法优化碱提斜生栅藻多糖的提取工艺[J].石河子大学学报:自然科学版,2013,31(3):371-376.
[8]Mata TM,Martins A A,Caetano N S.Microalgae for biodiesel production and other applications:A review[J].Renewable and Sustainable Energy Reviews,2010,14(1):217-232.
[9]Suali E,Sarbatly R.Conversion of microalgae to biofuel[J].Renewable and Sustainable Energy Reviews,2012,16(6):4316-4342.
[10]徐檬,徐小琳,李春.氮,磷对富油荒漠微藻混养生长及总脂的影响[J].石河子大学学报:自然科学版,2013,30(4):401-406.
[11]Rwehumbiza V M,Harrison R,Thomsen L.Alum-induced flocculation of preconcentrated Nannochloropsis salina:Residual aluminium in the biomass,FAMEs and its effects on microalgae growth upon media recycling[J].Chemical Engineering Journal,2012,200-202:168-175.
[12]Granados M R,Acién F G,Gómez C,et al.Evaluation of flocculants for the recovery of freshwater microalgae[J].Bioresource Technology,2012,118:102-110.
[13]Chen C Y,Yeh K L,Aisyah R,et al.Cultivation,photobioreactor design and harvesting of microalgae for biodiesel production:A critical review[J].Bioresource Technology,2011,102(1):71-81.
[14]Zhou W,Min M,Hu B,et al.Filamentous fungi assisted bioflocculation:A novel alternative technique for harvesting heterotrophic and autotrophic microalgal cells[J].Separation and Purification Technology,2013,107:158-165.
[15]Coward T,Lee JG M,Caldwell G S.Development of a foamflotation system for harvesting microalgae biomass[J].Algal Research,2013,2(2):135-144.
[16]张鹏,李兴锐,张永奎.用壳聚糖絮凝法采收小球藻及上清液再利用的研究[J].大连海洋大学学报,2012,27(2):162-165.
[17]张海阳,匡亚莉,林喆.能源微藻采收技术研究进展[J].化工进展,2013,32(9):2092-2098.
[18]Wu Z,Zhu Y,Huang W,et al.Evaluation of flocculation induced by pH increase for harvesting microalgae and reuse of flocculated medium[J].Bioresource Technology,2012,110:496-502.
[19]薛蓉,陆向红,卢美贞,等.絮凝法采收小球藻的研究[J].可再生能源,2012,30(9):80-84.
[20]翟玥,杨哲,安阳,等.壳聚糖凝聚去除景观水中微囊藻的研究[J].净水技术,2009,28(6):58-60,68.
[21]Salim S,Bosma R,Vermu M H,et al.Harvesting of microalgae by bio-flocculation[J].JAppl Phycol,2011,23(5):849-855.
[22]林喆,匡亚莉,郭进,等.微藻采收技术的进展与展望[J].过程工程学报,2009,9(6):1242-1248.
[23]He Y,Zhou L,Xu X,et al.Uniform design for optimizing biomass and intracellular polysaccharide production from selfflocculatingScenedesmussp.-BH[J].Annals of Microbiology,2014,1-9.
[24]郭锁莲.转基因絮凝斜生栅藻的构建和自絮凝斜生栅藻细胞絮凝的研究[D].大连:大连理工大学,2013:78-104.
