去花对菊芋干物质和糖分积累与分配的影响
李辉,许欢欢,赵耕毛,梁明祥*
(1.南京农业大学资源与环境科学学院,江苏南京210095;2.江苏省海洋生物学重点实验室,江苏南京210095)
菊芋(Helianthus tuberosus)是菊科向日葵属的栽培植物,又称洋姜或鬼子姜[1]。菊芋具有很强的生态适应性,耐寒、耐旱、耐贫瘠和耐盐碱。地上茎杆富含纤维可以做成高密度纤维板和饲料,地下块茎除了做饲料外,块茎富含菊糖为天然果聚糖,是食品中的甜剂、健康的食品纤维和脂肪替代物的理想原料[2],同时,菊芋块茎还可以生产燃料乙醇、生物柴油等新兴生物质能源[3-4]。
碳水化合物是植物光合同化作用的主要产物,光合同化产物在植物体内的积累和分配与产量密切相关[5],同化物分配过程是植物生长的关键环节,在很大程度上决定了植物的生长速率、生长模式[6],及植物的竞争能力,对于植物结构的形成也起着重要的作用[7]。菊芋块茎中的同化物来自地上部同化物(源)的积累与分配,地上部同化物的积累与分配对块茎的形成起着重要的作用。另外,块茎(库)对同化物的竞争能力也直接影响到同化物在植物体各器官之间的分配[8]。过去的研究已经发现叶片是同化物形成的主要场所,以蔗糖的形式通过茎中的输导组织向地下部转运,在块茎中积累并转变为高聚合度的果聚糖[9]。植物开花是植物从营养生长转化成生殖生长中最关键的一步,但开花过程同时消耗植物大量的能源。菊芋主要依靠无性繁殖进行繁衍(块茎),虽然部分品种能够开花,但种子的数量极少并且萌发率也不高。目前对植物进行摘除花朵的研究较少,对植株进行打顶研究的比较多,研究中发现摘除花朵可以提高植株的花絮有效率[10],打顶可以增加叶片的光照强度,减少生殖消耗,从而对产量提高有显著的影响[11]。在农业生产实践中,植物打顶和去花处理有着广泛的应用,但对于菊芋的去花处理对植物生长状态尤其是块茎的影响还没有研究。因此研究菊芋去花行为对块茎的生物量以及果聚糖模式的影响对指导生产实践具有重要的意义。
本文以青芋二号为试材,在南京农业大学牌楼实验基地的露天温室进行土培实验,跟踪观察其整个生长期并比较对其进行去花与不去花处理,测定了去花处理后地上部分和地下部分(块茎)生物量等生理指标。通过HPLC对青芋二号4个不同发育时期的块茎(根)、茎、叶糖分的测定,来探索青芋二号整个生长期的糖分累积与转运分布模式,通过对去花与不去花的块茎糖分的测定来弄清青芋二号花朵的去除与否对青芋二号块茎糖分的影响,为以后提高菊芋块茎质量以及进一步的开发利用提供参考。
1 材料与方法
1.1 材料
选用菊芋品种青芋二号作为试材,块茎来自南京农业大学863实验基地江苏省大丰市金海农场。
实验于2012年3月在南京农业大学牌楼温室进行。采用露天栽培,土壤基本性质为有机质8.36 g/kg,全磷0.024 g/kg,钾0.134 g/kg,全氮0.024 g/kg,pH 值7.3,盐分0.17 g/kg;间距40 cm,行距60 cm,纵深70 cm,施有机肥150 g(镇江兴农有机肥有限公司,有机质含量≥50%,氮、磷、钾含量2.5%)作为底肥,选取大小一致的菊芋块茎栽种。在种植后80 d与花蕾期(110 d)之间再施一次有机肥,每株100 g。
实验设计如下:实验设对照(CK,不去花菊芋植株)和去花处理(T,去花菊芋植株),种植青芋二号40株,每个处理3次重复,分4个时期进行采样(种植后80,110,150,210 d),去花处理是在花蕾出现的时候去除植株上所有的花蕾,处理时间大概需要持续1.5个月(大约在种植后80 d后开始去花处理),地上部与地下部分开采样,地上部称鲜重,烘干称干重;地下部称量鲜重,烘干后称干重计算干物质含量;取同等部位叶片、茎基部(5~10 cm)和块茎(根)烘干用于糖分测定。
1.2 试验方法
1.2.1 青芋二号全生育周期的地上部和地下部鲜重、干重、茎分枝数、块茎的长度、直径(用游标卡尺进行测量)和数量的测定 鲜重和干重测定方法:采样后用自来水冲洗干净然后用去离子水冲洗干净,用吸水纸吸干样品上的水分,用天平分别对地上部分和地下部分进行称量,所得重量即为地上部和地下部鲜重;然后将地上部和地下部放于烘箱110℃杀青10 min,75℃烘至恒重,再次称重(干重)。
1.2.2 糖分含量的测定 可溶性总糖的提取:菊芋块茎(种下后210 d的样品)、根、茎、叶(种下后80,110,150 d的样品)等鲜样于烘箱中75℃下恒温烘48 h;组织样品研磨后,与去离子水按1∶3(g/mL)比例混匀,放进100℃的水浴锅中20 min以去除蛋白,反复抽提3次,收集3次提取的所有溶液;将第二步所得的溶液过滤,滤液10319 r/min离心20 min,收集上清;所获得的滤液过固相萃提柱GracePureTMSPE C18-Max(GRACE公司),滤液过0.45 μm水相滤膜过滤,获取上样液。可溶性总糖(total soluble sugar,TSS)含量的测定采用苯酚-硫酸法[12]。总还原糖(total reducing sugar,TRS)含量的测定采用二硝基水杨酸(dinitro salicylic acid,DNS)法[13]。
果糖、葡萄糖、蔗糖、蔗果三糖、蔗果四糖、蔗果五糖HPLC-ELSD检测:取0.5 mL上样液于上样瓶中,上机测定,样品进样量为10 μL,梯度洗脱条件为:流速为1 mL/min,每次样品的运行时间为55 min。0~15 min流动相:25%水(B),75%乙腈(C);15~30 min流动相:35%水(B),65%乙腈(C);30~40 min流动相:50%水(B),50%乙腈(C);40~42 min流动相:50%水(B),50%乙腈(C);42~55 min流动相:25%水(B),75%乙腈(C)(“%”表示体积百分含量)。
所需设备:高效液相色谱仪(Agilent1200)、糖柱(PrevailTMCarbohydrate ES Coloumn-W250*46mm 5um)和蒸发光检测器(Alltech ELSD 3300)。
所需试剂:HPLC(High Performance Liquid Chromatography)级乙腈、超纯水。
1.3 数据处理
利用Microsoft Excel和SPSS 16.0软件进行试验数据的统计分析。图片采用SigmaPlot软件绘制。
2 结果与分析
2.1 青芋二号去花处理对块茎的影响
通过对青芋二号全生育期的跟踪观察,在块茎种下3周后出苗;出苗4周后进入快速生长期,这一时期持续1个月的时间,在这一阶段植株分枝开始出现并逐渐增多,平均每株7条分枝(取样);出苗后第8周青芋二号植株上开始出现花蕾,正式进入花蕾期阶段,在这一阶段,分枝数达到最多,稳定在每株22枝,此时青芋二号出现匍匐茎;花蕾期持续2周后,青芋二号花蕾绽放,此时进入开花期,青芋二号的整个开花期持续的时间较长,大概8周的时间,此时块茎开始形成(分别在花蕾后期和完全开花后期取样2次);花后2个月左右地上部分植株基本枯萎,这一阶段块茎不断膨大(取样),直到地上部分全部枯死。由于菊芋的花期较长,同时花蕾不时出现,因此本实验中仅对完全去花处理后的块茎进行了比较。去花处理后,青芋二号的块茎数量和块茎大小都增加了,去花处理后平均每株块茎为56.33个,与对照相比增加了39.67%,处理后平均每株块茎长度为5.90 cm,与对照相比增加了59.46%,块茎干重比对照的增加了22.53%;观察测定发现,地上部鲜重、地上部干重、地下部鲜重、地下部干重在全生育期呈先上升后下降的趋势,都在开花期(150 d)达到最大值,分别为:845.78,258.07,168.93,51.15 g,分别比快速生长期(80 d)增加了 530.94%,753.97%,391.08%,717.09%(表1)。

表1 青芋二号去花处理对块茎的影响Table 1 Effect of defloration on Qingyu No.2 tuber production
2.2 青芋二号全生育期可溶性总糖变化趋势及去花对块茎可溶性总糖含量的影响
植物可溶性总糖包含常见的单糖,二糖和多糖(在菊芋中主要包含不同聚合度的果聚糖),对植物总的可溶性糖的测定可以弄清糖类物质在菊芋植物中积累和分配模式。由图1可知,可溶性总糖在不同生长时期的各种器官中,在相同重量的干重组织样品下,块茎的含量是最多的,随着植株的生长含量也是不断增加,在收获时候(种下后210 d)达到最大值,在未去花植株的块茎中平均达到619.13 mg/g干重;茎和叶中的可溶性总糖含量在开花前均相对稳定,但开花后含量急剧下降,在210 d时降为0,此时植物茎叶已经枯萎。对青芋二号进行去花处理,可以看出,去花处理后,块茎中的可溶性总糖含量与对照相比差异显著,去花处理后相同重量的干重中可溶性总糖显著下降,但去花处理后总的植物块茎的鲜重增加了33.18%。综合以上结果表明,青芋二号随着不断的生长,相同干重下的植物总糖含量是不断增加的,种下后150 d与种下后80 d相比增加了34.21%;去花处理后块茎总的可溶性总糖的含量与对照相比上升了13.73%。
2.3 青芋二号全生育期还原糖变化趋势及去花对还原糖含量的影响
植物中常见的还原糖包括几乎所有的单糖和大部分二糖(蔗糖除外)等。如图2所示,还原糖含量在各组织器官中,叶中的含量是最低的;在茎叶未枯萎之前,茎中的还原糖含量是最高(但只在种植后150 d同根相比有显著性差异),其次是根;茎中的还原糖含量在整个生育期中是先递增而后降低,在110 d时达到最大值,为35.67 mg/g干重(但同根相比无显著性差异);叶中还原糖含量变化很小,茎叶中的还原糖含量在210 d时为0,这是因为茎叶基本枯萎。去花处理后,与对照相比,同时期相同干重的块茎中还原糖含量升高了,但差异不显著。以上结果表明,在地上组织枯萎之前,还原糖等主要积累在茎和根中,在植株开完花后,茎根中的还原糖快速转入块茎中,并同时聚合成高聚合度的果聚糖。去花处理稍微提高了青芋块茎单位重量的还原糖。
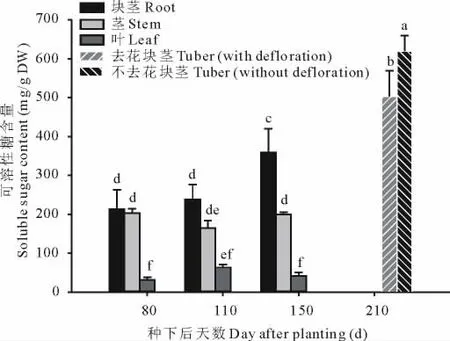
图1 青芋二号去花处理对块茎可溶性糖含量的影响Fig.1 Effect of defloration on soluble sugar content in Qingyu No.2 tubers
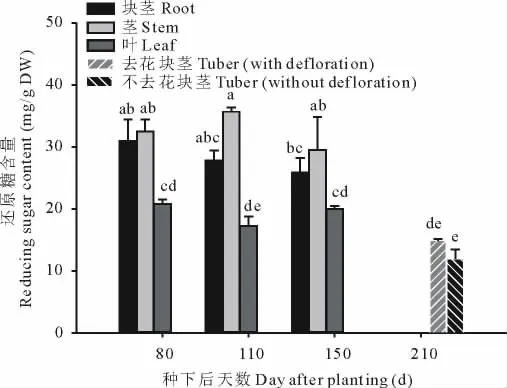
图2 青芋二号去花处理对块茎还原糖含量的影响Fig.2 Effect of defloration on reducing sugar content in Qingyu No.2 tubers
2.4 青芋二号全生育期葡萄糖含量变化趋势及去花对葡萄糖含量的影响
光合作用最主要的产物是碳水化合物,一般认为最初的产物为磷酸丙糖,该糖可在植物体内转变为果糖和葡萄糖,蔗糖就是在6-磷酸果糖和6-磷酸葡萄糖的基础上聚合而成。由于还原糖的测定并不能辨别当中各个组成成分的构成和含量,因此我们采用液相色谱的方法来检测各个组成成分。通过对菊芋果聚糖检测方法的摸索,我们成功建立了菊芋不同糖分的检测方法。图3为利用HPLC-ELSD方法测定的各个不同青芋器官中糖含量图,从图3中可以发现,葡萄糖,果糖,蔗糖等首先洗脱出来,高聚合度的果聚糖后洗脱出来。菊芋茎和叶中的高聚合度的果聚糖含量较低,在块茎和根中的果聚糖含量较高,由于比蔗果五糖更高聚合度的糖标准品没有,图中仅仅标记到蔗果五糖。由图4可知(仅以生长110 d的青芋2号根、茎和叶样品为例),青芋二号葡萄糖含量总体呈逐渐下降趋势。具体表现,在80 d时葡萄糖含量最高的是根,最大值为17.59 mg/g干重;在110 d时葡萄糖含量最高的是茎,在150 d时最高的是叶;在种下后210 d时在各个组织器官中根达到最低值,为0.28 mg/g。在根茎中的含量随着生长的进行呈逐渐下降趋势;葡萄糖在叶中的含量也是在种下后80 d达到最大值,为9.53 mg/g,在叶中葡萄糖含量呈先下降而后又上升的趋势。去花处理后,与未去花对照相比块茎中的葡萄糖含量增加了但是差异不显著,这表明去花处理较少影响最终葡萄糖在根中的积累。
2.5 青芋二号全生育期果糖含量变化趋势及去花对果糖含量的影响
如图3所示,在青芋二号的全生育周期中,果糖含量相对于葡萄糖而言,总体上是高于葡萄糖在各个组织中的水平,但在叶片中两者相差不大。果糖含量在各个组织器官中总体上呈递减趋势(图5),具体如下:果糖含量在茎叶枯萎之前,在茎中的含量是最多的,其次是根系,最少的是叶,在叶中的变化幅度很小。果糖含量在茎中的最大值出现在种下后80和110 d,此时段是植物快速生长期和花蕾期;根中果糖含量随着植物的生长发育在减少,到收获时基本为0。进行去花处理后,块茎中果糖含量与对照相比增加了65.78%,可能的原因是去花后让更多地上部分果糖往块茎中转运。以上结果表明,果糖在生长季主要积累在根茎中,叶中含量稍低。
2.6 青芋二号全生育期蔗糖含量变化趋势及去花对蔗糖含量的影响
在叶片中,糖的成分主要以还原糖为主,基本上是以低分子量的糖为主(图1,2,3)。如图6可知,除叶片外,根和茎中的蔗糖含量呈先下降后基本持平的趋势,叶中的蔗糖含量相对根茎大幅减少,在不同生长时期中总体呈持平的趋势;根和茎蔗糖含量在种下后80 d时达到最大值,分别为22.96和16.12 mg/g,在110 d下降至80 d的50%左右,但在150 d又逐渐上升。在210 d的块茎中,蔗糖含量较高。去花处理后,与对照相比蔗糖含量没有变化,说明去花处理对块茎中蔗糖积累没有多大影响。

图3 青芋二号花蕾期根(a)、茎(b)、叶(c)和去花块茎(d)、未去花块茎(e)糖的HPLC-ELSD图Fig.3 Soluble sugar patterns for Qingyu No.2 roots(a),stems(b),leaves(c)and flower late tubers with(d)or without defloration treatments(e)in flower bud stage by HPLC-ELSD
2.7 青芋二号全生育期蔗果三糖含量变化趋势及去花对蔗果三糖含量的影响
根据我们的实验结果初步估算,在根中随着生长阶段的不同,蔗果三糖含量在5.93~14.83 mg/g范围内,叶中是0.20~0.49 mg/g,在块茎中,95%以上的糖分为非还原糖,其中主要的成分为不同聚合度的果聚糖,因此有必要检测果聚糖的组成和含量。蔗果三糖在植物中主要由果糖和蔗糖聚合而成,如图7所示,蔗果三糖主要分布在根和块茎、茎中,在叶中的含量很少,在根和茎中蔗果三糖的含量呈先下降后上升趋势。在210 d块茎中的蔗果三糖含量达到最大值,为14.93 mg/g,在整个生长期中的茎中,80 d的茎中蔗果三糖含量达到9.12 mg/g,在110 d叶中蔗果三糖含量达到最大值,为0.49 mg/g,但同其他各个时期相比,叶中的含量基本稳定。去花处理对块茎中蔗果三糖含量没有影响。以上结果表明,蔗果三糖在生长期主要分布在根和茎中,在叶片中含量很少,在块茎形成期,主要积累在块茎中。
2.8 青芋二号全生育期蔗果四糖含量变化趋势及去花对蔗果四糖含量的影响
蔗果四糖在植物中主要在蔗果三糖等的基础上和果糖聚合而成。从图8可知,蔗果四糖同蔗果三糖一样,主要分布在块茎、根和茎中,含量最多的是在块茎中;蔗果四糖在生长期中,在根中先呈递减趋势,然后升高,在150 d达到最大值,为21.65 mg/g干重;蔗果四糖在茎中呈持续下降趋势,在80 d达到最大值,为11.90 mg/g干重;在叶中的含量很少,有的时期几乎为0。去花处理与对照相比,蔗果四糖含量没有什么变化,说明去花与不去花处理对蔗果四糖含量几乎没有影响。从以上结果可知,蔗果四糖在块茎生成前主要分布在根和茎中,在叶中分布很少,在块茎生成后主要存储在块茎中。

图4 青芋二号去花处理对块茎葡萄糖含量的影响Fig.4 Effect of defloration on glucose content in Qingyu No.2 tubers

图5 青芋二号去花对块茎果糖含量的影响Fig.5 Effect of defloration on fructose content in Qingyu No.2 tubers

图6 青芋二号去花处理对块茎蔗糖含量的影响Fig.6 Effect of defloration on sucrose content in Qingyu No.2 tubers
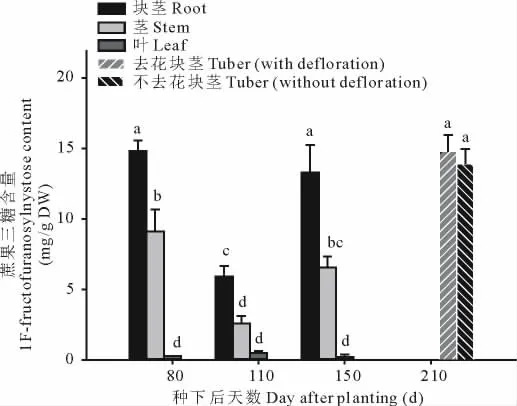
图7 青芋二号去花对块茎蔗果三糖含量的影响Fig.7 Effect of defloration on 1F-fructofuranosylnystose content in Qingyu No.2 tubers
2.9 青芋二号全生育期蔗果五糖含量变化趋势及去花对蔗果五糖含量的影响
蔗果五糖在植物中主要由蔗果三糖或者四糖合成。从图9可知,蔗果五糖主要存在块茎中,其次是生长后期的根中,在叶片中含量很少,有的时期几乎为0。蔗果五糖在生长初期,在根中含量较低,在150 d达到最大值,为28.28 mg/g;而在生长期的茎中基本保持恒定,在80 d达到最大值,为11.24 mg/g;在叶中的含量很少。去花处理与对照相比,块茎中的蔗果五糖含量比对照高。从以上结果可知,蔗果五糖主要积累在植物生长后期的根和块茎中,其次是在茎中,在叶中分布很少。
3 讨论
3.1 青芋二号去花处理对其块茎生物量的影响
生物量是衡量植物生长态势的直接总体指标,包括鲜重(未去除水分)和干重(去除水分即干物质)。一般来说,干物质在叶片中通过光合作用合成或者从其他器官中贮藏的物质转化而来,通过维管束运输,各个器官从维管束中吸收同化物加以利用,所以所有器官和组织都可以分为源(source,指能够通过光合生产或者由贮藏物质转化生成,并输出同化物的组织、器官或部位,如绿色植物的功能叶,种子萌发期间的胚乳或子叶,春季萌发时两年生或多年生植物的块根、块茎、种子等)和库(pool,指消耗或贮藏同化物的器官,如嫩叶、种子、果实、根和贮藏组织)[5]。本实验研究主要通过对青芋二号全生育期的块茎数量大小、地上部鲜重、地上部干物质、地下部鲜重、地下部干物质以及去花处理对块茎生物量的影响跟踪观察测量(表1),结果表明,地上部干物质呈先增加后降低的趋势,在种下后150 d(开花期)时达到最大值,之后又开始下降,这是因为青芋二号在开花期生长量达到鼎盛,在这之前植株通过光合作用生成的能量主要用来供给完成植株根、茎、叶的正常生长。在这一时期,青芋二号块茎开始膨大,块茎膨大所需的物质就需要通过地上部转运至地下部,在这时期后地上部的茎叶不会再继续生长,它们光合作用生成的物质一部分维持自身需要,但大部分都转运至地下部供给块茎的膨大。通过对青芋二号全生育期生物量的动态分析表明,叶是干物质分配过程中的源,地下部块茎是干物质分配过程中的库,但是在块茎萌发期又扮演了源的角色,茎在干物质分配过程中扮演了通道的功能。菊芋生育周期内干物质的积累和分配,对块茎产量的高低有很大影响,所以探索菊芋干物质分配规律对以后开发利用菊芋块茎有着重要的意义[14]。
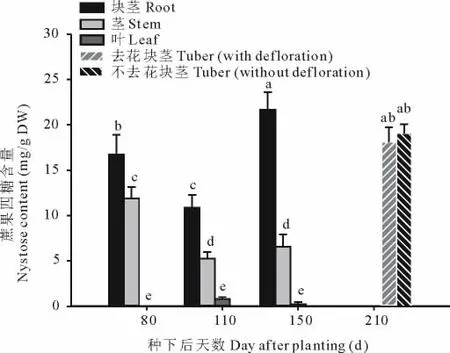
图8 青芋二号去花处理对块茎蔗果四糖含量的影响Fig.8 Effect of defloration on nystose content in Qingyu No.2 tubers

图9 青芋二号去花对块茎蔗果五糖含量的影响Fig.9 Effect of defloration on 1-kestose content in Qingyu No.2 tubers
去花的原理跟通常所说的打顶一样,打顶即去除植株的顶端优势,是为了让植物一些对我们没有多大利用价值的部位受到抑制减少它们对能量的吸收,进而为其他部位提供充足能量促进旺盛生长的技术措施[15]。打顶是烟草(Nicotiana tabacum)栽培过程中一项重要而又特殊的技术措施,它改变了烟株的生长中心和物质交换中心,使烟株原有的库源关系发生了很大变化,进而影响到烟草体内同化产物和矿质养分的分配[11]。对烟草进行打顶处理的研究发现,烟草打顶处理的叶重为不打顶的1.3倍左右,根系最终的重量近乎为不打顶的2倍,可见烟草打顶对促根及提高产量的作用十分明显[11]。由于菊芋主要依靠块茎无性繁殖,植物本生的种子发生退化,所以去花对于菊芋植株的繁殖无任何影响。本实验借鉴烟草的打顶技术,对青芋二号进行去花处理,在青芋二号植株出现花蕾的时候去除整株的花蕾一直到花期结束。通过对实验结果的分析发现去花处理对青芋二号块茎生物量有显著影响,去花处理后平均每株块茎为56.33个,与对照相比增加了39.67%;处理后平均每株块茎长度为5.90 cm,与对照相比增加了59.46%,块茎干重比对照的增加了22.53%。以上结果说明,通过此项技术,可以提高每株菊芋的单产,因此本实验可为农业生产实践使用去花技术提供理论依据。
3.2 青芋二号全生育期糖分积累与分配及去花处理对块茎糖分的影响
糖不仅是植物生命活动的基础物质,同时还具有其他的生理功能,如可作为信号分子与激素、氮等信号联成网络,通过复杂的信号转导机制调节植物生长发育与基因表达[16]。可溶性糖是植物光合产物的主要形式[17],同时也是植物重要的渗透调节物质[18],在植物体内的合成、运输和分配受植物生长发育的调控,在植物生长发育的不同时期,各营养器官中的可溶性糖含量会发生规律性的变化,同时也受到环境因素的影响[19]。菊芋在生长发育过程中,叶片是糖分合成的主要场所,通过叶片的光合作用产生最初的磷酸丙糖,进而转变为果糖、葡萄糖和蔗糖,在植物中主要以蔗糖的形式运输。蔗糖再通过3个酶合成不同聚合度的果聚糖,即:糖:蔗糖-1-果糖基转移酶(sucrose:sucrose1-fructosyl-transferase,1-SST)、果聚糖:果聚糖-1-果糖基转移酶(fructan:fructan1-fructosyltransferase,1-FFT)、蔗糖:果聚糖-6-果糖基转移酶(sucrose:fructan 6-fructosyltransferase,6-SFT),其中1-SST和 1-FFT 是菊糖型果聚糖合成的关键酶[20]。在块茎大规模出现以前,叶片中同时发现葡萄糖、果糖和蔗糖的积累,虽然在各个生长时期同茎和根组织相比,含量均比较少,分别只占到相同干重中茎含量的69.46%,25.51%,28.54%,根含量的70.68%,45.6%,24.35%。叶中的单糖(葡萄糖和果糖)等虽然较少,但在生长发育过程中葡萄糖和果糖的总和占还原糖的比例为65.24%(叶中的还原糖含量占总糖含量的42.22%),说明叶片中还原糖基本以这2个为主。如果加上蔗糖,叶片中果糖、葡萄糖和蔗糖的含量总和占可溶性总糖的比例较高,随着生长阶段的不同占可溶性总糖含量的比例在22.49% ~61.10%范围内变动,说明叶片中基本以单糖和二糖为主,这个结果同不同聚合度的果聚糖检测相吻合,在叶片中几乎很少检出蔗果三糖,四糖和五糖,而更高聚合度的果聚糖由于没有标准物,无法比较,但从图3可以发现,在叶片中更高聚合度的多糖比较少。茎作为糖分的临时贮藏器官,通过试验发现,虽各种糖在茎中都有分布,但主要是蔗糖、葡萄糖和果糖,其他多糖随着植株的继续生长含量逐渐下降。与叶和根组织相比,蔗糖、葡萄糖和果糖含量较多,分别是根的85.32%,105.3%和178.72%。但茎中还原糖和蔗糖的总和占可溶性糖的比例很低,为24.47%,从图3中可以发现其他高聚合度的多糖含量很少,说明其他的单糖成分占的比重比较大。茎在整个糖分的积累与分配中起着运输的作用,通过茎的运输糖分从地上部往地下部转运为块茎的生长发育提供充足的能源,糖分最后在块茎中积累合成果聚糖,糖分在茎中的积累与再分配对块茎的形成起着重要作用[9]。在块茎中主要是果聚糖和蔗糖,还原糖含量相对于多糖很低,检测发现,蔗果三糖、四糖和五糖含量在每克块茎中分别为13.92,19.06和20.08 mg。
本研究结果表明,可溶性糖在根和块茎中含量最多,其次是茎,最少的是叶(图1)。在叶中主要是还原糖,在根、茎中主要是非还原性糖(图1,图2)。去花处理对相同干重的块茎可溶性总糖含量有明显的影响,可能的原因是菊芋去花后影响了糖分含量在各组织间的分配与运输,原先提供开花所需的糖转入到块茎,使原先没有足够糖膨大成块茎的匍匐茎获得所需能量膨大成块茎,这使得块茎的数量增多和块茎的总干重变大。还原糖在去花处理后稍有增加,但增加不多,可能原因是低分子量的糖主要转移到了根和块茎中。由于块茎中果聚糖主要由蔗糖等聚合形成,通过HPLC-ELSD检测青芋二号根、茎、叶中的果糖、葡萄糖、蔗糖、蔗果三糖、蔗果四糖、蔗果五糖,发现葡萄糖、蔗糖等单糖二糖主要分布在茎和叶中,而高聚合度的蔗果三糖、蔗果四糖和蔗果五糖主要集中分布在块茎和茎中。对青芋二号进行去花处理提高了蔗果五糖的含量,更高聚合度的多糖由于没有标准品无法鉴别,但根据图3d和图3e,去花处理后块茎的高聚合度果聚糖的峰面积均比对照有所增加,说明去花处理可能增加了高聚合度果聚糖的含量。由上面的实验结果,我们推测在菊芋中糖的分配转运机制:首先叶片的光合作用积累小分子的糖类,然后通过茎转运进入茎和根中,在根和块茎中合成高聚合度的果聚糖进而导致块茎形成和膨大。这表明去花处理不但可以增加块茎大小和数量,还可改变菊糖成分,对于以后菊芋块茎的利用开发提供了重要的理论依据。
[1]赵琳静,燕方龙,宋小平.菊芋菊糖的研究进展[J].食品研究与开发,2008,29(4):186-189.
[2]赵琳静,李洪森,陈婷婷,等.菊芋菊糖含量的测定[J].化工生产与技术,2010,17(4):43-45.
[3]周正,曹海龙,朱豫,等.菊芋替代玉米发酵生产乙醇的初步研究[J].西北农业学报,2008,17(4):297-301,305.
[4]胡娟,金征宇.菊糖在植脂掼奶油中对流变品质的影响[J].食品与生物技术学报,2008,27(2):64-70.
[5]刘颖慧,贾海坤,高琼.植物同化物分配及其模型研究综述[J].生态学报,2006,26(6):1981-1992.
[6]Kage H,Kochler M,Stutzel H.Root growth and dry matter partitioning of cauliflower under drought stress conditions:measurement and simulation[J].European Journal of Agronomy,2004,20(4):379-394.
[7]Davidson A,Keller F,Turgeon R.Phloem loading,plant growth form,and climate[J].Protoplasma,2011,248(1SI):153-163.
[8]Schubert S,Feuerle R.Fructan storage in tubers of Jerusalem artichoke:Characterization of sink strength[J].Newphytologist,1997,136(1):115-122.
[9]Denoroy P.The crop physiology of Helianthus tuberosus L:A model orientated view[J].Biomass& Bioenergy,1996,11(1):11-32.
[10]李彦玲,党承林.多花菜豆和蚕豆花的冗余与适应[J].生态学杂志,2003,22(6):33-37.
[11]郭丽琢,张福锁,李春俭.打顶对烟草生长、钾素吸收及其分配的影响[J].应用生态学报,2002,13(7):819-822.
[12]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[13]Wang G Y,Michailides T J,Bostock R M.Improved detection of polygalacturonase activity due to Mucor piriformis with a modified dinitrosalicylic acid reagent[J].Phytopathology,1997,87(2):161-163.
[14]钟启文,王怡,王丽慧,等.菊芋生长发育动态及光合性能指标变化研究[J].西北植物学报,2007,27(9):1843-1848.
[15]孟祥才,孙晖,杨舸,等.打顶对北柴胡产量和质量的影响[J].中药材,2008,31(3):336-337.
[16]张晓艳,刘锋,王风云,等.墨西哥玉米留茬中糖组分含量对氮素的响应[J].草业学报,2009,18(1):184-187.
[17]刘爱荣,张远兵,谭志静,等.模拟干旱对佛甲草生长和渗透调节物质积累的影响[J].草业学报,2012,21(3):156-162.
[18]王磊,隆小华,郝连香,等.氮素形态对盐胁迫下菊芋幼苗PSⅡ光化学效率及抗氧化特性的影响[J].草业学报,2012,21(1):133-140.
[19]潘庆民,韩兴国,白永飞,等.植物非结构性贮藏碳水化合物的生理生态学研究进展[J].植物学通报,2002,19(1):30-38.
[20]张小芸,何近刚,孙学舞,等.转果聚糖合成关键酶基因多年生黑麦草的获得及抗旱性的提高[J].草业学报,2011,20(1):111-118.

