宁夏中部干旱带主要植物叶性状变异特征研究
陈林,杨新国,宋乃平,杨明秀,肖绪培,王兴
(宁夏大学西北退化生态系统恢复与重建教育部重点实验室西北土地退化与生态恢复省部共建国家重点实验室培育基地西部生态与生物资源开发联合研究中心,宁夏银川750021)
长期以来,人们习惯采用气体交换测定指标去理解植物生长过程(忽略了一些植物性状指标的重要性)[1],但是这种瞬间变化的测定指标(如光合/呼吸速率)是难以深入解释植物生长的长期适应机理[2]。叶片是植物与外界环境进行物质与能量交换的主要器官,直接影响到植物的基本行为和功能,且随着气候、土壤和环境因子的变化而变化[3],叶性状在特定的环境背景下保持稳定,反映了不同物种在长期进化过程中对其生存环境的适应和竞争能力,还可以反映植物适应环境变化所形成的生存对策[4],因而具有重要的生态学和生物进化意义[5],对植物叶性状的研究能更好地阐明叶片生理生态对环境变化的响应机理[6]。目前,植物叶性状的变化与环境的关系成为植物生态学的研究热点之一[7],应用叶性状研究植物对环境的适应机理更是生理生态学领域近些年研究中新的突破点[3]。
宁夏中部干旱带降水量稀少,气候恶劣,植被稀疏,由于风沙危害和超载过牧等自然和人为因素的共同作用,宁夏荒漠草原土壤沙化、植被退化严重[6],总体表现为生物多样性降低、草地生产力下降、荒漠化不断扩大和风沙危害日益加剧。近年来实施的“退耕还林(草)”和“封山禁牧”等政策虽然取得了一定成效,但植被建设中仍存在成活率低、保存率低等问题,其中一个重要原因就是对该区植物适应环境的机理研究还不够深入,这无疑使当前生态环境保护和建设陷入盲目。因此,认清干旱地区,特别是北方农牧交错干旱地区植物的基本性状,不但可以反映植物适应环境变化所形成的生存对策,而且可以深入解释植物对环境的适应机理,对该地区植被重建与恢复具有重要的理论和实践意义。此外,目前针对该地区不同植物叶性状的研究并不多见。基于此,本研究以宁夏中部干旱带的典型区域中在相同生境条件下的人工引入种及野生物种植物为研究对象,从植物叶性状入手,研究不同种植物叶性状间的差异,分析叶性状之间的关系,以及不同科类群、功能类群植物叶性状间的差异,试图从植物叶片生理生态的角度揭示该地区植物对环境的适应性,为人工调控促进植被演替、退化生态系统的植被恢复、人工建置草地、选择合适的植物种进行荒漠化防治等提供理论依据,并为进一步研究该地区的生物多样性和生境的稳定性保育提供基础资料。
1 材料与方法
1.1 研究区自然概况
宁夏盐池县皖记沟行政村(杨寨子自然村和北王圈自然村),处于宁夏中部干旱带上,位于盐池县城东北约3 km,地貌为鄂尔多斯缓坡起伏高原。气候特点为干旱少雨,蒸发量大,冬春两季风大沙多,属典型的中温带大陆性气候。1954-2010年年平均气温为8.46℃,年降水量为276.3 mm,年日照时数为2862.6 h。地表植被属荒漠草原,沙生特征明显。土壤以有机质含量低、易沙化的淡灰钙土和风沙土为主。地表水与地下水资源匮乏。20世纪60年代以来,由于人类活动加剧,土地沙化面积仍不断扩大[8]。
1.2 研究方法
1.2.1 实验材料的选择 选取夏季生长的35种植物(表1)作为研究对象,于植被生长盛期(2012年8月份)一次降雨后的第3~5天,选取完全展开、保持完整且生长良好的成熟叶片(或其着生小枝)作为实验材料。
1.2.2 植物叶性状测定方法 考虑到水对植物叶片大小有明显的影响[9],在计算过程中会影响到结果的准确性,因此,植物叶片吸水实验参照Limm等[10]的方法,改进后进行操作。将植物叶片(或其着生小枝)剪下,迅速在切口沾涂凝固胶后装入塑封袋,放入智能移动保温冰箱(52L/AMC017A),然后带回实验室,立即用扫描仪(清华同方A868)扫描成图片,应用Photoshop计算吸水面积,记为S。吸水实验的具体步骤是:将扫描叶面积后的材料称重,记为m1,在黑暗中完全浸没于去离子水中直至饱和,取出后用干洁的白布将附着在表面的水分吸取后称重,记为m2,在空气中放置干燥失水10 min后称重,记为m3,然后再次浸入去离子水中1 s取出,用干洁的白布将附着在表面的水分吸取后称重,记为m4,然后将材料放入硬质信封中,105℃杀青30 min,65℃烘干至恒重,记为m5。每一物种重复5~9次。
叶片单位面积吸水量(leaf water uptake content,LWUC,mg/cm2)的计算公式为:
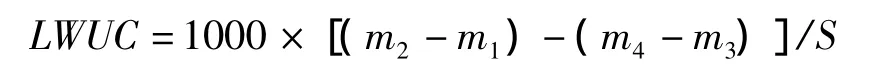
叶片含水量增加率(percentage increase in leaf water content,RW,%)的计算公式为:
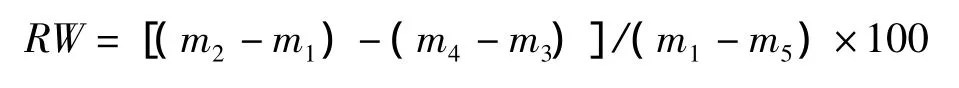
叶片水分饱和亏(leaf water saturation deficit,WSD,%)的计算公式为:
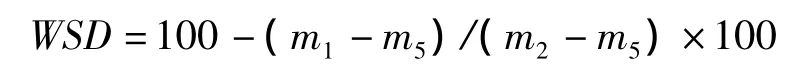
比叶面积(specific leaf area,SLA,cm2/mg)的计算公式为:
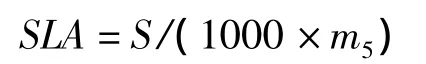
叶片干物质含量(leaf dry material content,LDMC,%)的计算公式为:
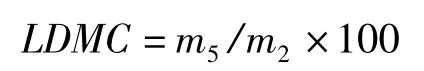
叶片肉质化程度(leaf succulence,Suc,g/cm2)的计算公式为:

叶组织密度(leaf density,LD,g/cm3)的计算公式为:
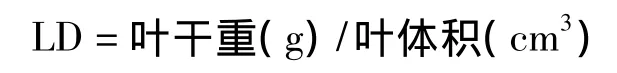
式中,叶体积=叶面积×叶厚度。
叶片厚度(leaf thickness,LT,mm)测定方法为:考虑到野外采样的可操作性,本研究中随机取不同叶位9个叶片,用游标卡尺(精度为0.01 mm)测量新鲜叶片的厚度后取平均值。
用便携式叶绿素仪(USA,SPAD 502DL Plus)对可进行测量植物种的叶片叶绿素含量(chlorophyll content,ChlC,%)进行测定,每一物种重复9次。

表1 植物名录及功能群分类Table 1 List of the species and their ownership to life forms and functional groups
1.3 数据分析
箱式图用于多组数据平均水平和变异程度的直观分析比较,包括最小值、最大值、中位数、两个四分位数(上四分位数和下四分位数)以及异常值(实心黑圆点)和极端值(*),故本研究采用箱式图表现不同科类群、功能类群间的差异;采用SPSS 17.0软件进行单因素方差分析(one-way AVOVA),LSD法检验处理组间的差异显著性。
2 结果与分析
2.1 植物叶性状的变异特征
表2为研究地植物 LT、Suc、LD、SLA、LDMC、WSD、ChlC、LWUC、RW 的平均值、最值、中值以及变异特征值。按照变异系数,将9种叶性状划分为3类:高变异系数(≥70%)、中变异系数(40% ~70%)和低变异系数(≤40%)。35种植物LT和LWUC的平均值分别为0.3605 mm和6.9626 mg/cm2,变异系数高达83.90%和81.10%,其中禾本科的画眉草LT最小(0.1340 mm),菊科的菊芋LT最大(1.8340 mm),而蔷薇科的二裂委陵菜LWUC最小(1.3134 mg/cm2),蒺藜科的白刺LWUC最大(22.2356 mg/cm2)。中变异系数的RW的平均值为34.8357%,变异系数为57.73%,其中豆科的中间锦鸡儿最小(8.9829%),豆科的砂珍棘豆最大(104.9063%);LD的平均值为0.2730 g/cm3,变异系数为48.49%,其中菊科的菊芋最小(0.0393 g/cm3),豆科的草木樨状黄耆最大(0.5999 g/cm3);Suc的平均值为0.0362 g/cm2,变异系数为47.07%,其中禾本科的画眉草Suc最小(0.0169 g/cm2),蒺藜科的骆驼蓬最大(0.0996 g/cm2);SLA的平均值为0.1582 cm2/mg,变异系数为43.06%,其中禾本科的针茅最小(0.0483 cm2/mg),禾本科的虎尾草最大(0.2963 cm2/mg)。低变异系数中,可测量植物27种ChlC的变化范围在9.8000%(禾本科的狗尾草)至53.7700%(蔷薇科的苹果树)之间,平均值为33.8134%,变异系数为39.84%;LDMC的变化范围在11.2999%(豆科的苦参)至40.7958%(蔷薇科的杜梨)之间,平均值为22.5503%,变异系数为34.28%;WSD的变化范围在14.7490%(禾本科的中亚百草)至57.0748%(豆科的砂珍棘豆)之间,平均值为37.1261%,变异系数为27.61%。
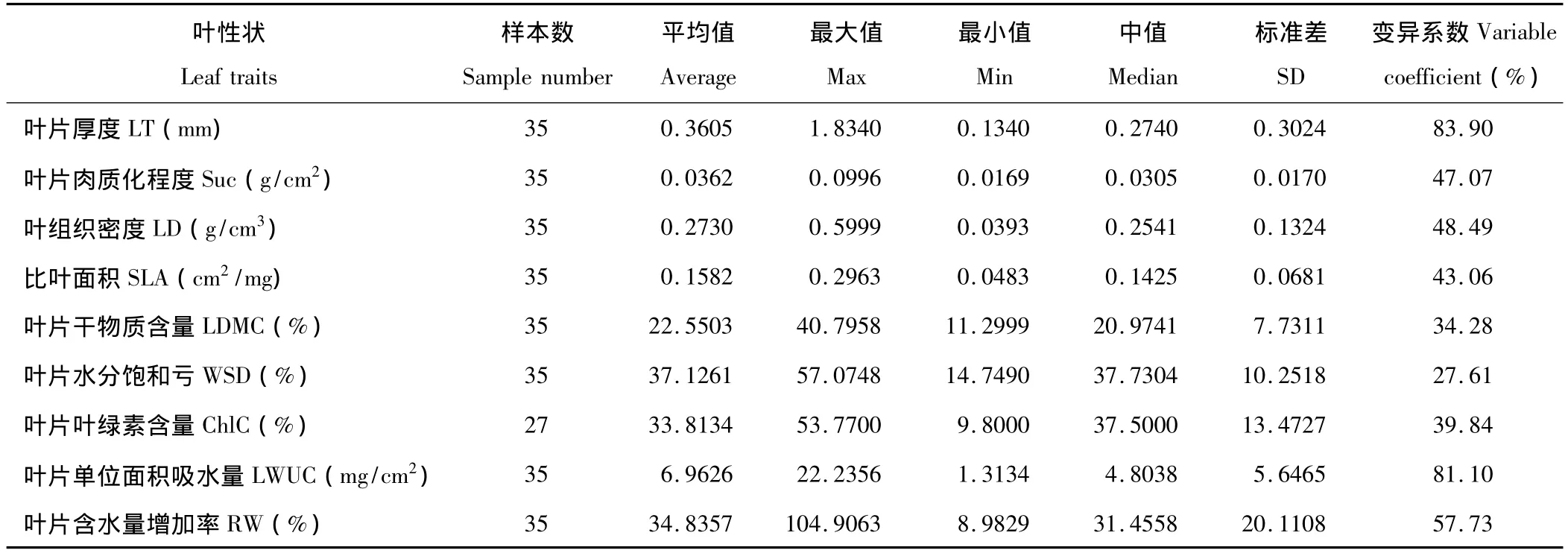
表2 研究地植物叶性状的变异特征Table 2 Parameters of leaf traits in study area
2.2 叶性状的相关性分析
表3为植物各叶性状之间的相关系数及显著水平。可以看出,LT与LD(r=-0.516,P<0.01)呈极显著的负相关关系,与 Suc呈显著的正相关关系(r=0.420,P <0.05);Suc与 SLA(r= -0.563,P <0.01)呈极显著正相关关系,与 LWUC(r=0.675,P <0.01)呈极显著正相关关系;LD 与 SLA(r= -0.337,P <0.05)呈显著负相关关系,与ChlC和LDMC呈正相关关系,并分别达到了显著水平(r=0.401,P<0.05)和极显著水平(r=0.542,P<0.01);SLA 与 LDMC(r= -0.468,P <0.01)和 ChlC(r= -0.676,P <0.01)呈极显著的负相关关系,与 LWUC 存在显著的负相关关系(r= -0.350,P <0.05);LDMC 与 WSD(r= -0.174,P >0.05)、LWUC(r= -0.328,P >0.05)、RW(r= -0.123,P >0.05)呈负相关,但相关性均不显著(P >0.05),与 ChlC 呈显著正相关(r=0.428,P <0.05);WSD 与 LWUC(r=0.395,P <0.05)和 RW(r=0.572,P <0.01)呈极显著的正相关关系;LWUC 与 RW 呈极显著的正相关关系(r=0.706,P <0.01),与 ChlC 呈正相关关系,但相关性不显著(r=0.280,P >0.05);RW 与ChlC 正相关关系不显著(r=0.164,P >0.05)。
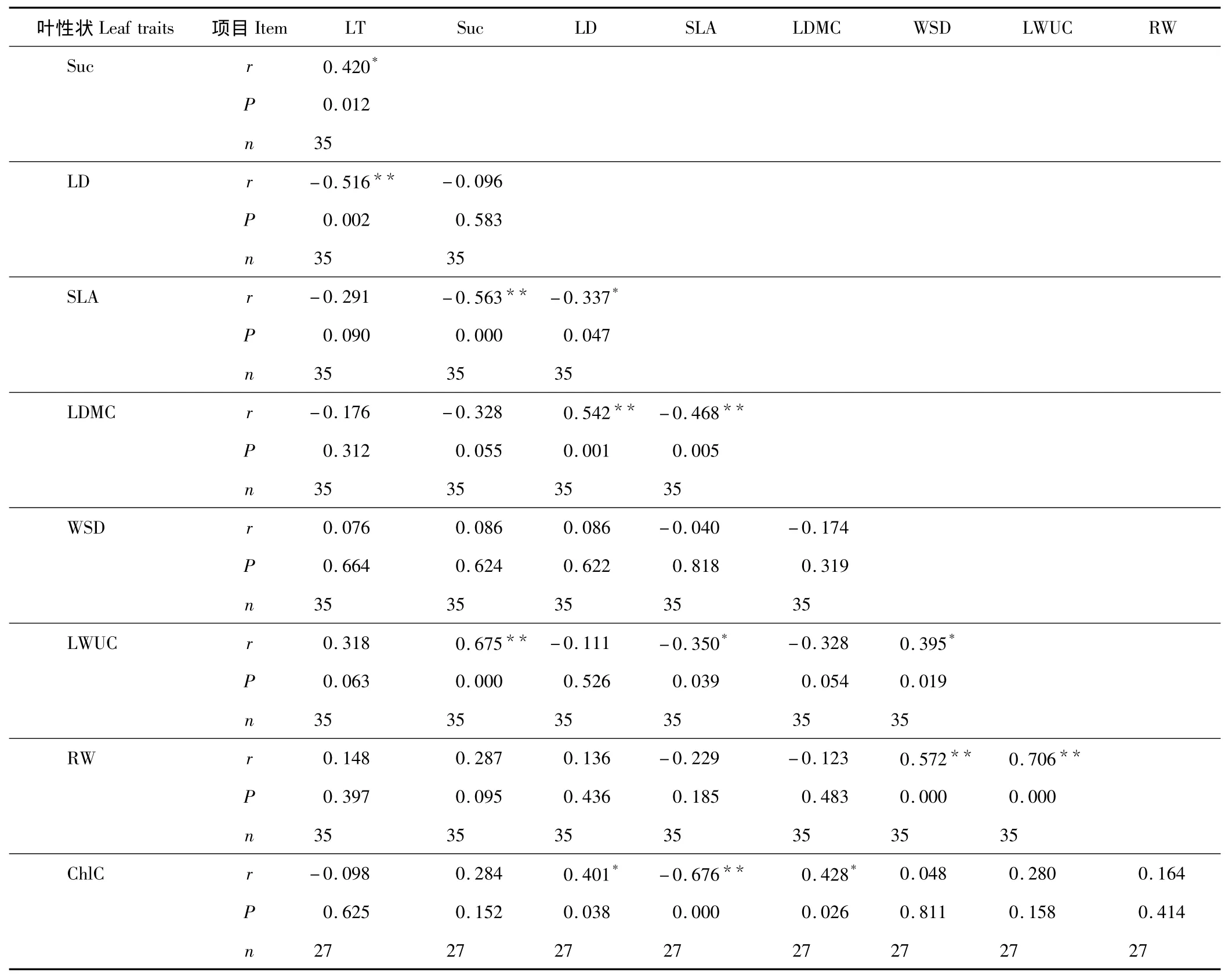
表3 植物叶性状的相关分析Table 3 Correlation coefficient between six leaf water uptake strategy of 35 plants
2.3 不同科类群植物叶性状比较
方差分析结果表明(图1),植物叶性状LD、LT、Suc、LDMC和LWUC在不同科类群之间存在极显著差异(P<0.01),但SLA、WSD、ChlC和RW之间则差异不显著(P>0.05)。蔷薇科植物叶片的LD最高,极显著大于豆科、禾本科、蒺藜科和菊科植物叶片的LD(P<0.01),菊科植物的LD极显著的小于豆科和禾本科(P<0.01),蒺藜科、豆科和禾本科植物叶片的LD之间则无显著差异(P>0.05)。菊科植物叶片的LT极显著的大于豆科、禾本科、蒺藜科和蔷薇科植物叶片的LT(P<0.01),而豆科、禾本科、蒺藜科和蔷薇科植物叶片的LT之间则无显著差异(P>0.05)。蒺藜科植物叶片的Suc极显著高于豆科、禾本科和蔷薇科植物叶片的Suc(P<0.01),与菊科植物叶片的Suc无显著差异(P>0.05),而菊科植物叶片的Suc极显著高于禾本科植物叶片的Suc(P<0.01),与豆科、蔷薇科植物叶片的Suc无显著差异(P>0.05)。蔷薇科植物叶片的LDMC极显著的大于豆科、蒺藜科和菊科植物叶片的LDMC(P<0.01),与禾本科植物无显著差异(P>0.05),而禾本科植物叶片的LDMC极显著的大于蒺藜科和菊科植物叶片的LDMC(P<0.01),与豆科植物叶片的LDMC无显著差异(P>0.05),豆科、蒺藜科和菊科植物叶片的LDMC之间则无显著差异(P>0.05)。蒺藜科植物叶片的LWUC极显著的大于豆科、禾本科和蔷薇科植物叶片的LWUC(P<0.01),与菊科植物叶片的LWUC无显著差异(P>0.05),而豆科、禾本科和蔷薇科植物叶片的LWUC也无显著差异(P>0.05)。
2.4 不同功能类群植物叶性状比较
图2是对一年生和多年生植物叶性状的比较。经方差分析结果表明,一年生植物LD、ChlC和LDMC的平均值极显著低于多年生植物LD、ChlC和LDMC的平均值(P<0.01),而SLA则极显著的高于多年生植物(P<0.01)。但一年生和多年生植物LT、Suc、WSD、LWUC和RW的平均值之间无显著差异(P>0.05)。
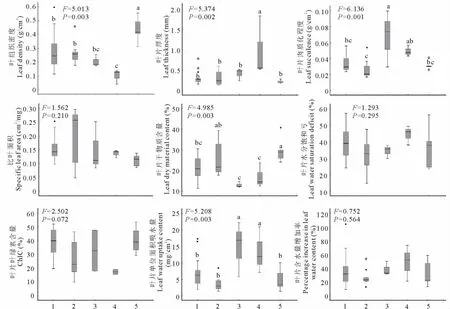
图1 不同科类群植物叶性状比较Fig.1 Comparison of leaf traits among different family groups
3 结论与讨论
有学者提出了基于植物性状的植物群落构建理论:对特定的生境,构成群落的物种虽存在个体差异,但与其他群落物种相比,群落内物种间具有相似的性状特征,即性状趋同[11]。但随着对植物功能性状与植物群落形成及生态系统功能关系研究的深入,有研究表明,即使在相似生境中,叶片的一些特征仍存在种间差异[12],本研究的结果也证实了这一点(表2),部分叶性状(LT、LWUC、RW、LD、Suc、SLA)存在着较大的差异(具有中、高变异系数)。此外,本研究中所测植物的各叶片形状指标的平均值与其他地区研究结果[13]相比有所差异,造成这种现象的原因可能是不同生境植物长期适应生态环境的结果以及与其本身固有的遗传特性有关[14],也可能与所选物种的不同以及测定季节的差异有关。SLA和LDMC是植物叶片的两个关键性状,能够较好地反映植物生长策略及植物利用资源的能力、生物量大小和生态系统功能,在退化荒漠草原地区植物SLA能更好地指示植物对资源的利用[6],本研究中植物叶片SLA和LDMC的平均值均相对偏小,这与本研究区气候干旱、土壤贫瘠的环境条件有关,反映了该地区植物对有限资源的利用能力、适应性,能很好地适应贫瘠的环境。
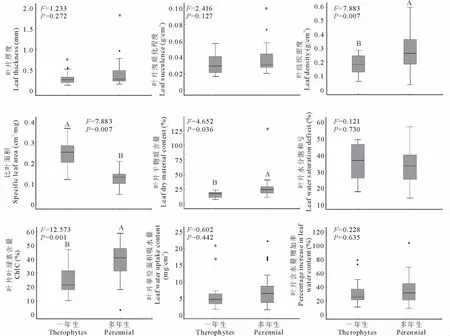
图2 不同功能类群植物叶性状比较Fig.2 Comparison of leaf traits between annual and perennials
关于植物叶性状之间关系的研究已经有许多报道。叶性状并不是孤立发挥作用的,植物在长期适应环境过程中,通过内部不同功能之间的调整,最终形成一系列适应某种环境的功能性状的组合[15],它们之间是彼此联系的。有学者对全球175个样点2548种植物[3]以及中国草地174个样点171种植物[16]的叶性状分析后,研究结果证实了叶性状之间普遍存在着密切的关系。这是由于植物生长过程中,由于受到物理、生理等的综合作用,不同的性状之间表现出一定的相关性,从而反映出植物对环境的趋同适应特征。但是由于植物的叶性状受环境的影响很大,因此,不同研究区域植物叶性状之间的关系存在一定的差异,基于宁夏中部干旱带35种植物叶性状的测定和分析结果,与郑新军等[17]在准噶尔盆地的研究结果不尽相同,也证明了这一点。这些差异通常被解释为植物遗传特性[18]或适应环境的结果[19]。几乎所有的实验研究结果都表明,植物的SLA和LDMC之间呈负相关关系,随着LDMC的增加,植物叶片含水率降低,LD增加,从而导致SLA降低[20-21]。但是由于植物叶性状对环境因子的应对措施不完全一致,不同植物SLA和LDMC在物种水平上的相关性也不尽相同[22]。李玉霖等[23]研究认为,流动沙丘、半固定沙丘植物的SLA和LDMC之间相关性均不显著,但流动沙丘、半固定沙丘和固定沙丘的所有植物SLA和LDMC之间却有显著负相关关系。
一年生草本植物在冬天全部死亡,所以冬天的维持消耗为0;多年生草本植物在冬天仅地下部分能存活,其维持消耗显然大于一年生草本植物。由于一年生植物和多年生植物在获取资源的能力以及维持生态系统稳定性方面具有不同的生态功能,而植物的叶片性状是植物行为和功能的具体体现[19]。研究发现,一年生植物和多年生植物的叶性状存在较大差异。宁夏中部干旱带一年生植物的SLA极显著大于多年生植物的SLA(P<0.01),而LMDC则显著小于多年生植物(P<0.05),这也验证了SLA和LMDC之间的显著负相关关系是很多陆地生态系统类型的普遍特征[24]。因此可以用来推断彼此,如一年生植物的SLA显著偏低,则可以推断一年生植物的LMDC会显著偏大。
目前,关于不同科类群间植物叶性状的系统报道尚不多见。本研究发现,植物叶性状LD、LT、Suc、LDMC和LWUC在不同科类群之间存在极显著差异(P<0.01),而SLA、WSD、ChlC和RW之间则差异不显著(P>0.05)。因此可以将LD、LT、Suc、LDMC和LWUC用作不同科类群植物间相比较的研究因子,进而对相关研究提供方便。
最后,有学者提出了一个“全球统一的叶性状间的比例关系”[25]的假说,然而,目前国内外对叶性状间的关系在不同空间尺度上的比较研究相对还很少[26],针对不同尺度叶性状间关系是否有差异,差异的因素是由什么导致的以及叶性状间关系的相关性是否会随空间尺度的变化而呈现有规律的变化,都尚未定论。因此,系统开展不同尺度的比较研究是今后研究发展的方向。
[1]李永华,罗天祥,卢琦,等.青海省沙珠玉治沙站17种主要植物叶性因子的比较[J].生态学报,2005,25(5):994-999.
[2]Krne C H.Some often overlooked plant characteristics as determinants of plant growth:a reconsideration[J].Functional Ecology,1991,5:162-173.
[3]Wright I J,Rrich P B,Westoby M,et al.The worldwide leaf economics spectrum[J].Nature,2004,428:821-827.
[4]宝乐,刘艳红.东灵山地区不同森林群落叶功能性状比较[J].生态学报,2009,29(7):3692-3703.
[5]张林,罗天祥.植物叶寿命及其相关叶性状的生态学研究进展[J].植物生态学报,2004,28(6):844-852.
[6]安慧.放牧干扰对荒漠草原植物叶性状及其相互关系的影响[J].应用生态学报,2012,23(11):2991-2996.
[7]刘旻霞,马建祖.甘南高寒草甸植物功能性状和土壤因子对坡向的响应[J].应用生态学报,2012,23(12):3295-3300.
[8]宋乃平,杨新国,何秀珍,等.荒漠草原人工柠条林重建的土壤养分效应[J].水土保持通报,2012,32(4):21-26.
[9]李永华.白刺叶片性状对人工增水的响应[D].北京:中国林业科学研究院,2010.
[10]Limm E B,Simonin K A,Bothman A G,et al.Foliar water uptake:a common water acquisition strategy for plants of the redwood forest[J].Oecologia,2009,161(1):449-459.
[11]Grime J P.Trait convergence and trait divergence in herbaceous plant communities:Mechanisms and consequences[J].Journal of Vegetation Science,2006,17:255-260.
[12]牛书丽,蒋高明,高雷明,等.内蒙古浑善达克沙地97种植物的光合生理特征[J].植物生态学报,2003,27(3):318-324.
[13]Shipley B,Almeida-Cortez J.Interspecific consistency and intraspecific variability of specific leaf area with respect to irradiance and nutrient availability[J].Ecoscience,2003,10(1):74-79.
[14]白文娟,郑粉莉,董莉丽,等.黄土高原水蚀风蚀交错带不同生境植物的叶性状[J].生态学报,2010,30(10):2529-2540.
[15]施宇,温仲明,龚时慧.黄土丘陵区植物叶片与细根功能性状关系及其变化[J].生态学报,2011,31(22):6805-6814.
[16]He J S,Wang X P,Flynn D F B,et al.Taxonomic,phylogenetic and environmental trade-offs between leaf productivity and persistence[J].Ecology,2009,90(10):2779-2791.
[17]郑新军,李嵩,李彦.准噶尔盆地荒漠植物的叶片水分吸收策略[J].植物生态学报,2011,35(9):893-905.
[18]李冰,刘左军,赵志刚,等.海拔对钝裂银莲花不同花色居群间繁殖特征及繁殖分配的影响[J].草业学报,2013,22(1):10-19.
[19]赵红洋,李玉霖,王新源,等.科尔沁沙地52种植物叶片性状变异特征研究[J].中国沙漠,2010,30(6):1292-1298.
[20]张林,罗天祥,邓坤枚,等.云南松比叶面积和叶干物质含量随冠层高度的垂直变化规律[J].北京林业大学学报,2008,30(1):40-44.
[21]张灵菲,魏斌,葛庆征,等.高寒草甸恢复演替过程中生产力与植物功能特征关系的研究[J].草业学报,2012,21(6):235-241.
[22]闫建成,梁存柱,付晓玥,等.草原与荒漠一年生植物性状对降水变化的响应[J].草业学报,2013,22(1):68-76.
[23]李玉霖,崔建垣,苏永中.不同沙丘生境主要植物比叶面积和叶干物质含量的比较[J].生态学报,2005,25(2):304-311.
[24]Shipley B.Trade-offs between net assimilation rate and specific leaf area in determining relative growth rate:relationship with daily irradiance[J].Functional Ecology,2002,16(5):682-689.
[25]Reich P B,Oleksyn J,Wright I J,et al.Evidence of a general 2/3-power law of scaling leaf nitrogen to phosphorus among major plant groups and biomes[J].Proceedings the Royal of Society(Biological sciences),2010,277:877-883.
[26]刘超,武娴,王襄平,等.内蒙古灌木叶性状关系及不同尺度的比较[J].北京林业大学学报,2012,34(6):23-29.

