双单倍体牙鲆的性腺发生、性别分化及早期发育的研究
王桂兴,朱以美,侯吉伦,张晓彦,王玉芬,孙朝徽,姜秀凤,刘海金
(1.中国水产科学研究院北戴河中心实验站,河北秦皇岛066100;2.东北农业大学动物科学技术学院,哈尔滨150030;3.中国水产科学研究院,北京100141)
1 前言
牙鲆(Paralichthys olivaceus)肉质细嫩、味道鲜美,同时它还具有生长快、繁殖能力强、洄游性小和回归性强的特点,是中国、日本、韩国等国家重要的海水增养殖鱼类[1]。牙鲆雌雄个体差异较大,雌鱼的生长速度明显快于雄鱼。人工养殖条件下这种差异更加显著。在生产中,养殖全雌牙鲆比养殖普通牙鲆能大幅度提高养殖产量,从而获得更大的经济效益。因此,人工诱导雌核发育,实现牙鲆养殖全雌化,对提高养殖产量和经济效益具有非常重要的意义[2]。根据不同的处理原理,雌核发育可分为减数分裂雌核发育和有丝分裂雌核发育。有丝分裂雌核发育能够产生双单倍体,再次诱导雌核发育,即可获得克隆牙鲆。
从20世纪60年代以来,我国学者对鱼类性腺发育的研究有许多报道,多数集中在性腺发育的分期和季节变化规律方面,直到现在许多学者还在致力于此方面的研究。但是,对鱼类性别分化的研究较少,且大多集中在淡水鱼类,而对海水鱼类的研究则更少[3,4]。关于双单倍体牙鲆的性腺发生、分化及发育的研究,至今未见报道。
本文对双单倍体牙鲆的性腺发生、性别分化及早期发育过程进行组织切片观察,对其性比及性腺组织学特征进行了描述和分析,旨在为研究双单倍体牙鲆的繁殖生物学提供组织学上的依据。
2 材料与方法
2.1 实验材料
本实验的亲鱼取自中国水产科学研究院北戴河中心实验站,是2007年生产的普通牙鲆,5龄,体质量为4.17 kg,全长70 cm。利用亲鱼的同一批卵子,诱导有丝分裂雌核发育、减数分裂雌核发育和对照组。有丝分裂雌核发育,用紫外线灭活的真鲷精液激活卵子,静置3 m in后加入17℃海水培育60min,然后转移至静水压机(5406R,大岳公司,日本)中,施压650MPa,持续6m in,完成雌核发育诱导后,移至常温海水中孵化。减数分裂雌核发育,用紫外线灭活的真鲷精液激活卵子,静置3m in后转入0℃海水中培育30m in,然后移至常温海水中孵化。对照组为精卵通过干法受精方式获得。受精卵分别培育在0.5m3的孵化缸中,开始培育水温16℃。30天后转入3m3的大孵化缸中培育,采用常规方法进行培育,投喂饵料依次是轮虫、卤虫和配合饵料。
2.2 性别分化样品的采集
初孵仔鱼自孵出后第10天开始取样,10~80天,每5天随机取样5尾;80~110天,每10天随机取样5尾。对照组和实验组分别取样,每组分别取样90尾。对所取样品进行称重和照相。分别取头尾放于波恩试液中固定12 h,之后存放在浓度为70%的酒精中。
2.3 性腺发育样品的采集
性别分化110天后,每月随机取样5~10尾,至18月龄结束。由于有丝分裂雌核发育牙鲆特别珍贵,所以笔者在保证实验顺利进行并能充分说明所要研究问题的同时取样较少。对所取样品进行称重和照相。取性腺的前、中、后部放于波恩试液中固定24 h,之后存放在浓度为70%的酒精中。
2.4 组织切片
将固定好的样品用70%的酒精冲洗,然后梯度酒精脱水,二甲苯透明,石蜡(熔点为56~58℃)包埋,连续切片,厚度为5μm。采用苏木素-伊红(H.E)染色,中性树胶封片。组织切片用Leica光学显微镜观察并显微摄影。
2.5 组织切片观察方法
本文将牙鲆性腺分化的组织学特征卵巢腔的形成作为雌性性别分化开始的依据,没有观察到其他研究者看到的输精管原基,把没有卵巢腔形成的认为是精巢。以Ⅰ时相卵母细胞的出现作为卵巢分化完成的标志;而以精巢中初级精母细胞的出现作为精巢分化完成的标志。观察有丝分裂雌核发育牙鲆的性腺分化与普通牙鲆的性腺分化的不同,包括性别分化开始时间、性别分化完成时间、卵原细胞的数目和精原细胞的数目等。
本文以施瑔芳等[5]提出的划分标准和刘筠[6]提出的划分标准为基础,结合张耀光等[7]的观点,并依据牙鲆卵母细胞及精母细胞自身发育的特点,划分牙鲆卵母细胞时相及精巢的分期。卵巢发育分期依卵巢切面中所占面积超过50%或比例最高的卵母细胞的时相进行划分。比较有丝分裂雌核发育与普通牙鲆性腺发育的不同,包括各个时期卵母细胞的形态特点、细胞质的不同、细胞核的不同及数目,以及精巢中各个时期精小叶、精小囊的形态特点、精原细胞的数目以及初级和次级精母细胞的数目等。
3 结果与分析
3.1 双单倍体牙鲆原始性腺的发生
普通牙鲆15~35日龄的仔鱼,全长8.3~17.9mm,腹腔后端向腹腔内形成突起并逐渐延伸,形成生殖嵴;随着日龄增大,全长增加,生殖嵴内原始生殖细胞(PGCs)数目增加,35日龄时增加到5~6个,位于中肾管附近,与生殖嵴共同构成性腺原基;原始生殖细胞体积大,要比正常的体细胞大很多,细胞核被染成紫色,核染色较深,胞质着色较浅,细胞界限明显。35~45日龄,仔鱼全长17.9~27.4mm,性腺长度前期增加,后期变化不大,但是明显变宽,原始生殖细胞数量增加,排列变得稍微紧密,细胞直径变大;45日龄时,性腺内出现微血管。此时仍不能分清精巢或卵巢,随后,性腺进入分化阶段。减数分裂雌核发育牙鲆原始性腺的发生和普通牙鲆基本相同。
双单倍体牙鲆30~40日龄的仔鱼,全长10~21mm,原始生殖细胞由1个增加到4个。分布在生殖嵴内,两者共同构成性腺原基,性腺呈长条状,向腹腔内延伸。40~55日龄,仔鱼完成变态,全长21~38mm,性腺继续延伸变宽,原始生殖细胞数量增加,在性腺内部排列逐渐紧密,原始生殖细胞逐渐增大;55日龄时,性腺内出现微血管,但仍不能辨别雌雄(见图1)。

图1 30~55日龄双单倍体牙鲆的原始性腺Fig.1 Primordial gonad of 30~55 day sold doubled haploid Paralichthy solivaceus
3.2 双单倍体牙鲆的性别分化
3.2.1 卵巢的分化
普通牙鲆50日龄,全长41.2mm,性腺有像卵巢发育的迹象,中间出现卵巢腔,一端向另一端延伸,最后两端逐渐靠近,闭合后中间形成腔隙;背侧基部有微血管。60日龄,全长50mm,卵原细胞增多,排列在性腺的边缘,血管增多。70日龄,全长86.8 mm,性腺一端逐渐卷曲延伸,形成产卵板,卵原细胞沿着产卵板紧密排列。80日龄,全长92.5 mm,卵原细胞继续增多,细胞体积逐渐变大,形成向卵母细胞过渡的细胞,继续卷曲延伸形成产卵板,卵巢腔未闭合。90日龄,全长114mm,个别开始出现Ⅰ时相卵母细胞,细胞体积变大,含有2~3个核仁,分布于核周边,细胞质嗜碱性增强,沿卵母细胞边缘均匀分布。100日龄,全长135.7 mm,大部分卵巢都出现Ⅰ时相卵母细胞,同时细胞数目增多,至此,卵巢分化完成,属于Ⅰ卵巢。卵巢腔形成是卵巢分化的标志,Ⅰ时相卵母细胞的出现是卵巢分化完成的标志。减数分裂雌核发育牙鲆卵巢的分化和普通牙鲆基本相同。
双单倍体牙鲆60日龄,全长47mm,性腺开始向卵巢发育,一端向另一端卷曲延伸,中间形成腔隙,慢慢闭合形成卵巢腔;有微血管出现(见图2a)。70日龄,全长64.2mm,性腺一端继续延伸,形成产卵板,卵原细胞沿着边缘分布,血管增多(见图2b)。80日龄,全长87.3mm,产卵板数目逐渐增多,卵原细胞数量也增加,同时细胞的体积增大,逐渐向过渡细胞转变,细胞沿着产卵板分布。90日龄,全长104mm,产卵板和卵原细胞数目都继续增多,在产卵板上紧密排列。细胞体积也进一步增大(见图2c)。100日龄,全长122mm,产卵板数目继续增加,但卵巢腔仍未闭合,未见Ⅰ时相卵母细胞出现(见图2d)。110日龄,全长132mm,产卵板上存在大量的卵原细胞向卵母细胞过渡的细胞,但仍未见有Ⅰ时相卵母细胞出现(见图2e)。
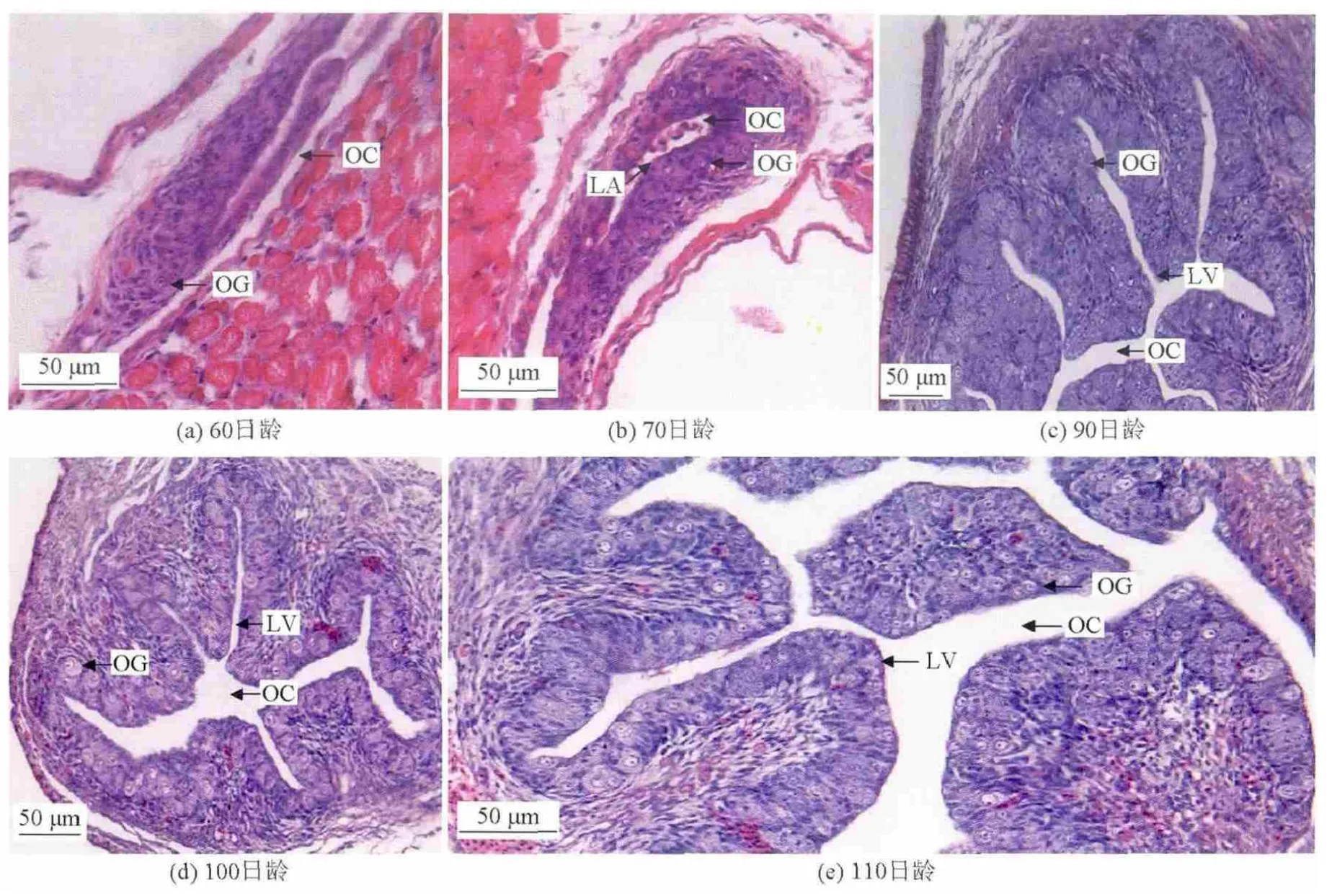
图2 60~110日龄双单倍体牙鲆的卵巢Fig.2 Ovary of 60~110 day sold doubled haploid Paralichthys olivaceus
3.2.2 精巢的分化
双单倍体牙鲆和普通牙鲆在精巢分化时间上基本相同。全长42.6~51.5mm、55日龄的幼鱼中,没有出现卵巢腔裂隙的那一类型的性腺则没有明显变化,整个性腺呈长条状(见图3a)。笔者认为像这样没有变化的性腺将发育成精巢。60~80日龄,全长55~87mm,精巢继续延伸、变宽,精原细胞有所增加(见图3b)。90日龄,全长100mm,精原细胞聚集成簇,形成囊状结构,将会发展成为精小叶,精小叶间基质内有微血管分布,精原细胞数目大量增加(见图3c)。100日龄,全长122mm,精巢内精小叶结构清晰可见,出现初级精母细胞,还有少量次级精母细胞,标志着性腺分化完成(见图3d)。
3.3 双单倍体牙鲆的性腺发育
3.3.1 卵巢的发育
牙鲆具有一对卵巢,呈圆锥状,一般情况下呈左右对称状分布。但是在双单倍体牙鲆中,卵巢经常出现不对称分布的情况,形态包括:缺少一边,只剩左支;性腺一端弯曲折叠;性腺左右两端一大一小等。牙鲆左右卵巢各延伸出一条输卵管,在临近生殖孔处汇合,并开口于生殖孔。根据卵巢发育过程中生殖细胞形态、结构的变化及特点将其分为以下几个时期。
1)Ⅰ期,3~5月龄,卵巢内的细胞主要由卵原细胞、Ⅰ时相卵母细胞以及由卵原细胞向Ⅰ时相卵母细胞过渡的细胞组成。卵原细胞小且圆,细胞质区域显著,核仁明显,细胞聚集成团。卵原细胞不断增值。Ⅰ时相卵母细胞原生质和细胞核开始增大,细胞质被苏木素染成淡紫色,核膜界线清晰,核膜边缘有1~3个染色很深的核仁,观察到核质内有丝状的物质,似染色体残迹。过渡的细胞其细胞直径介于卵原细胞和卵母细胞之间,由卵原细胞缓慢过渡到卵母细胞。

图3 55~110日龄双单倍体牙鲆的精巢Fig.3 Testisof 55~110 daysold doubled haploid Paralichthys olivaceus
2)Ⅱ期,6~18月龄,根据卵巢内卵母细胞直径、油球、生长环和卵黄核的出现,以及核仁数目的变化,将Ⅱ时相卵母细胞划分为早、中、晚3个时期。6~10月龄的卵巢为早期卵巢,与Ⅰ期相比,卵母细胞体积增大,呈圆形或椭圆形,细胞质区域增大,被苏木素染成深紫色,靠近核膜处出现油球,在细胞核边缘分布3~6个大核仁不等。11月龄的卵巢为早期向中期过渡的卵巢,可见卵母细胞体积进一步增大,核质比变小,核仁数目增加,油球数目增加,并聚集成块,个别卵母细胞出现卵黄核,正向Ⅱ期中期过渡。12~16月龄的卵巢为中期卵巢,卵母细胞体积进一步增大,在性腺中排列紧密,成不规则形状,油球数目增多,沿着细胞核周围分层排列,部分卵母细胞、油球在靠近细胞质外缘围成一圈,把细胞质分成内外两层;核仁数目增加,核仁与前期相比变小,数目增加至7~20个不等,细胞核中间出现似染色质的物质,呈团状,个别有卵黄核出现。18月龄为中期向晚期过渡阶段,细胞体积进一步增大,呈椭圆形或不规则形状,油球继续增多,分层聚集成块,细胞质染色出现分层现象,靠近卵核处染成浅紫色,而靠近卵膜处染成深紫色;核仁排列在细胞核的边缘,数目增加,出现卵黄核。
与普通牙鲆相比,双单倍体牙鲆的Ⅰ期卵巢发育过程没有差异,3~5月龄卵巢内的细胞主要由卵原细胞、Ⅰ时相卵母细胞以及由卵原细胞向Ⅰ时相卵母细胞过渡的细胞组成(见图4a)。
普通牙鲆的Ⅱ期卵巢,6~17月龄,同样根据卵巢内卵母细胞直径、油球、生长环和卵黄核的出现,以及核仁数目的变化,将Ⅱ时相卵母细胞划分为早、中、晚3个时期。6~9月龄为早期,卵母细胞体积增大,细胞多呈圆形或椭圆形,在近核膜处出现油球,在核膜边缘分布3~6个不等的大核仁。10~12月龄为中期,卵母细胞的体积进一步增大,在性腺中排列紧密,呈不规则形状,油球数目增多,沿着细胞核周围分层排列,部分卵母细胞、油球在靠近细胞质外缘围成一圈,把细胞质分成内外两层。核仁数目增加至7~17个。细胞质染色出现分层现象,靠近细胞核部分染色较浅,而靠近核膜处染色较深。13~18月龄为晚期,细胞体积继续增大,呈不规则多角形,出现卵黄核,卵黄核周围细胞质被溶解,核仁数量增加,核膜模糊。
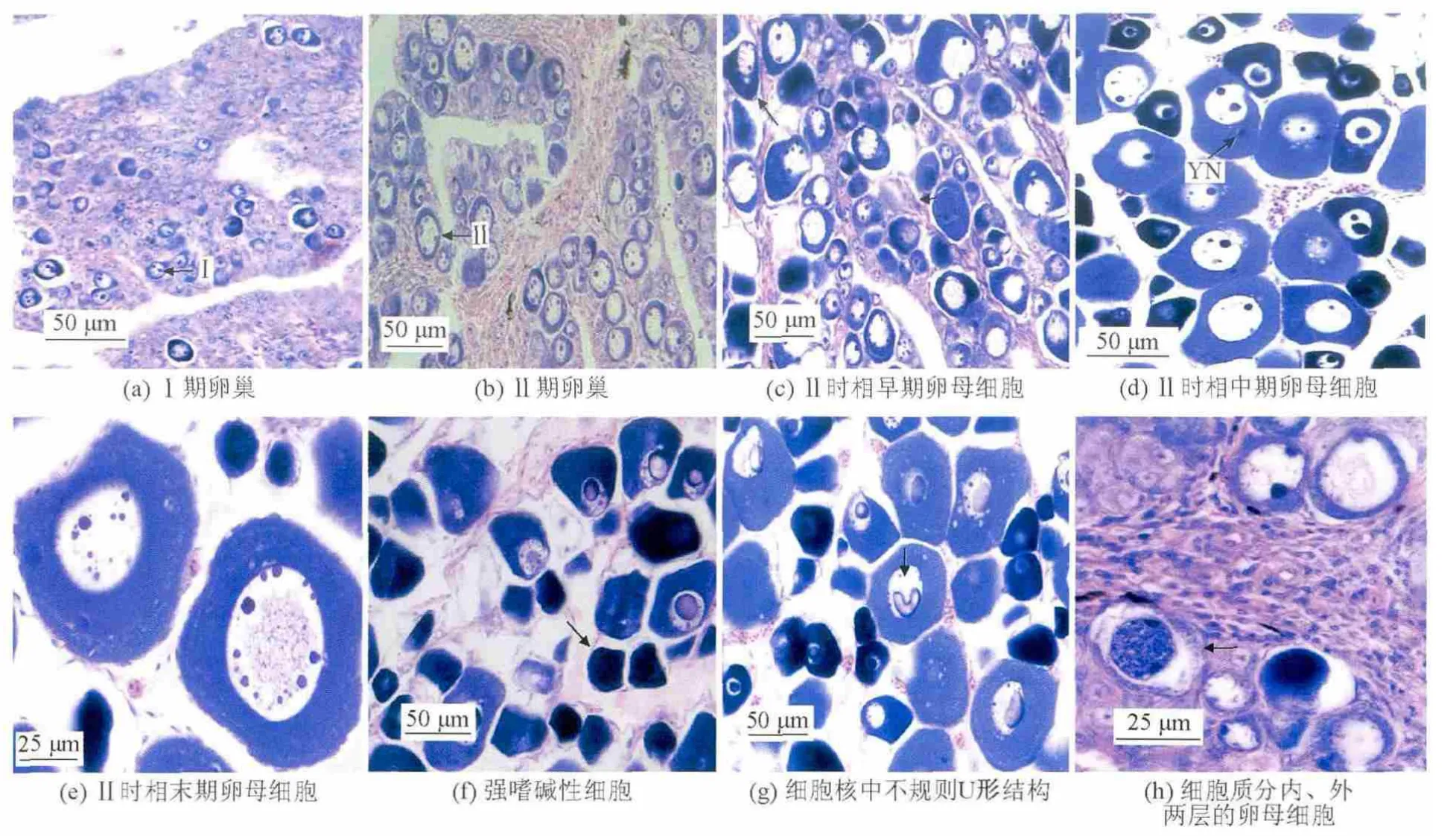
图4 双单倍体牙鲆卵巢的发育Fig.4 Ovary development of doubled haploid Paralichthy solivaceus
双单倍体牙鲆卵巢中发育异常的卵母细胞主要是形态结构的改变:a.通过各个时期双单倍体牙鲆性腺与普通牙鲆性腺的对比,性腺中的嗜碱性细胞增多,不见细胞核,只见一个个被染成深紫色的细胞;b.细胞核中出现不规则的嗜碱性结构,中空的U形结构;c.细胞质出现分层现象,表现为内外两层,且相互分离,内层染色深,外层染色浅,内层聚集成团,看不清内部结构;d.退化的卵巢,能看到卵巢腔和产卵板的结构,分布着极少量血管和细胞,没有卵母细胞,因此不能分清发育到哪期,笔者把这类卵巢叫做退化卵巢;e.败育的卵巢,能看到卵巢腔和产卵板的结构,性腺组织被染成红色,有非常少的血管分布,不见任何细胞,故称此类卵巢为败育卵巢(见图4f~图4h)。
3.3.2 精巢的发育
牙鲆精巢位于体腔后缘、中肾后方,与中肾相连,根据精巢发育过程中生殖细胞形态、结构的变化及特点将其分为以下几个时期。
1)Ⅰ期,与普通牙鲆发育时期及特点相同,2~3月龄,精巢形成许多精小叶,每个精小叶内镶嵌2~4个精原细胞,小叶基质中有微血管。精原细胞呈圆形或椭圆形,核大,位于中央或边缘,细胞质染色浅,在其一生中Ⅰ期精巢仅出现一次。
2)Ⅱ期,与普通牙鲆发育时期及特征也没明显差异,4~5月龄,精小叶略显增大,小叶间结缔组织增多,精原细胞数目迅速增加,紧密排列于精小叶中,处于增值期;并出现少量初级精母细胞,初级卵母细胞与精原细胞相比,体积变小,细胞核染色深。
3)Ⅲ期,6~11月龄,精小叶体积增大,精小叶间结缔组织变薄。早期,6月龄,精小叶内充满了精原细胞和初级精母细胞,以及少量次级精母细胞;中期,7~8月龄,可见含有大量初级精母细胞和次级精母细胞的精小囊,还有少量精子细胞;末期,9~11月龄,可见精子细胞增多,同时含有大量的初级和次级精母细胞,精原细胞和初级精母细胞沿着精小叶边缘分布,此期为向Ⅳ期精巢过渡阶段。初级精母细胞的体积小于精原细胞,次级精母细胞的体积小于初级精母细胞,由初级精母细胞分裂而来;精子细胞的体积小于次级精母细胞,由次级精母细胞分裂而来。可以看到,精原细胞分布在精小叶的边缘,精小叶内的细胞发育是不同步的,而精小囊内的细胞发育是同步的。与普通牙鲆相比,双单倍体牙鲆Ⅲ期精巢发育较慢,普通牙鲆性腺在同期进入了Ⅳ期,主要特征就是精小叶间结缔组织变薄,精小叶内充满大量正在变态的精子细胞和精子,以及大量的初级和次级精母细胞,精小叶之间相互连通或贯穿(见图5a和图5b)。

图5 双单倍体牙鲆精巢的发育Fig.5 Testis development of doubled haploid Paralichthy solivaceus
11月龄,观察到其中1尾双单倍体牙鲆精巢有退化的趋势,精子细胞与前期相比减少,精小叶内含有大量的精原细胞和初级精母细胞(见图5c)。
13~15月龄,双单倍体牙鲆与普通牙鲆差别很大,精巢发生退化(见图5d)。13月龄的主要特征是次级精母细胞和精子细胞消失,精小叶内被大量的精原细胞及少量的初级精母细胞填充。其中有1尾发育正常的双单倍体牙鲆,特征是精小叶内出现空腔,此空腔应该是精子排出以后残留的,还含有大量的精原细胞、初级精母细胞以及少量的次级精母细胞。14~15月龄的主要特征是精小叶内只含有精原细胞,初级精母细胞消失不见,似Ⅱ期精巢(见图5e和图5f)。
16~18月龄,部分双单倍体牙鲆精巢发育正常,精小叶中出现空腔,似是精子排出后留下的,同时还含有大量精原细胞和初级精母细胞,以及少量的次级精母细胞和精子细胞(见图5g)。但此期并不完全像排出精子后的精巢,普通牙鲆精子排出后,精小叶萎缩,只含有残存的精子、精原细胞和初级精母细胞,特征与所观察到双单倍体牙鲆性腺有差距。此外,还有部分精巢仍处于退化阶段。
18月龄,观察到1尾双单倍体牙鲆精巢败育,从切片可以看出精小叶结构以及精小叶内出现很多空腔,但是观察不到任何细胞结构,也就是说没有精原细胞,故称此类精巢为败育精巢(见图5h)。
4 讨论
4.1 双单倍体牙鲆的性比
牙鲆的性别决定机制是XX-XY型,在XX-XY性别决定的鱼类中,雌核发育后代预期是全雌的。本研究中,在79尾实验鱼中,雌鱼44尾,占群体总数的55.7%;雄鱼30尾,占群体总数的37.9%;雌雄鱼比例为1∶0.68,与预测结果存在很大的偏差。导致该结果的原因一部分可能归结于环境因素压制了性别决定体系,还有一些实验表明隐性突变影响性别决定。双单倍体出现雄性的例子有很多,双单倍体斑马鱼主要是雄鱼,甚至是双单倍体雌鱼诱导雌核发育都能生产全雄的克隆系[8,9]。斑马鱼中这种异常的性比似乎是一个重要的事实,所有的动物开始都发育成雌鱼,而后会有一部分波动比例改变性别变成雄鱼[10]。尼罗罗非鱼的性别决定是XXXY型[11],但是可能受温度的影响[9,12],双单倍体中出现较高的雄鱼比例,比例高达35.3%。Müller-Belecke和Hörstgen-Schwark[9]认为存在1~2个较小的性别决定因素,当这几个性别决定因素发生在纯合子状态时可能推翻XX-XY机制。Sarder等[13]认为在双单倍体出现雄鱼的这些群体中存在不止一个较小的性别决定位点的分离。Karayücel等[14]发现在尼罗罗非鱼中存在着一个能引起雌鱼变为雄鱼的性逆转基因,且此基因和控制红色体色的基因相关联。鱼类的性别决定是个相当复杂的过程,不仅受遗传影响,还与其所在环境、行为和生理因素等有关[12]。本实验未能对双单倍体牙鲆中出现雄性的原因进行说明,因此还需设计实验对其产生的原因进行研究。
4.2 双单倍体牙鲆的性腺分化
多数鱼类的性腺分化不仅与日龄相关,还与全长密切相关。日龄越大,全长越长,性腺发育越明显。不同鱼种性腺分化时间差别很大,同一种鱼的性腺分化时间也可能不同,Yamamoto[15]报道牙鲆性腺分化的全长是27~37mm;而Tabata[16]报道的全长为30~100mm;孙鹏等[17]报道的全长为38mm;孙朝徽[18]报道的全长为33.8mm。本研究普通牙鲆全长41mm时才开始向卵巢分化,而双单倍体牙鲆全长47mm时才开始分化。这可能是诱导处理和培育水温不同导致的。本研究观察到双单倍体牙鲆与普通牙鲆的性腺分化时间有差异,但是并未找到出现这种现象的具体原因,还需设计实验进行具体的观察研究。
4.3 双单倍体牙鲆性腺的退化及败育
本研究中,观察到精巢退化的现象。该现象可能是隐性有害基因纯合并表达引起的,可能是单基因控制,可能由多基因共同决定,也可能与Y染色体的缺失有关。本研究的结果与周丹[2]研究的结果相似。笔者并未对其产生的原因进行研究,还需要设计实验进行进一步的研究。同时,观察到1尾双单倍体牙鲆精巢败育。造成精巢败育的原因可能与隐性有害基因的纯合或Y染色体的缺失有关,也可能是两者共同决定的。由于此类精巢数目很少,还需要进一步的验证及研究。
本研究中,观察到一尾双单倍体牙鲆卵巢退化和一尾双单倍体牙鲆卵巢败育。由于所观察的此两类卵巢数目很少,而且在其他鱼类中也没有此种现象的报道,所以笔者分析造成这种现象的原因可能与基因纯合并表达有关,也可能是由于突变基因的影响,还需进一步设计实验进行证明。
[1] 安泉泉.双单倍体牙鲆(Paralichthys olivaceus)与骨骼生长相关的微卫星标记筛选[D].上海:上海海洋大学,2012.
[2] 周 丹.雌核发育双单倍体牙鲆(Paralichthys olivaceus)的纯合性鉴定和性腺的组织学观察[D].哈尔滨:东北农业大学,2013.
[3] 方永强,Welsch U.文昌鱼卵巢中滤泡细胞超微结构及功能的研究[J].中国科学(B辑),1995,25(10):1079-1085,1121-1122.
[4] 刘少军.革胡子鲇原始生殖细胞的起源、迁移及性腺分化[J].水生生物学报,1991,15(1):1-7,97-99.
[5] 施瑔芳,尹伊伟,胡传林.鲢鱼性腺周年变化的研究[J].水生生物学集刊,1964,5(1):77-94.
[6] 刘 筠.中国养殖鱼类繁殖生理学[M].北京:农业出版社,1993.
[7] 张耀光,罗泉笙,何学福.长吻鮠的卵巢发育和周年变化及繁殖习性研究[J].动物学研究,1994,15(2):42-48,98.
[8] Streisinger G,Walker C,Dower N,et al.Production of clones of homozygous diploid zebra fish(Brachydanio rerio)[J].Nature,1981,291(5813):293-296.
[9] Müller-Belecke Andreas,Hörstgen-schwark Gabriele.Sex determination in tilapia(Oreochromis niloticus)sex ratios in homozygous gynogenetic progeny and their offspring[J].Aquaculture,1995,137(1-4):57-65.
[10] Maack G,Segner H.Morphological development of the gonadsin zebrafish[J].Journal of Fish Biology,2003,62(4):895-906.
[11] Carrasco LA,Penman D J,Bromage N.Evidence for the presence of sex chromosomes in the Nile tilapia(Oreochromis niloticus)from synaptonemal complex analysis of XX,XY and YY genotypes[J].Aquaculture,1999,173(1-4):207-218.
[12] Devlin Robert H,Nagahama Yoshitaka.Sex determination and sex differentiation in fish:An overview of genetic,physiological,and environmental influences[J].Aquaculture,2002,208(3-4):191-364.
[13] Sarder M R,Penman D J,M yers JM,et al.Production and propagation of fully inbred clonal lines in the Nile tilapia(Oreochromis niloticusL.)[J].Journal of Experimental Zoology,1999,284(6):675-685.
[14] Karayücel İsm ihan,Ezaz Tariq,Karayücel Sedat,et al.Evidence for two unlinked“sex reversal”loci in the Nile tilapia,Oreochromis niloticus,and for linkage of one of these to the red body colourgene[J].Aquaculture,2004,234(1-4):51-63.
[15] Yamamoto Eiichi.Studies on sex-manipulation and production of cloned populations in hirame,Paralichthys olivaceus(Temm inck etSchlegel)[J].Aquaculture,1999,173(1-4):235-46.
[16] Tabata K.Induction of gynogenetic diploidmales and presumption of sex determination mechanisms in the hirameParalichthys olivaceus[J].Bulletin of the Japanese Society of Scientific Fisheries,1991,57:845-850.
[17] 孙 鹏,尤 锋,张立敬,等.牙鲆性腺分化的组织学研究[J].海洋科学,2009,33(3):53-58.
[18] 孙朝徽.牙鲆(Paralichthys olivaceus)性腺分化与发育的组织学研究[D].哈尔滨:东北农业大学,2008.

