WWOX、p53及Bcl-2在鼻咽癌中的表达及意义*
兰会华, 莫武宁, 黄华艺
1广西壮族自治区人民医院检验科,南宁 530021
2广西医科大学第一附属医院临床医学实验中心,南宁 530021
鼻咽癌(nasopharyngeal carcinoma,NPC)是我国常见的恶性肿瘤之一,其发病机制不十分清楚,治疗效果不令人满意,因此,寻找鼻咽癌相关的分子标志物,成为一个重要的研究方向。
WWOX(WW结构域含有氧化还原酶)是新发现的抑癌基因[1],其表达异常在多种肿瘤中频繁出现。研究指出WWOX基因不仅上调p53表达,也下调凋亡抑制因子Bcl-2和Bcl-XL的表达,从而促进肿瘤细胞凋亡[2]。为了研究鼻咽癌中涉及的变化,我们探讨WWOX基因与p53和Bcl-2在鼻咽癌组织中的表达及其相互作用。
1 材料与方法
1.1 病例来源
收集广西医科大学第一附属医院耳鼻喉科初诊、有完整临床及病理资料的鼻咽癌患者鼻咽组织61例,所有的标本均经病理证实,均未经过化疗及放疗。参照 WHO的标准,晚期病理诊断依据TNM分期法进行分期,收集同期鼻咽黏膜慢性炎症(CIONM)组织20例作对照。标本离体后部分置-80℃冰箱保存,部分经10%甲醛溶液固定,石蜡包埋,4μm厚连续切片,贴于涂有0.05%多聚赖氨酸的载玻片备用。
1.2 实验材料
Trizol购自美国Invitrogen公司,逆转录试剂盒购自美国Fermentas公司,引物合成及PCR试剂盒购自上海生工生物工程有限公司,兔抗人WWOX多克隆抗体(ab33248)购自美国Abcam公司,兔抗人p53单克隆抗体(ZA-0501)及鼠抗人Bcl-2单克隆抗体(ZM-0010)购自北京中杉金桥生物技术有限公司。
1.3 RT-PCR检测
用Trizol提取组织RNA,用逆转录试剂盒提供的标准条件进行逆转录反应,所获取的cDNA作为PCR反应模板,用Actin作为cDNA的内参照,cDNA用于WWOX基因引物的PCR扩增,WWOX引 物 (正 向,5′-GAGTTCCTGAGCGAGTGGAC-3′;反向,5′-CCCCAGGAATTCCCTGCTT-3′),扩增条件:95℃预变性5min,94℃变性60s,64℃退火60s,72℃延伸90s,变性、退火和延伸共33个循环,最后72℃延伸10min。cDNA用于p53基因引物的PCR扩增,p53引物(正向,5′-GAAACTACTTCCTGAAAACAACGT-3′;反 向,5′-GCCTCACAACCTCCGTCAT-3′),扩增条件:95℃预变性5 min,94℃变性45s,57℃退火45s,72℃延伸45s,变性、退火和延伸共33个循环,最后72℃延伸10 min。cDNA用于Bcl-2基因引物的PCR扩增,Bcl-2引物(正向,5′-GACGCTTTGCCACGGTGGTG-3′;反 向,5′-GGGGCAGGCATGTTGACTTCAC-3′),扩增条件:95℃预变性5min,94℃变性45s,65℃退火45s,72℃延伸45s,变性、退火和延伸共33个循环,最后72℃延伸10min。扩增完成后,用1.5%琼脂糖凝胶电泳分析扩增产物,全自动凝胶成像电泳分析仪下观察结果并进行照相,用Gel-pro Analyzer 4.5凝胶定量分析软件分析各扩增条带产物的含量。
1.4 免疫组织化学法检测
按照说明书进行实验,按标准方法进行石蜡包埋组织的免疫组织化学染色,显微镜下,对所测区域进行定位后,在相同显微镜条件下采集图像,用Image-Pro Plus 5.1彩色图像分析软件分析图像,统计累积吸光度值/测量面积,即平均吸光度值(A值)。
1.5 统计学方法
应用SPSS 13.0软件包对数据进行统计和分析,实验数据用±s表示,两样本均数比较采用t检验,多样本均数比较采用方差分析,相关性检验采用Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 WWOX、p53及Bcl-2mRNA的表达情况
为了解 WWOX、p53和Bcl-2的转录情况,对81例鼻咽黏膜慢性炎症和鼻咽癌组织mRNA表达进行研究,在肿瘤组织中WWOX mRNA扩增产物较正常组织减低或缺失(图1A),而p53和 Bcl-2 mRNA扩增产物较鼻咽黏膜慢性炎症组织增高(图1B、1C)。
2.2 WWOX、p53及Bcl-2蛋白免疫组织化学染色
应用相应的抗体对81例组织进行免疫组织化学染色分析,观察WWOX、p53和Bcl-2蛋白在鼻咽癌中的表达,结果表明,在鼻咽癌组织中WWOX蛋白表达显著弱于鼻咽黏膜慢性炎症组织(图2A、2B),在鼻咽癌中p53和Bcl-2蛋白表达明显增强(图2C~2F)。

图1 WWOX、p53and Bcl-2mRNA在鼻咽癌及对照组组织中的表达Fig.1 The expression of WWOX,p53and Bcl-2mRNA in NPC and CIONM tissues
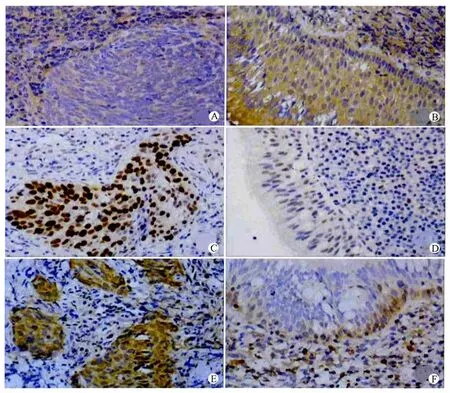
图2 WWOX、p53和Bcl-2蛋白在鼻咽癌及对照组中的表达(免疫组织化学染色,×400)Fig.2 The expression of WWOX,p53and Bcl-2protein in NPC and CIONM tissues(Immunohistochemical staining,×400)
2.3 WWOX、p53和Bcl-2的表达情况
数据显示,WWOX mRNA及蛋白在鼻咽癌组表达明显低于鼻咽黏膜慢性炎症组(均P<0.05),p53和Bcl-2mRNA及蛋白在鼻咽癌组中表达明显强于鼻咽黏膜慢性炎症组(均P<0.05)(表1)。
表1 WWOX、p53及Bcl-2mRNA及蛋白在鼻咽癌和黏膜慢性炎症组织中的表达(A,±s)Table 1 The mRNA and protein expression of WWOX,p53and Bcl-2in NPC and CIONM tissues(A,±s)
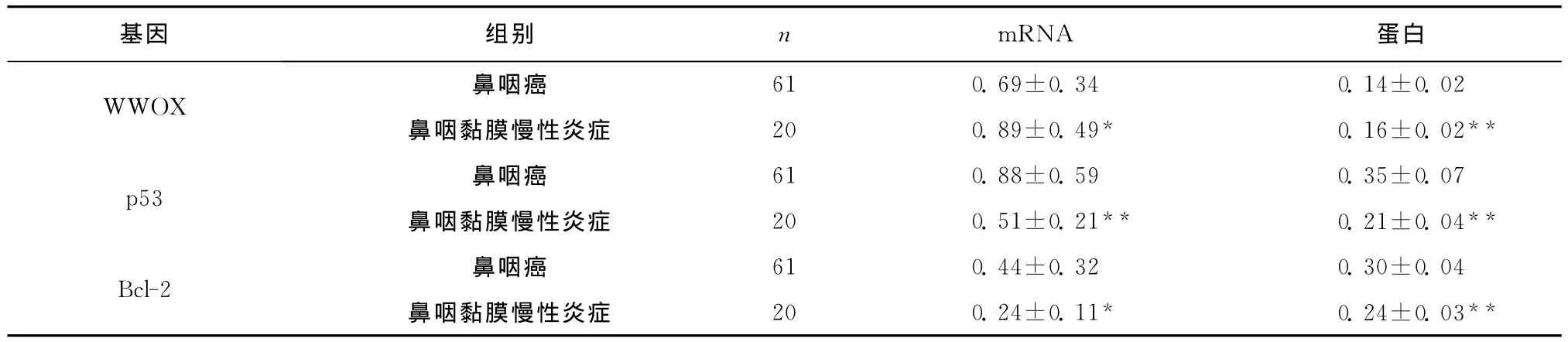
表1 WWOX、p53及Bcl-2mRNA及蛋白在鼻咽癌和黏膜慢性炎症组织中的表达(A,±s)Table 1 The mRNA and protein expression of WWOX,p53and Bcl-2in NPC and CIONM tissues(A,±s)
与鼻咽癌组织比较,*P<0.05**P<0.01
蛋白WWOX 鼻咽癌基因 组别 n mRNA 61 0.69±0.34 0.14±0.02鼻咽黏膜慢性炎症 20 0.89±0.49* 0.16±0.02**p53 鼻咽癌 61 0.88±0.59 0.35±0.07鼻咽黏膜慢性炎症 20 0.51±0.21** 0.21±0.04**Bcl-2 鼻咽癌 61 0.44±0.32 0.30±0.04鼻咽黏膜慢性炎症 20 0.24±0.11* 0.24±0.03**
2.4 WWOX、p53和Bcl-2蛋白表达与相关临床因素的关系
为了进一步探讨 WWOX、p53和Bcl-2基因在鼻咽癌的发生发展中的作用,本研究对 WWOX、p53和Bcl-2在肿瘤不同临床分期、有无淋巴结转移、不同性别、年龄以及病理类型中的蛋白水平表达情况进行了分析,WWOX蛋白表达与鼻咽癌的临床分期和有无颈部淋巴结转移有关,WWOX蛋白在癌症的Ⅰ~Ⅱ期表达要高于Ⅲ~Ⅳ期(P<0.01),在无淋巴结转移组要高于有淋巴结转移组(P<0.05)。p53蛋白表达在Ⅲ~Ⅳ期高于Ⅰ~Ⅱ期(P<0.05),Bcl-2 蛋 白 在 鼻 咽 癌 中的表达与TNM分期、淋巴结转移、性别、年龄及病理分型无关(均P>0.05)(表2)。
表2 WWOX、p53及Bcl-2蛋白表达与鼻咽癌相关临床因素的关系(A,±s,n=61)Table 2 The relationship between the protein expression of WWOX,p53and Bcl-2and the clinical features of NPC(A,±s,n=61)
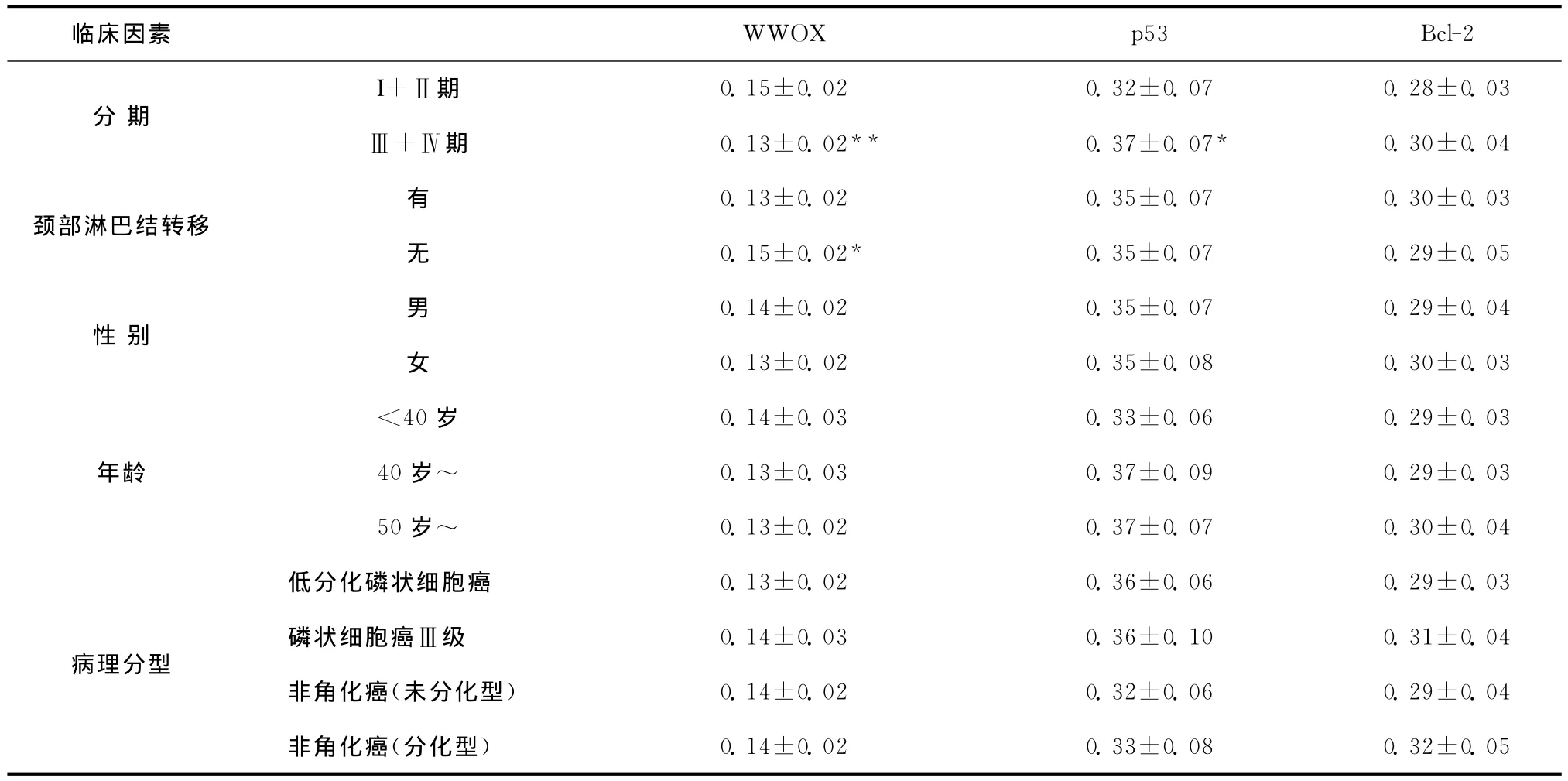
表2 WWOX、p53及Bcl-2蛋白表达与鼻咽癌相关临床因素的关系(A,±s,n=61)Table 2 The relationship between the protein expression of WWOX,p53and Bcl-2and the clinical features of NPC(A,±s,n=61)
组内比较,*P<0.05**P<0.01
临床因素 WWOX p53 Bcl-2分期I+Ⅱ期 0.15±0.02 0.32±0.07 0.28±0.03Ⅲ+Ⅳ期 0.13±0.02** 0.37±0.07*0.30±0.04颈部淋巴结转移性别年龄0.13±0.02 0.35±0.07 0.30±0.03无0.15±0.02* 0.35±0.07 0.29±0.05有0.14±0.02 0.35±0.07 0.29±0.04女0.13±0.02 0.35±0.08 0.30±0.03男<40岁 0.14±0.03 0.33±0.06 0.29±0.03 40岁~ 0.13±0.03 0.37±0.09 0.29±0.03 50岁~ 0.13±0.02 0.37±0.07 0.30±0.04病理分型0.14±0.02 0.33±0.08 0.32±0.05低分化磷状细胞癌 0.13±0.02 0.36±0.06 0.29±0.03磷状细胞癌Ⅲ级 0.14±0.03 0.36±0.10 0.31±0.04非角化癌(未分化型) 0.14±0.02 0.32±0.06 0.29±0.04非角化癌(分化型)
2.5 WWOX与p53和Bcl-2蛋白的相关性分析
为分析WWOX蛋白与p53和Bcl-2蛋白的关系,对WWOX与p53和Bcl-2在蛋白水平的表达进行相关分析,数据显示,在鼻咽癌组织中WWOX与p53表达之间有负相关关系(r=-0.62,P=0.008),WWOX与Bcl-2表达也呈负相关关系(r=-0.45,P=0.008)。
3 讨论
WWOX(WW结构域含有氧化还原酶)是新近发现在FRA16D常见的染色体脆性位点上含大于1M碱基对的基因组区域的基因,据报道,在几种不同来源的肿瘤细胞株中WWOX基因存在低表达、缺失或异常转录[3],WWOX基因编码1个含有2个WW区域和短链脱氢酶还原酶区域的46kD的蛋白质,WW结构域通常是由一个40个氨基酸组成的球状结构域,其中的2个色氨酸和1个高度保守的脯氨酸,就如SH3结构域一样,WW结构域的特点是与含脯氨酸配体介导的蛋白质相互作用,通常,根据其与配体结合的情况,WW区域可以分为4个等级,近来,有人认为他们可以通过酪氨酸磷酸化来调节[4]。
研究认为,WWOX作为一种癌抑制基因,与肿瘤的发生、发展和预后密切相关,其表达异常在多种肿瘤,如乳腺癌、前列腺癌、食管癌,肺癌及胃癌中频繁出现。本研究中,WWOX转录在鼻咽黏膜慢性炎症组织中表达正常但在鼻咽癌组织中WWOX转录明显减少或缺失,这表明在鼻咽癌中WWOX在转录水平已有改变。虽然DNA和RNA很重要,但是决定基因功能的实际因素是其蛋白的表达水平,为进一步探讨,本研究采用免疫组织化学染色技术检测蛋白表达情况,发现在鼻咽癌组织中 WWOX蛋白表达也低于鼻咽黏膜慢性炎症组织,在鼻咽癌组织中WWOX mRNA和蛋白表达减少或缺失,因此,WWOX基因可能在肿瘤中起着重要的作用。另外,研究还发现,在鼻咽癌中WWOX蛋白与鼻咽癌的不同临床分期及有无颈部淋巴结转移相关,在癌症早期WWOX的表达高于晚期,在有淋巴结转移的病例表达率低于无淋巴结转移者,提示WWOX的减低或缺失可能参与调控鼻咽癌的发生、发展。
p53是体内重要的抑癌基因,p53基因作为一个完整基因组的保护者,在细胞凋亡的调控中起着至关重要的作用,p53基因的改变广泛存在于人类肿瘤中。在细胞损伤后,突变的p53基因导致p53蛋白合成的改变使其无法控制DNA修复和细胞凋亡的激活,这将导致DNA持久损害[5]。在多种人类肿瘤中,p53基因突变频率在50%~70%,但在鼻咽癌中p53基因突变频率低于10%[6]。大量的研究显示,60%以上的鼻咽癌组织和几乎100%的鼻咽癌细胞株中存在p53过表达,具体机制目前还不清楚[7-8]。本研究中鼻咽癌组p53mRNA表达水平明显高于鼻咽黏膜慢性炎症组,与张猛等[9]报道相符,本研究数据显示p53蛋白在鼻咽癌组织中呈过表达,鼻咽癌晚期p53蛋白表达明显高于早期,这提示p53的过表达在鼻咽癌的发生发展中起着重要的作用。
Bcl-2基因是迄今研究最深入的凋亡调控基因之一,负责调节凋亡信号的后期阶段[10],过表达的Bcl-2可避免细胞的程序性死亡,该蛋白质在致癌作用中至关重要。在大多数恶性肿瘤中,肿瘤细胞Bcl-2的表达显著高于良性肿瘤细胞和正常细胞,Sheu等[11]研究发现,在鼻咽癌组织中,Bcl-2蛋白呈高表达,另外在不典型增生上皮上也呈高表达,这说明Bcl-2蛋白在鼻咽癌发生的早期阶段扮演了重要角色。本研究发现Bcl-2mRNA和蛋白在鼻咽癌组织中的表达高于鼻咽黏膜慢性炎症组织,Bcl-2蛋白的阳性表达在鼻咽癌早期和晚期、有无淋巴结转移、各病理分型中的阳性表达分别进行比较,差异无统计学意义。在一定程度上说明Bcl-2的异常表达是细胞癌变的较早期事件,与鼻咽癌的转移和预后关系不大。
考虑到其肿瘤抑制效应的基本机制,一些研究认为WWOX不仅上调p53表达,而且也下调凋亡抑制因子Bcl-2和Bcl-XL蛋白的表达,从而促进肿瘤细胞凋亡,基于本课题的研究结果我们推测WWOX基因在鼻咽癌中可能发挥抑癌基因的功能,经进一步分析,WWOX与Bcl-2的蛋白表达呈负相关关系,这证实了在肿瘤中WWOX下调Bcl-2的表达,而本课题中WWOX与p53蛋白呈负相关关系,这与其他癌症的研究中 WWOX基因上调p53的表达不相符,也许是因为在鼻咽癌中p53突变频率低于10%,但却存在过表达有关,但其具体机制尚不清楚,有待进一步研究。总之,三者在鼻咽癌的发生发展中可能具有协同作用,共同促进了鼻咽癌的生长和转移,但是目前还缺乏有关 WWOX与p53、Bcl-2基因在肿瘤中的相关性调控机制的相关文献报道,这些有待进一步研究探讨。
[1] Bednarek A K,Laflin K J,Daniel R L,et al.WWOX,a novel WW domain-containing protein mapping to human chromosome 16q23.3-24.1,a region frequently affected in breast cancer[J].Cancer Res,2000,60(8):2140-2145.
[2] Chang N S,Pratt N,Heath J.Hyaluronidase induction of a WW domain-containing oxidoreductase that enhances tumor necrosis factor cytotoxicity[J].J Biol Chem,2001,276(5):3361-3370.
[3] Adam J,Karen J,Claire T,et al.WWOX:A candidate tumor suppressor gene involved in multiple tumor types[J].PNAS,2001,12(25):11417-11422.
[4] Gorgul A,Seta K,Nowakowska M,et al.WWOX oxidoreductase-substrate and enzymatic characterization[J].Z Naturforsch[C],2011,66(1/2):73-82.
[5] Soussi T.The p53tumor suppressor gene:from molecular biology to clinical investigation[J].Ann N Y Acad Sci,2000,910:121-137.
[6] Hoe S L,Sam C K.Mutational analysis of p53and RB2/p130 genes in Malaysian nasopharyngeal carcinoma samples:apreliminary report[J].Malays J Pathol,2006,28(1):35-39.
[7] Segawa Y,Oda Y,Yamamoto H,et al.Overexpression of inducible nitric oxide synthase and accumulation of 8-OHdG in nasopharyngeal carcinoma[J].Histopathology,2008,52(2):213-223.
[8] Lili L,Shang Z,Xue C,et al.The activation of p53mediated by Epstein-Barr virus latent membrane protein 1in SV40 large T-antigen transformed cells[J].Febs Letters,2008,3(5):755-762.
[9] 张猛,龙江斌,梁启万,等 .鼻咽癌p53与bcl-2基因表达的相关关系[J].中华医学遗传学杂志,2002,19(3):260-261.
[10] Cory S,Huang C S D,Adams M J.The Bcl-2family:roles in cell survival and oncogenesis[J].Oncogene,2003,22(53):8590-8607.
[11] Sheu L F,Chen A,Meng C L,et al.Analysis of Bcl-2expression in normal,inflamed,dysplastic nasopharyngeal epithelia,and nasopharyngeal carcinoma:association with p53expression[J].Hum Pathol,1997,28(5):556-562.

