CO2浓度升高对毛竹器官矿质离子吸收、运输和分配的影响
庄明浩,陈双林,李迎春,郭子武,杨清平
(中国林业科学研究院亚热带林业研究所, 富阳 311400)
CO2作为最主要的温室气体,由于化石燃料的燃烧、森林砍伐及农业活动的影响,大气CO2浓度急剧升高,其浓度已经从工业革命前的270 μmol/mol增至目前的360 μmol/mol,而且仍以每年1—1.5 μmol/mol的速度上升[1-3]。CO2作为植物光合作用最重要的碳源,其浓度升高会直接影响到植物的生长发育,对农业以及自然生态系统有着深远的影响[4-6]。目前大气CO2浓度升高对植物生理生态的影响及植物的适应性管理已成为全球范围内的研究热点。近年来,针对大气CO2浓度升高条件下植物的响应机制已开展了较多的研究,主要集中在CO2的“施肥效应”,一方面CO2浓度升高可以提高植物光合作用的原料,有利于促进Rubisco的羧化作用,增强光合作用对CO2的固定能力[7-11];另一方面提高叶绿体内CO2与O2体积比,致使活性氧产生几率减小,反馈激活植物光合作用的光反应过程,促进合成更多的还原力,诱导植物抗氧化酶活性和抗氧化剂的上升[12],促进植物的生长,增加植物的生物量和经济产量[13-14]。然而,也有研究证实长期高浓度CO2处理可能会导致植物的光合能力下降,出现光适应现象[15],也会诱导植物叶片抗氧化活性下降,导致植物更易受到氧化胁迫[16],从而对植物生长产生抑制作用。另外,有研究者认为植物生长对CO2浓度升高的响应与植物自身矿质营养元素的吸收、运输和分配密切有关[17],且已有研究证实CO2浓度升高会加速植物对矿质营养元素的吸收,提高其含量用来满足自身生长的需要[18],也有研究提出相反的观点[19],总体来讲,植物矿质离子的吸收、运输和分配对CO2浓度升高的响应研究较少且缺乏深入系统的认识。因此有必要深入探讨CO2浓度升高条件下对植物矿质营养元素选择吸收、运输和分配的影响,这对于揭示CO2浓度升高对植物生长发育的影响机制具有重要意义。
毛竹(Phyllostachysedulis)隶属禾本科(Poaceae)竹亚科(Bambusoideae)刚竹属,是中国分布最广、面积最大、利用领域最广、最为重要的经济竹种,具有生长快、产量高、效益好等特点,而且毛竹林对区域水源涵养、水土保持、固碳排氧和调节气候等方面发挥着巨大的生态保护作用[20]。鉴于毛竹对区域社会经济发展和生态环境保护的重要性,针对大气CO2浓度逐渐升高的背景,就很有必要开展大气CO2浓度升高对毛竹生长发育和生理生态的影响研究。为此,本文运用开顶式气室(OTCs)模拟CO2浓度升高情景,测定不同CO2浓度条件下的毛竹器官矿质离子浓度,分析CO2浓度升高条件下的毛竹器官矿质离子选择性吸收、运输和分配特征,旨在为气候变化背景下的毛竹林适应性经营管理提供理论依据。
1 材料与方法
1.1 试验材料
试验在浙江省临安市(29°56′—30°23′N,118°51′—119°72′E)太湖源镇太湖源观赏竹种园中进行。于2009年11月在浙江省安吉竹博园的毛竹林中选取地径(18.15±1.75) mm,全高(2.75±0.09) m,生长健壮的1年生立竹,进行不带宿土的全梢竹盆栽,栽植盆上端直径38 cm,下端直径32 cm,高35 cm,每盆栽植1株,共50盆。盆栽基质为红壤与细沙体积比3∶1均匀混合而成,pH值5.8,水解氮198.47 mg/kg,速效磷67.25 mg/kg,速效钾74.16 mg/kg。盆栽试验竹苗经定期人工水分补充,及时去除笋芽和杂草等管护,至2011年7月开始进行大气CO2浓度处理试验。
1.2 试验设计
开顶式气室(OTCs)由不锈钢管和无色透明玻璃构建,主要包括过滤系统、通风及布气系统和框架等,气室边长1.5 m,高4.0 m,室壁上部向内部倾斜45°成斜面,玻璃室壁为正八边形,CO2为钢瓶装纯CO2。环境大气经活性炭过滤后,再添加钢瓶中通过CO2减压阀释放的CO2气体,CO2添加量先经气室体积和轴流风机流速计算后,通过流量计来调节,用750 W功率的轴流风机通入OTCs内。气室顶部装有自动喷灌系统,对试验竹苗进行水分定期供应。
试验共设3个CO2浓度处理,分别为环境背景大气(CK,360—380 μmol/mol)、500 μmol/mol(T1,475—530 μmol/mol)、700 μmol/mol(T2,685—730 μmol/mol)。每个处理重复3次。每处理气室内均匀放置5—6盆毛竹试验盆栽苗(也用于显微结构、抗性生理等试验),竹冠不重叠。OTCs内CO2浓度用上海兴卓环保仪器有限公司生产的CO2红外传感器进行监测,每隔3 d在气室的上部、中部、下部各测定1次。
1.3 取样和测定方法
2011年7月10号开始熏气,每天熏气24 h,于2011年10月10号停止熏气。熏气结束时,即在每个气室内选取5株立竹,分别取秆、枝、叶、根混合样品各约300 g,在烘箱中105 ℃杀青30 min,再80 ℃烘至恒重,后磨碎过40目筛,称量后用硝酸-高氯酸法消煮。Na+采用火焰光度法测定[21],Fe2+-Fe3+、Ca2+和Mg2+采用原子分光光度法测定[22]。
1.4 数据处理与分析
根据Pitman的方法[23]计算毛竹器官对矿质离子的运输系数SX, Na=库器官(X/Na+)/源器官(X/Na+),SX, Fe=库器官(X/Fe2+-Fe3+)/源器官(X/Fe2+-Fe3+),SX, Ca=库器官(X/Ca2+)/源器官(X/Ca2+),SX, Mg=库器官(X/Mg2+)/源器官(X/Mg2+)。
在Excel 2003统计软件中进行试验数据的整理与作图表,在DPS统计软件中进行单因素方差分析,在0.05水平上进行LSD多重比较。试验数据均为平均值±标准差。
2 结果与分析
2.1 CO2浓度升高对毛竹器官矿质离子浓度的影响
不同CO2浓度条件下,毛竹Na+浓度由大到小的器官顺序均为:竹根>竹枝>竹秆>竹叶,而且竹根极显著地大于其他器官,竹枝极显著地大于竹叶和竹秆。环境背景大气条件下,竹叶、竹秆的Na+浓度无显著差异,但随着CO2浓度的升高,竹秆极显著地大于竹叶。随着CO2浓度的升高,叶片Na+浓度呈下降趋势,T1、T2处理无显著差异,但与CK均有显著差异。而竹枝、竹秆和竹根Na+浓度随CO2浓度升高均呈提高趋势,竹枝和竹秆Na+浓度CK、T2处理差异显著,与T1处理差异均不显著。竹根Na+浓度各处理间均差异显著(图1)。
不同CO2浓度条件下,毛竹Fe2+-Fe3+浓度由大到小的器官顺序均为:竹根>竹叶>竹枝>竹秆,其中,竹根极显著地大于其他器官,竹叶、竹枝无显著差异,均极显著地高于竹秆。随着CO2浓度的升高,各器官Fe2+-Fe3+浓度均呈下降趋势。竹叶、竹枝Fe2+-Fe3+浓度各处理间均无显著差异。竹秆Fe2+-Fe3+浓度CK、T2处理差异显著,T1处理与CK、T2处理差异均不显著。竹根Fe2+-Fe3+浓度T1、T2处理差异不显著,与CK差异均显著(图1)。
不同CO2浓度条件下,毛竹Mg2+浓度由大到小的器官顺序均为:竹叶>竹根>竹枝>竹秆,其中,竹叶极显著地大于其他器官,竹根、竹枝无显著差异,均极显著地高于竹秆。随着CO2浓度的升高,竹叶、竹秆Mg2+浓度呈提高趋势,且T1、T2处理差异不显著,与CK均有显著差异。竹枝Mg2+浓度各处理间均无显著差异。竹根Mg2+浓度也随CO2浓度升高而提高,CK、T2处理间差异显著,与T1处理差异均不显著(图1)。
在CK和T1处理下,毛竹器官Ca2+浓度由大到小的器官顺序均为:竹叶>竹根>竹秆>竹枝,而T2处理下,顺序为:竹叶>竹秆>竹枝>竹根。竹叶Ca2+浓度极显著地大于其他器官。竹枝、竹秆Ca2+浓度无显著差异,CK、T1处理均极显著地低于竹根,而在T2处理均极显著地高于竹根;随着CO2浓度的升高,竹叶Ca2+浓度呈显著升高趋势。竹枝、竹秆Ca2+浓度也均呈升高趋势,其中,竹枝CK、T2处理差异显著,与T1处理均无显著差异,竹秆T1、T2处理无显著差异,与CK均差异显著。竹根Ca2+浓度呈降低趋势,CK、T1处理无显著差异,与T2处理均差异显著(图1)。
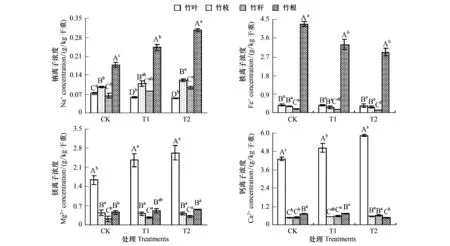
图1 不同CO2浓度条件下毛竹器官矿质离子浓度
2.2 CO2浓度升高对毛竹器官矿质离子浓度比的影响
由表1分析可知,随着CO2浓度的升高,毛竹器官Fe2+-Fe3+/Na+、Mg2+/Na+和Ca2+/Na+在竹叶中逐渐增大,而在其他器官中均逐渐减小。竹叶Fe2+-Fe3+/Na+、Mg2+/Na+和Ca2+/Na+,竹枝Fe2+-Fe3+/Na+、Mg2+/Na+,竹秆Fe2+-Fe3+/Na+、竹根Mg2+/Na+在T1、T2处理间均无显著差异,均与CK差异显著。竹枝Ca2+/Na+和竹秆Mg2+/Na+、Ca2+/Na+各处理间均无显著差异,而竹根Fe2+-Fe3+/Na+、Ca2+/Na+各处理间差异显著。
毛竹竹叶、竹枝、竹秆和竹根Mg2+/Fe2+-Fe3+、Ca2+/Fe2+-Fe3+均随CO2浓度的升高而逐渐增大,但不同器官的影响程度不同。随着CO2浓度的升高,竹叶、竹秆Mg2+/Fe2+-Fe3+、Ca2+/Fe2+-Fe3+均显著增大,而竹根Mg2+/Fe2+-Fe3+、 Ca2+/Fe2+-Fe3+和竹枝Ca2+/Fe2+-Fe3+T1、T2处理均无显著差异,且均与CK差异显著,对竹枝Mg2+/Fe2+-Fe3+无明显影响。
随着CO2浓度的升高,毛竹竹枝Ca2+/Mg2+逐渐增大,而竹叶、竹秆、竹根Ca2+/Mg2+均逐渐减小。竹枝Ca2+/Mg2+各处理间均无显著差异。竹叶Ca2+/ Mg2+T1、T2处理无显著差异,均与CK差异显著。竹秆和竹根Ca2+/ Mg2+均为CK、T2处理差异显著,均与T1处理无显著差异。
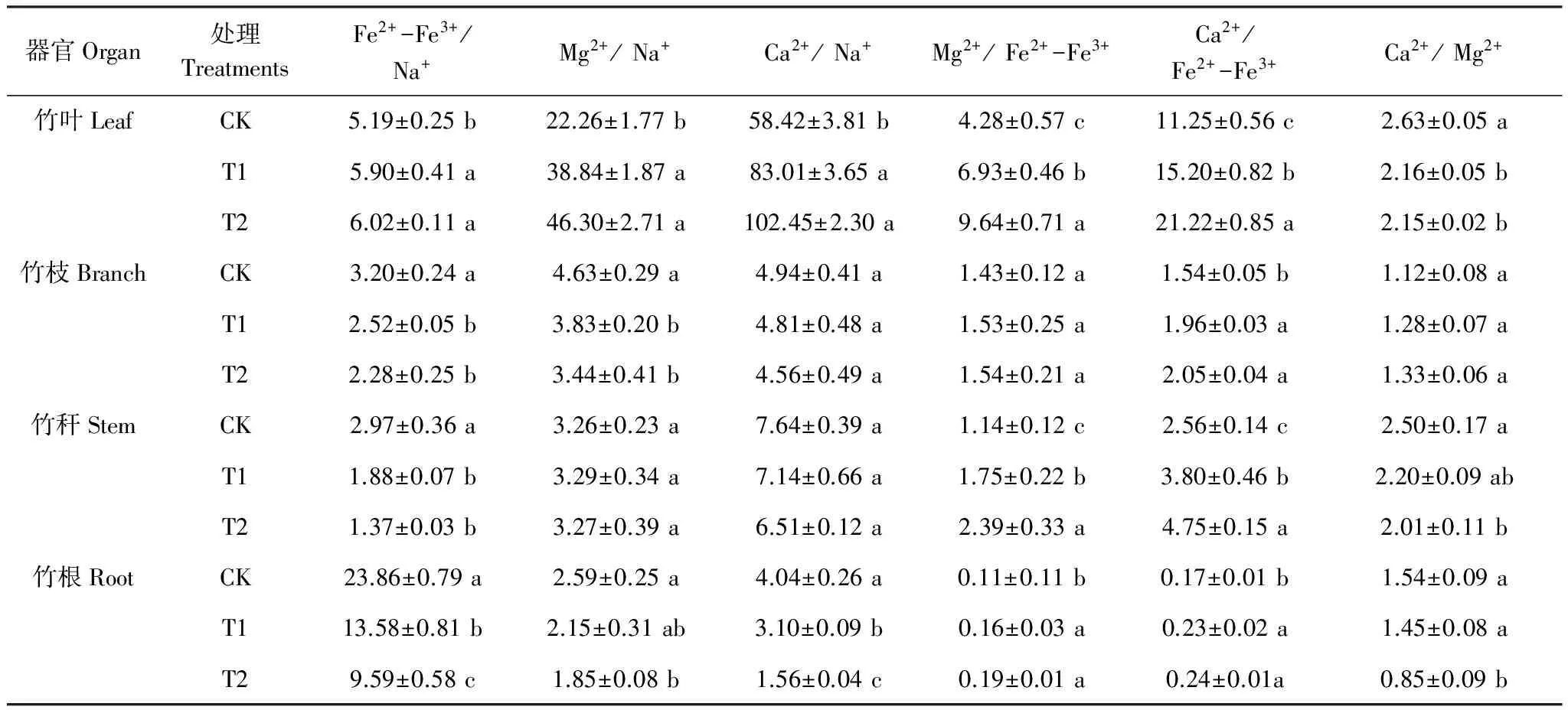
表1 不同CO2浓度条件下毛竹器官矿质离子浓度比值
相同器官不同处理间比较;不同小写字母示差异显著(P<0.05),相同小写字母示差异不显著(P>0.05)
2.3 CO2浓度升高对毛竹器官矿质离子选择性运输能力的影响
SX,Na、SX,Fe、SX,Ca和SX,Mg反映了植物器官中的Na+、Fe2+-Fe3+、Ca2+和 Mg2+的选择性运输能力。由表2可以看出,不同的CO2浓度条件下,竹根-竹秆、竹秆-竹枝SFe,Na、SMg,Na无明显变化,而竹枝-竹叶SFe,Na、SMg,Na在T1、T2处理间虽差异不显著,但较CK均有显著提高,表明CO2浓度升高使竹枝向上运输Fe2+-Fe3+和 Mg2+的能力显著增强。随着CO2浓度的升高,竹根-竹秆SCa,Na呈下降趋势,CK、T2处理差异显著,竹秆-竹枝SCa,Na各处理间无显著变化,而竹枝-竹叶SCa,Na呈显著提高趋势,表明CO2浓度升高使竹根-竹秆运输Ca2+能力下降,而竹枝向上运输Ca2+能力明显提高。竹根-竹秆SMg,Fe随CO2浓度升高变化不明显,而竹秆-竹枝SMg,Fe在T1、T2处理间差异不显著,均显著地低于CK,而竹枝-竹叶SMg,Fe与竹秆-竹枝则呈相反变化规律,表明CO2浓度升高使竹秆-竹枝运输Fe2+-Fe3+能力强于Mg2+,而竹枝-竹叶则相反。竹根-竹秆、竹枝-竹叶SCa,Fe随CO2浓度升高呈提高趋势,尤其T2处理显著高于CK、T1处理,而竹秆-竹枝SCa,Fe无明显变化,说明CO2浓度升高使竹根-竹秆、竹枝-竹叶运输Ca2+能力强于Fe2+-Fe3+。竹根-竹秆、竹秆-竹枝SCa,Mg随CO2浓度升高均呈升高趋势,CK、T2处理差异显著,与T1处理均差异不显著,而竹枝-竹叶SCa,Mg呈下降趋势,竹秆-竹枝、竹枝-竹叶SCa,Mg在T1、T2处理间无显著差异,均与CK差异显著,说明CO2浓度升高使竹根-竹秆、竹秆-竹枝运输Ca2+能力强于 Mg2+,而竹枝-竹叶运输Ca2+能力低于Mg2+。可见,CO2浓度升高显著提高了Fe2+-Fe3+、Mg2+和 Ca2+的向上运输能力,尤其是Mg2+,且Fe2+-Fe3+、Mg2+和 Ca2+在立竹各器官的选择吸收运输能力竹叶显著强于其他器官,即越接近地上生长末端,矿质离子的选择性运输能力就越强,表明竹叶具有较强的离子调节能力,有利于维持细胞内的矿质离子平衡。
3 讨论
植物体内离子的平衡状态反映了植物细胞内环境的稳定程度,是维持细胞内部各种生理活动正常进行的前提。许多逆境往往会改变植物器官中的离子浓度,破坏离子间的动态平衡,从而会影响植物正常的代谢[24-25]。普遍认为,CO2浓度升高会刺激植物的生长,但也有经长期的CO2浓度升高条件下的研究发现,CO2浓度升高会影响植物矿质营养元素的吸收,降低植物器官中的矿质营养元素含量,尤其是叶片会出现养分稀释效应,降低植物的光合速率,表现出对植物生长的抑制作用[26-27]。本研究发现,一方面,CO2浓度升高对毛竹不同器官矿质离子浓度的影响程度存在着差异,其中,对竹叶、竹根的影响最为明显。在竹叶中积累更多的Mg2+和 Ca2+,分析这可能是CO2浓度升高条件下有利于植物光合色素合成,促进光合作用的机制之一。在竹根中积累更多的Na+,有利于对根部起到渗透调节,降低水势,保持植物水分吸收能力,减轻对地上部分代谢活动干扰等作用,而且很可能会减轻其他器官过多的Na+使代谢中的酶形成无活性的蛋白对植物的毒害,提高毛竹的耐盐能力,这方面值得进一步研究。另一方面,毛竹各器官矿质离子浓度随CO2浓度升高呈现不同的变化规律,分析认为可能与试验测定的矿质离子化学性质具有一定的相似性,植物吸收转运过程中之间会产生一定程度的协同或拮抗作用,及细胞容纳金属离子数量(金属配合位点数量)有限等有关[28]。
逆境胁迫会造成植株体内离子毒害和营养元素的吸收困难,使组织器官的离子比例失衡[29-30]。本研究表明,随着CO2浓度的升高,竹叶Mg2+/Na+、Ca2+/Na+和Fe2+-Fe3+/Na+增大,表明CO2浓度升高促进了竹叶对Mg2+、Ca2+和Fe2+-Fe3+的吸收,这对于维持CO2浓度升高条件下叶片中Mg2+、Ca2+和Fe2+-Fe3+的平衡至关重要。分析原因可能是一方面CO2浓度升高促进了毛竹的生长,尤其是竹叶的生长,需要从其他器官吸收更多的矿质营养元素Mg2+、Ca2+和Fe2+-Fe3+向竹叶运输来满足其生长,并且对Mg2+、Ca2+和Fe2+-Fe3+的吸收速率大于植株竹叶碳水化合物的合成速率[18];另一方面可能与CO2浓度升高使土壤水分含量增大[31],微生物活性上升,有机质分解加快,可利用的矿质养分增加等有关[32-33]。而Mg2+/Na+、Ca2+/Na+和Fe2+-Fe3+/Na+在其他器官中则均减小,尤其是竹根中下降尤为显著,表明CO2浓度升高可明显促进除竹叶外的其他器官对Na+的吸收,其中,竹根对Na+的吸收最为明显,这有利于维持细胞渗透平衡和水分吸收,维持离子区域平衡。另外,Mg2+/Fe2+-Fe3+和 Ca2+/ Fe2+-Fe3+各器官中均随CO2浓度的升高而增大,而Ca2+/ Mg2+除在竹枝中稍有增大外,其它器官中均减小。一方面说明CO2浓度升高不同程度地影响了毛竹器官对植物细胞新陈代谢、光合作用等重要生理过程的必需元素Fe2+-Fe3+、Mg2+和Ca2+的吸收、运输和分配;另一方面各器官矿质离子间比值对CO2浓度升高呈现出不同的响应规律,意味着CO2浓度升高改变了毛竹器官矿质离子的竞争格局,可能与矿质营养离子的性质,包括离子半径、电荷数、电子层结构及在植物生长中所起的作用等有关[25,34-35],其中机理有待于进一步研究。
离子选择性运输系数反映了植物不同器官对矿质离子向上运输的选择能力[36]。CO2浓度升高,Fe2+-Fe3+、Mg2+从竹根、竹秆分别向竹秆和竹枝的选择性运输系数略有增大,从竹枝向竹叶的选择性运输系数则显著增大,Ca2+从竹根向竹秆、竹秆向竹枝的选择性运输系数逐渐减小或变化平缓,而竹枝向竹叶的选择性运输系数明显增大。说明CO2浓度升高会使Fe2+-Fe3+、Mg2+、Ca2+从竹枝向竹叶的选择性向上运输能力明显增强,这有利于毛竹的光合作用正常进行。对不同矿质离子的运输能力进行综合比较,竹叶中矿质离子运输能力大小依次为Mg2+>Ca2+>Fe2+-Fe3+。可见,CO2浓度升高会影响毛竹不同器官矿质离子的选择性运输能力,及矿质元素在不同器官中的积累,目的是维持植物体内的矿质离子平衡。
综上所述,CO2浓度升高对毛竹器官矿质离子选择性吸收、运输和分配会产生影响,对竹叶、竹根的影响最为明显,增强了竹叶Mg2+和Ca2+、竹根Na+的积累能力和Fe2+-Fe3+、Ca2+、Mg2+的向上选择性运输能力,提高了光合器官竹叶中矿质养分元素浓度,维持了体内矿质养分元素平衡,有利于提高毛竹对高CO2浓度环境的适应能力。
致谢:感谢杭州临安太湖源观赏竹种园有限公司顾李俭和刘剑对试验材料的日常管理和维护,中国林业科学研究院亚热带林业研究所张建锋研究员对本文写作的帮助。
[1]Carnol M, Hogenboom L, Jach M E, Remacle J, Ceulemans R. Elevated atmospheric CO2in open top chambers increases net nitrification and potential denitrification. Global Change Biology, 2002, 8(6): 590-598.
[2]Ruan Y N, He X Y, Chen W, Xu S, Xu W D. Effects of elevated CO2on lipid peroxidation and activities of antioxidant enzymes inGinkgobiloba. Acta Ecologica Sinica, 2007, 27(3): 1106-1112.
[3]Zhao G Y, Liu J S, Dou J X, Zhou W M, Wang Y, Qin S J. Effects of CO2concentration doubling on physiological characteristics of calamagrostis angustifolia in freshwater marsh. Research of Environmental Science, 2008, 21(5): 134-138.
[4]Ziska L H, Moya T B, Wassmann R, Namuco O S, Lantin R S, Aduna J B, Abao E Jr, Bronson K F, Neue H U, Olszyk D. Long-term growth at elevated carbon dioxide stimulates methane emission in tropical paddy rice. Global Change Biology, 1998, 4(6): 657-665.
[5]Ruan Y N, He X Y, Chen W, Chen Z J, Sun Y. Effects of elevated CO2concentration on anti-oxidative enzyme activities of urbanPinustabulaeformis. Chinese Journal of Ecology, 2009, 28(5): 839-844.
[6]Zhao T H, Wang M Y, Zhang W W, Zhang X. Effects of elevated CO2concentration on plant photosynthesis. Ecology and Environment, 2006, 15(5): 1096-1100.
[7]Jiang Y L, Zhang Q G, Yang S Y, Zhang S D, Wu J. Ecophysiological responses of 28 species of garden plants to atmospheric CO2enrichment. Journal of Plant Resources and Environment, 2006, 15(2): 1-6.
[8]Wang M Y, Zhao T H, Zhang W W, Guo D, He X Y, Fu S L. Effects of elevated CO2concentration on photosynthetic characteristics of two urban forest species in Shenyang city. Chinese Bulletin of Botany, 2007, 24(4): 470-476.
[9]Long S P. Modification of the response of photosynthetic productivity to rising temperature by atmospheric CO2concentrations: Has its importance been underestimated? Plant, Cell and Environment, 1991, 14(8): 729-739.
[10]Donnelly A, Craigon J, Black C R, Colls J J, Landon G. Does elevated CO2ameliorate the impact of O3on chlorophyll content and photosynthesis in potato (Solanumtuberosum)?. Physiologia Plantarum, 2001, 111(4): 501-511.
[11]Manderscheid R, Burkart S, Bramm A, Weigel H J. Effect of CO2enrichment on growth and daily radiation use efficiency of wheat in relation to temperature and growth stage. European Journal of Agronomy, 2003, 19(3): 411-425.
[12]Rao M V, Hale B A, Ormrod D P. Amelioration of zone-induced oxidative damage in wheat plants grown under high carbon dioxide. Plant Physiology, 1995, 109: 421-432.
[13]Yang S T, Li Y F, Hu Y X, Lin J X. Effects of CO2concentration doubling on the leaf morphology and structure of 10 species in gramineae. Acta Botanica Sinica, 1997, 39(9): 859-866.
[14]Jiang G M, Han X G, Lin G H. Response of plant growth to elevated: a review on the chief methods and basic conclusions based on experiments in the external countries in past decade. Acta Phytoecologica Sinica, 1997, 21(6): 489-502.
[15]Chen G Y, Yong Z H, Liao Y, Zhang D Y, Chen Y, Zhang H B, Chen J, Zhu J G, Xu D Q. Photosynthetic acclimation in rice leaves to free-air CO2enrichment related to both ribulose-1, 5-bisphosphate carboxylation limitation and ribulose-1, 5-bisphosphate regeneration limitation. Plant and Cell Physiology, 2005, 46(7): 1036-1045.
[16]Verro E, Bruni R, Bianchi A, di Toppi L S. Elevated atmospheric CO2decreases oxidative stress and increases essential oil yield in leaves ofThymusvulgarisgrown in a mini-FACE system. Environmental and Experimental Botany, 2009, 65(1): 99-106.
[17]Stafford N. The other greenhouse effect. Nature, 2007, 448(7153): 526-528.
[18]Guo J. Response of Main Mineral Bioavailability to Atmospheric CO2Enrichment in Paddy Ecosystem [D]. Nanjing: Nanjing Agricultural University, 2011.
[20]Jiang Z H, Xiao J H, Xu H C. Bamboo and Rattan in the World. Liaoning: Liaoning Technology Press, 2002.
[21]Li P F, Bai W B, Yang Z C. Effects of NaCl stress on ions absorption and transportation and plant growth of tall fescue. Scientia Agricultura Sinica, 2005, 38(7): 1458-1565.
[22]Hunt J. Dilute hydrochloric acid extraction of plant material for routine cation analysis. Communications in Soil Science and Plant Analysis, 1982, 13(1): 49-55.
[23]Pitman M G. Transport across the root and shoot/root interaction // Staples R C, Toennisson G A, eds. Salinity Tolerance in Plants. Milton: Wiley, 1984.
[24]Liu A R, Zhang Y B, Zhang X P, Li B X. Effect of lead pollution on growth, inorganic ion distribution and Pb2+accumulation in Festuca arundinacea. Journal of Nuclear Agricultural Sciences, 2009, 23(1): 128-133.
[25]Yang CH W, Li CH Y, Zhang M L, Liu J, Ju M, Shi D C. pH and ion balance in wheat-wheatgrass under salt-or alkali stress. Chinese Journal of Applied Ecology, 2008, 19(5): 1000-1005.
[26]Reich P B, Hobbie S E, Lee T, Ellsworth D S, West J B, Tilman D, Knops J M H, Naeem S, Trost J. Nitrogen limitation constrains sustainability of ecosystem response to CO2. Nature, 2006, 440(7086): 922-925.
[27]Duval B D, Blankinship J C, Dijkstra P, Hungate B A. CO2effects on plant nutrient concentration depend on plant functional group and available nitrogen: a meta-analysis. Plant Ecology, 2012, 213(3): 505-521.
[28]Worms I, Simon D F, Hassler C S, Wilkinson K J. Bioavailability of trace metals to aquatic microorganisms: importance of chemical, biological and physical processes on biouptake. Biochimie, 2006, 88(11): 1721-1731.
[29]Zhu J K. Regulation of ion homeostasis under salt stress. Current Opinion in Plant Biology, 2003, 6(5): 441-445.
[30]Hao Y B, Liu H L, Ci X K, Dong S T, Zhang J W, Liu P. Effects of arsenic on maize growth, antioxidant system, and ion distribution. Chinese Journal of Applied Ecology, 2010, 21(12): 3183-3190.
[31]Margan J A, Pataki D E, Körner C, Clark H, Del Grosso S J, Grünzweig J M, Knapp A K, Mosier A R, Newton P C D, Niklaus P A, Nippert J B, Nowak R S, Parton W J, Polley H W, Shaw M R. Water relations in grassland and desert ecosystems exposed to elevated atmospheric CO2. Oecologia, 2004, 140(1): 11-25.
[32]Liu J X, Zhang D Q, Zhou G Y, Faivre-Vuillin B, Deng Q, Wang C L. CO2enrichment increases nutrient leaching from model forest ecosystems in subtropical China. Biogeosciences, 2008, 5(6): 1783-1795.
[33]Liu J X, Zhou G Y, Xu Z H, Duan H L, Li Y L, Zhang D Q. Photosynthesis acclimation, leaf nitrogen concentration, and growth of four tree species over 3 years in response to elevated carbon dioxide and nitrogen treatment in subtropical China. Journal of Soils and Sediments, 2011, 11: 1155-1164.
[34]Liu J, Zhao H T, Sheng H J, Xu Y Q, Feng K. Effects of Fe3+on growth and Calcium/Magnesium ions uptakes of three common algae in Taihu lake. Environmental Science and Technology, 2011, 34(1): 59-64.
[35]Yang C L, Duan R J, Li R M, Hu X W, Fu S P, Guo J C. The physiological characteristics of salt-tolerance inSesuviumportulacastrumL. Acta Ecologica Sinica, 2010, 30(17): 4617-4627.
[36]Ning J F, Zheng Q S, Yang S H, Zou X Z, Sun L L, Chen Y. Impact of high salt stress on Apocynum venetum growth and ionic homeostasis. Chinese Journal of Applied Ecology, 2010, 21(2): 325-330.
参考文献:
[2]阮亚男, 何兴元, 陈玮, 徐胜, 徐文铎. CO2浓度倍增对城市银杏 (Ginkgobiloba) 叶片膜脂过氧化与抗氧化酶活性的影响. 生态学报, 2007, 27(3): 1106-1112.
[3]赵光影, 刘景双, 窦晶鑫, 周旺明, 王洋, 秦胜金. CO2浓度倍增对湿地小叶章生理特性的影响. 环境科学研究, 2008, 21(5): 134-138.
[5]阮亚男, 何兴元, 陈玮, 陈振举, 孙雨. CO2浓度倍增对城市油松抗氧化酶活性的影响. 生态学杂志, 2009, 28(5): 839-844.
[6]赵天宏, 王美玉, 张巍巍, 张鑫. 大气CO2浓度升高对植物光合作用的影响. 生态环境, 2006, 15(5): 1096-1100.
[7]蒋跃林, 张庆国, 杨书运, 张仕定, 吴健. 28种园林植物对大气CO2浓度增加的生理生态反应. 植物资源与环境学报, 2006, 15(2): 1-6.
[8]王美玉, 赵天宏, 张巍巍, 郭丹, 何兴元, 付士磊. CO2浓度升高对两种沈阳城市森林树种光合特性的影响. 植物学报, 2007, 24(4): 470-476.
[13]杨松涛, 李彦舫, 胡玉熹, 林金星. CO2浓度倍增对10种禾本科植物叶片形态结构的影响. 植物学报, 1997, 39(9): 859-866.
[14]蒋高明, 韩兴国, 林光辉. 大气CO2浓度升高对植物的直接影响——国外十余年来模拟实验研究主要手段及基本结论. 植物生态学报, 1997, 21(6): 489-502.
[18]郭嘉. 稻田系统主要矿质元素生物有效性对大气CO2浓度升高的响应研究 [D]. 南京: 南京农业大学, 2011.
[20]江泽慧, 萧江华, 许煌灿. 世界竹藤. 沈阳: 辽宁科学技术出版社, 2002.
[21]李品方, 白文波, 杨志成. NaCl胁迫对苇状羊茅离子吸收与运输及其生长的影响. 中国农业科学, 2005, 38(7): 1458-1565.
[24]刘爱荣, 张远兵, 张雪平, 李百学. 铅污染对高羊茅生长、无机离子分布和铅积累量的影响. 核农学报, 2009, 23(1): 128-133.
[25]杨春武, 李长有, 张美丽, 刘杰, 鞠淼, 石德成. 盐、碱胁迫下小冰麦体内的pH及离子平衡. 应用生态学报, 2008, 19(5): 1000-1005.
[30]郝玉波, 刘华琳, 慈晓科, 董树亭, 张吉旺, 刘鹏. 砷对玉米生长、抗氧化系统及离子分布的影响. 应用生态学报, 2010, 21(12): 3183-3190.
[34]刘静, 赵海涛, 盛海君, 徐轶群, 封克. 铁对太湖常见藻类生长及Ca2+、Mg2+离子吸收的影响. 环境科学与技术, 2011, 34(1): 59-64.
[35]杨成龙, 段瑞军, 李瑞梅, 胡新文, 符少萍, 郭建春. 盐生植物海马齿耐盐的生理特性. 应用生态学报, 2010, 30(17): 4617-4627.
[36]宁建凤, 郑青松, 杨少海, 邹献中, 孙丽丽, 陈勇. 高盐胁迫对罗布麻生长及离子平衡的影响. 应用生态学报, 2010, 21(2): 325-330.

