CO2浓度和降水协同作用对短花针茅生长的影响
石耀辉, 周广胜,蒋延玲, 王 慧,许振柱
(1. 中国科学院植物研究所植被与环境变化国家重点实验室,北京 100093;2. 中国科学院研究生院,北京 100049;3. 中国气象科学研究院,北京 100081)
大气CO2浓度已由工业化前约270—280 μmol/mol增加到2009年的387 μmol/mol[1],预计到2050年大气CO2浓度将达到550 μmol/mol左右[2]。大气CO2浓度升高一方面直接对植物光合作用和生长发育产生影响,另一方面,其引起的“温室效应”将诱发全球增暖与降水格局等的改变,间接影响植物光合作用和生长发育[3]。
关于大气CO2浓度升高[4-13]及水分变化[14-20]对植物的影响国内外已经开展了大量研究,但关于CO2和水分交互作用对植物的影响研究仍较少[21-23],制约着植物对全球变化响应的综合理解与预测。关于CO2浓度升高的模拟通常采用700 μmol/mol[7-8]、550 μmol/mol或其它浓度处理[10-13];水分变化的模拟多以土壤持水量为参考[17-23],或以降水量为参考[15-16],主要关注干旱的影响;实验设计的水分梯度少、跨度较小,无法全面理解植物对水分的响应及涝渍对植物的影响[24]。不同植物对CO2浓度升高和水分胁迫的敏感程度不尽相同,即使是生存在相同环境下的植物,它们受到的影响也可能存在较大的差异[6]。
短花针茅(Stipabreviflora) 是亚洲中部暖温型荒漠草原的建群种,在我国主要分布在内蒙古高原南部、阴山山脉以南及黄土高原西部等地区。短花针茅为优等牧草,具有耐干旱、返青早、适口性好等优点[25]。本研究以短花针茅为研究对象,利用开顶式生长箱(OTC)模拟CO2浓度升高和降水量变化协同作用对短花针茅生长特性的影响,探讨短花针茅对气候变化的适应性,为未来气候变化情景下荒漠草原的科学管理与畜牧业生产提供科学依据。
1 实验材料和方法
1.1 实验材料与设计
实验于2011年5月至8月在中国科学院植物研究所进行。短花针茅种子于实验前一年采集于中国科学院植物研究所乌兰察布草地生态研究站(41°43′N,111°52′E,海拔1420—1500 m),经0.5%高锰酸钾溶液消毒8min,用水冲洗后备播。土壤来源于内蒙古锡林浩特草原典型栗钙土。
实验设置3个CO2浓度水平:对照(Control)、450 μmol/mol和550 μmol/mol,每个浓度水平3个重复,共9个开顶式气室(OTC)。以钢瓶装高纯度CO2为气源,利用CO2自动控制系统进行24h监控,每分钟监测1次气室内CO2浓度并补气。对每个CO2浓度水平,以短花针茅种源地内蒙古乌兰察布盟四子王旗6、7、8月的30a(1978—2007)月均降水量为对照设置5个降水量梯度:-30%(W1)、-15%(W2)、对照(W3)、+15%(W4)和+30%(W5),每个气室内相同降水量水平设置两个重复处理。根据塑料盆的尺寸将月均降水量换算为各处理的总浇水量,每3d浇灌1次。短花针茅种源地30年月均降水量及各水分处理的每次浇灌水量见表1。
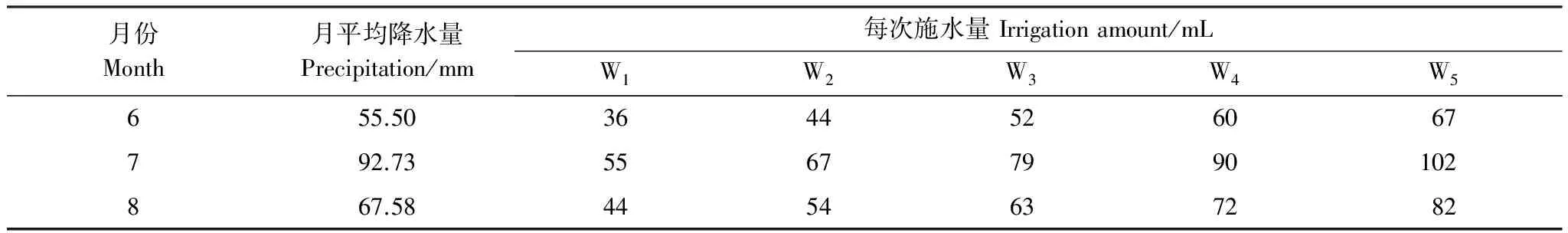
表1 短花针茅种源地30年(1978—2007)月平均降水量及各水分处理施水量表
W3为对照,W1、W2、W4和W5分别代表降水量在对照基础上-30%、-15%、+15%和+30%
在进行CO2浓度和水分控制实验前先进行育苗、间苗及定苗。(1)育苗:4月18日播种,将土壤过筛去除其中的残根、石块后分装入聚乙烯塑料盆中,每盆播种短花针茅种子10粒左右(短花针茅种子发芽率94.4%),浇水100 mL。随后,放入温室育苗(最大光强约1000mol·m-2·s-1,昼夜温度26—28 ℃/18—20 ℃),定期浇水。(2)间苗及定苗:在出苗至第1片叶完全展开后进行间苗,直到幼苗第3片叶完全展开时进行定苗,每盆选取长势较好且一致的幼苗保留4株。
5月23日将90盆实验材料随机转入OTC气室,每个气室10盆。2011年5月31日开始控制实验。开始实验前对每盆样品进行称重、补水以保证初始水分条件一致。控制实验开始后每天检查一次CO2通气状况,经常清洁气室的玻璃内外壁,每3d在16:00后浇水1次,雨天及时扣上防雨罩。晴天于9:00—16:00用遮阳网遮挡强光,用鼓风机不间断向气室内鼓风以防止气室内温度过高,6、7、8月气室内的日均温分别为27.8、27.7 ℃和26.5 ℃。
1.2 观测指标
(1)形态特征及存活率 在7月和8月下旬进行每株株高测定,收获时统计相同处理下植株整体存活率,计数每株叶片数,利用WinFOLIA (Régent Instruments Inc.,Quebec,Canada)植物叶片分析系统测定每株总叶面积。
(2)生物量 采用收获法在9月2日进行测定,测定每盆短花针茅植株的叶、茎、根(经过筛、分拣和冲洗)的生物量(75℃下烘干至恒重后采用感量0.01 g电子天平称量)。
1.3 数据分析
采用统计分析软件SPSS16.0的单因素方差分析和多因素方差分析方法,分析不同CO2浓度和降水量梯度及其协同作用对观测指标影响的显著性。若影响显著,则采用Duncan多重比较分析各处理间的显著性差异,显著性水平为0.05。
2 结果分析
2.1 植株存活率
降水量变化对短花针茅植株存活率影响较大(表2),随着降水量的减少植株存活率下降,降水量减少30%(W1)条件下存活率仅为66.7%,较对照(W3)存活率降低14.6%(表2);CO2浓度升高对植株存活率没有明显影响。
2.2 植株株高
短花针茅生长中期(7月),相同CO2浓度下,随着降水量增多,株高增高,但W4和W5两个处理之间株高差异不显著(表3)。在相同降水量条件下,与对照(Control)相比,550 μmol/molCO2浓度下株高显著增高,在W1—W55个降水量条件下株高分别增高14.4%、33.7%、20%、20.4%和20.3%,但在降水量减少30%(W1)条件下CO2浓度升高引起的株高差异不显著。

表2 CO2浓度升高和降水量变化对短花针茅植株存活率的影响/%

表3 短花针茅植株株高对CO2浓度升高和降水量变化的响应/cm
表中株高数据为平均数±标准误差(n=3—6);不同的小写字母表示在相同CO2浓度下由于降水量变化导致在P<0.05水平上差异显著,*表示在相同降水量水平下CO2浓度升高在P<0.05水平上差异显著
短花针茅生长后期(8月),相同CO2浓度下,与对照(W3)相比,降水量减少(W1,W2)显著降低了短花针茅的株高;降水量增多(W4,W5)一定程度上增加了植株株高,但差异不显著(表3)。在相同降水量条件下,与对照相比,450 μmol/molCO2浓度对株高变化影响不显著,550 μmol/mol CO2浓度下植株株高略有增加但差异不显著。
2.3 叶面积
2.3.1 植株总叶面积
相同CO2浓度下,随着降水量增多,植株总叶面积呈增加趋势,降水量增加15%(W4)后叶面积增加趋势变缓(图1)。相同降水量条件下,随着CO2浓度增加,植株总叶面积有增加趋势。与对照相比,450 μmol/molCO2浓度下的植株总叶面积增加不显著,550 μmol/mol CO2浓度下的植株总叶面积显著增加:W1—W55个降水量条件下分别增加14.5%、20.1%、18.7%、18.3%和13.2%。降水量减少15%条件下,550 μmol/mol CO2浓度与对照CO2浓度相比增加比率最大。CO2浓度升高条件下(550 μmol/mol),降水量增加15%(W4)植株总叶面积最大。

图1 短花针茅植株总叶面积和单叶面积对CO2浓度升高和降水量变化的响应
2.3.2 单叶面积
相同CO2浓度下,降水量变化对短花针茅单叶面积影响显著,随着降水量增加单叶面积逐渐增大,但降水量增多(W4,W5)两个处理之间差异不显著(图1)。相同降水量条件下,与对照CO2浓度相比,短花针茅单叶面积在450 μmol/mol CO2浓度下没有显著变化;在550 μmol/mol CO2浓度下则显著增大,在W1—W55个降水量条件下分别增加5.6%、14%、13.5%、9.4%和8.6%,但降水量减少30%(W1)条件下,CO2浓度为550 μmol/mol与对照 CO2浓度相比差异不显著。CO2浓度升高条件下,降水量增加可以促进短花针茅单叶面积的增大。
2.4 叶数
相同CO2浓度下,随着降水量增加,短花针茅植株叶片数量逐渐增多,降水量增加15%(W4)后增加趋势减缓。与对照(W3)相比,降水量减少尤其是减少30%(W1)时植株叶片数量显著减少,总体减少19.1%。相同降水量条件下,与对照CO2浓度相比,CO2浓度升高短花针茅植株的叶片数量增多,但是变化不显著(图2)。CO2浓度升高的条件下,降水量增加,短花针茅叶片数也增加。
2.5 植株总生物量
相同CO2浓度下,随着降水量增加,短花针茅植株总生物量呈先增后减趋势(图3)。在本实验5个降水量处理水平下,降水量增加15%(W4)短花针茅生物量达到最大值,降水量增加30%(W5)短花针茅植株总生物量较降水量增加15%(W4)有所减少,但W4和W5两种降水量处理差异不显著。相同降水量条件下,随着CO2浓度增加,短花针茅植株总生物量呈增加趋势。与对照CO2浓度相比,在450 μmol/mol CO2浓度下有所增加但差异不显著;而在CO2浓度为550 μmol/mol时除降水量减少30%(W1)增加不显著外,其它降水量水平下生物量显著增加。CO2浓度升高条件下,降水量增加可以明显提高短花针茅植株总生物量。
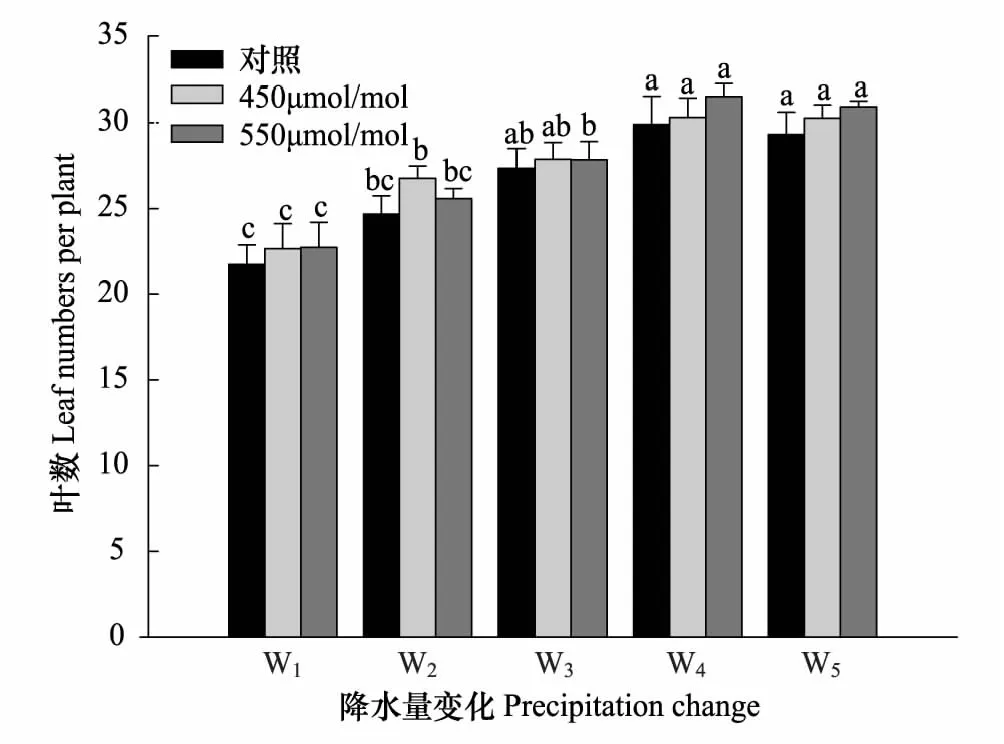
图2 短花针茅植株叶数对CO2浓度升高和降水量变化的响应

图3 短花针茅植株总生物量(g)对CO2浓度升高和降水量变化的响应
2.6 生长指标多因素方差分析

表4 不同CO2浓度和降水量变化下短花针茅生长指标的多因素方差分析
3 讨论
本研究表明,降水量变化对短花针茅植株的存活率有较大影响,而CO2浓度升高对其存活率的影响不明显。因此,水分是影响干旱半干旱地区短花针茅植株存活的关键因子,与已有研究结果一致[14]。
研究表明,CO2浓度升高促进植物株高、叶面积和生物量的增加[26-30];对植株叶数的影响则不一致,或促进植株叶数增加[14],或无明显变化[27]。本研究显示,CO2浓度升高对短花针茅株高的影响在不同生长期表现不同,高CO2浓度(550 μmol/mol)使得生长中期(7月)短花针茅的株高显著增加,生长后期(8月)株高虽有增加,但差异不显著。短花针茅植株总叶面积和单叶面积在550 μmol/mol CO2浓度下较对照CO2浓度显著增加,叶片数目受CO2浓度升高影响不显著。因此,高浓度CO2(550 μmol/mol)对短花针茅植株总叶面积的正效应主要通过增加单叶面积实现。研究表明,前期叶片细胞增大和后期叶片细胞数目增多是单叶叶面积增加的直接原因[28],其机制在于CO2浓度增加促进了细胞增殖、细胞增长等基因表达,从而增加了单叶面积[29]。高CO2浓度(550 μmol/mol)显著增加了短花针茅植株的生物量,CO2是植物光合作用的底物,CO2浓度升高的“施肥效应”将增加光合速率,进而促使植株总生物量增加[7]。
水分是影响植物生长发育的重要环境因子,水分过少将对植物造成旱害,过多则造成涝害[24]。降水量变化对短花针茅株高的影响在不同生长期不同,降水量增加使得生长中期(7月)短花针茅的株高显著增加;生长后期(8月),与对照(W3)相比降水量减少(W1, W2)导致短花针茅株高显著降低,降水增多(W4, W5)对短花针茅株高影响不显著。在一定降水量变化范围内短花针茅植株总叶面积、单叶面积、叶数和生物量随降水量增加而增加。但在降水量增加超过15%后增加趋势变缓,降水量增加15%(W4)与增加30%(W5)两种处理对生长指标影响并不显著,降水量增加30%(W5)生物量甚至有降低趋势,可能此时已产生涝渍胁迫。干旱胁迫下单叶面积减少和叶数的降低将造成植株总叶面积减小,说明植株在受到水分胁迫时通过减小蒸腾面积减少水分损失来维持植株体内水分平衡,反映了植物对干旱胁迫的适应机制[14]。
一般而言,CO2浓度升高具有“施肥效应”,水分减少对植物的影响则为负效应,高CO2浓度下发生土壤干旱胁迫时,CO2施肥效应受到一定程度的抑制[31]。但也有研究表明,高CO2浓度下玉米和高粱的产量增幅干旱条件明显大于湿润条件[13]。本研究表明,在W2—W5四个降水量水平条件下,高浓度CO2(550 μmol/mol)显著增加了短花针茅植株总叶面积、单叶面积和生物量,在降水量减少15%(W2)条件下增加幅度最大;CO2浓度升高与降水量变化对短花针茅植株生物量有较强的交互作用。CO2浓度的升高在一定程度上可以缓解干旱胁迫对植株的影响[6],但降水量减少30%(W1)则抑制了CO2浓度升高的效应。本研究还表明,CO2浓度升高也将缓解涝渍胁迫(W5),这可能是由于CO2浓度升高增加了植物叶面积导致蒸腾作用增强,进而起到缓解水分涝渍胁迫的效果。
4 结论
利用开顶式生长箱(OTC)模拟CO2浓度升高和降水量变化协同作用对荒漠草原优势物种短花针茅的影响表明:降水量变化显著影响短花针茅的生长特性。降水量减少30%将严重影响短花针茅植株的存活率、株高、叶面积、生物量等,而降水量增加15%与30%对短花针茅存活影响不显著,对生物量、叶数等影响显著,但降水量增加30%已对短花针茅产生轻微的涝渍胁迫。CO2浓度升高对降水量减少30%条件下的短花针茅影响不显著,但对其它降水量水平下短花针茅的生物量、叶面积等影响显著,可能是降水量严重减少限制了CO2浓度升高对短花针茅产生的施肥效应;同时CO2浓度升高会对轻度干旱和涝渍产生缓解作用。这为阐明干旱和干旱区生态系统优势植物对全球变化的响应和适应机理,分析其脆弱性提供了实验支持。
致谢:感谢孙敬松、孙晓红、张彦敏、刘涛、吕晓敏、侯彦会、宋健等对实验给予的帮助。
[1]Mauri A. Field experiments using CO2enrichment: a comparison of two main methods. Iforest: Biogeosciences and Forestry, 2010, 3(1): 109-112.
[2]IPCC. Climate change 2007: synthesis report // Core Writing Team, Pachauri R K, Reisinger A, eds. Contribution of Working Groups I, II and III to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Geneva, Switzerland: IPCC, 2007.
[3]Zhao M, Wang X W, Mao Z J. The effect of CO2concentration and temperature on chlorophyll content ofQuercusmongolicaFisch. under different nitrogen levels. Bulletin of Botanical Research, 2006, 26(3): 337-341.
[4]Niu Y F, Zong X B, Du S T, Huang L D, Zhang Y S. Effect of elevated CO2on morphology change of plant roots and its regulatory mechanism. Plant Nutrition and Fertilizer Science, 2011, 17(1): 240-246.
[5]Baldocchi D. Global change: the grass response. Nature, 2011, 476(7359): 160-161.
[6]Yin F H, Li X L, Dong Y S, Xie Z M, Gao Z J, He S, Liu C Y. Effect of elevated CO2on ecosystem and C-N coupling in arid and semi-arid region. Advances in Earth Science, 2011, 26(2): 235-244.
[7]Ge Y, Jie D M, Guo J X, Liu H M, Shi L X. Response of phytoliths inLeymuschinensisto the simulation of elevated global CO2concentrations in Songnen grassland. Chinese Science Bulletin, 2010, 55(32): 3703-3708.
[8]Hou Y, Yang H C, Wang K Y. Responses of morphological structure and competition capability of dominant plant species in subalpine timberline to elevated atmospheric CO2concentration and air temperature. Chinese Journal of Ecology, 2011, 30(11): 2413-2420.
[9]Morgan J A, LeCain D R, Pendall E, Blumenthal D M, Kimball B A, Carrillo Y, Williams D G, Heisler-White J, Dijkstra F A, West M. C4grasses prosper as carbon dioxide eliminates desiccation in warmed semi-arid grassland. Nature, 2011, 476(7359): 202-205.
[10]Zheng Y R, Xie Z X, Rimmington G M, Yu Y J, Gao Y, Zhou G S, An P, Li X J, Tsuji W, Shimizu H. Elevated CO2accelerates net assimilation rate and enhance growth of dominant shrub species in a sand dune in central Inner Mongolia. Environmental and Experimental Botany, 2010, 68(1): 31-36.
[11]Hikosaka K, Onoda Y, Kinugasa T, Nagashima H, Anten N P R, Hirose T. Plant responses to elevated CO2concentration at different scales leaf, whole plant, canopy, and population. Ecological Research, 2005, 20(3): 243-253.
[12]Ainsworth E A, Long S P. What have we learned from 15 years of free-air CO2enrichment (FACE)? A meta-analytic review of the responses of photosynthesis, canopy properties and plant production to rising CO2. New Phytologist, 2005, 165(2): 351-372.
[13]Wang Y X, Yang L X, Manderscheid R, Wang Y L. Progresses of free-air CO2enrichment (FACE) researches on C4crops: a review. Acta Ecologica Sinica, 2011, 31(5): 1450-1459.
[14]Li Y H, Lu Q, Wu B, Zhu Y J, Liu D J, Zhang J X, Jin Z H. A review of leaf morphology plasticity linked to plant response and adaptation characteristics in arid ecosystems. Chinese Journal of Plant Ecology, 2012, 36(1): 88-98.
[15]Jia M Q, Gao Y B, Yang Y. Leaf traits ofStipakryloviiRoshev. and S. grandis P. Smirn. in middle and eastern Inner Mongolia steppe. Journal of Tianjin Normal University: Natural Science Edition, 2010, 30(1): 57-63.
[16]Tian Q, Cao Z Z, Wang G H. Response of leaf traits of 14 plant species in typical steppe to water gradient in Inner Mongolia. Grassland and Turf, 2008, (5): 23-26.
[17]Huang J Y, Yuan Z Y, Li L H. Changes in N, P and specific leaf area of green leaves ofLeymusChinensisalong nitrogen, phosphorus and water gradients. Chinese Journal of Plant Ecology, 2009, 33(3): 442-448.
[18]Wang K, Yang J, Chen J K. Comparison of morphological traits between alligator weed and two congeners under different water and nutrient conditions. Biodiversity Science, 2010, 18(6): 615-621.
[19]Yu Q S, Zhao M, Li C L, Li A D. Growth and biomass allocation ofChilopsislinearisunder different soil water stresses. Chinese Journal of Ecology, 2006, 25(1): 7-12.
[20]Dai L M, Li Q R, Wang M, Ji L Z. Responses of the seedlings of five dominant tree species in Changbai Mountain to soil water stress. Journal of Forestry Research, 2003, 14(3): 191-196.
[21]Kang S Z, Zhang F C, Hu X T, Zhang J H. Benefits of CO2enrichment on crop plants are modified by soil water status. Plant and Soil, 2002, 238(1): 69-77.
[22]Xu Z Z, Zhou G S, Xiao C W, Wang Y H. Responses of two dominated desert shrubs to soil drought under doubled CO2condition. Acta Ecologica Sinica, 2004, 24(10): 2186-2191.
[23]Guo J P, Gao S H. Impacts of CO2Enrichment and soil drought on C, N accumulation and distribution in stipa baicalensis. Journal of Soil and Water Conservation, 2005, 19(2): 118-121.
[24]Jiao J Y, Chen K, Yin C Y. Effects of soil moisture content on growth, physiological and biochemical characteristics ofJatrophacurcasL. Acta Ecologica Sinica, 2010, 30(16): 4460-4466.
[25]Du L X, Li Q F. Effects of grazing on reproductive characteristics of stipa brevif lora in Desert Steppe. Journal of Shanxi agricultural university: Natural Science Edition, 2008, 28(1): 4-6.
[26]Zhang P, Zhang W H, Miao X L, Li H, Liu L L, Zhang W W. Effects of Doubled CO2Concentration on Growth and Photosynthesis of Soybean. Soybean science, 2010, 29(1): 64-67.
[27]Driscoll S P, Prins A, Olmos E, Kunert K J, Foyer C H. Specification of adaxial and abaxial stomata, epidermal structure and photosynthesis to CO2enrichment in maize leaves. Journal of Experimental Botany, 2006, 57(2): 381-390.
[28]Chen G Y. Advances in the study on response and acclimation of plants to free-air CO2enrichment (FACE). Journal of Plant Physiology and Molecular Biology, 2003, 29(6): 479-486.
[29]Ainsworth E A, Rogers A, Vodkin L O, Walter A, Schurr U. The effects of elevated CO2concentration on soybean gene expression. An analysis of growing and mature leaves. Plant Physiology, 2006, 142(1): 135-147.
[30]Kang H. Study on effect of increasing CO2concentration of environment on plant growth. Auhui Agricultural Science Bulletin, 2008, 14(22): 42-45.
[31]Wang M Y, Hao T H, Zhang W W, Shi Y. Effects of interactions between elevated CO2concentration and temperature, drought on physio-ecological processes of plants. Agricultural Research in the Arid Areas, 2007, 25(2): 99-103.
参考文献:
[3]赵甍, 王秀伟, 毛子军. 不同氮素浓度下CO2浓度、温度对蒙古栎 (Quercusmongolica) 幼苗叶绿素含量的影响. 植物研究, 2006, 26(3): 337-341.
通过上述四个环节完成有关堆码基础知识的学习,同学们对本次内容的基本理论知识有了基本理解,这只是对内容的初步掌握。在基本理论知识的基础上还要完成货物堆码的实践操作,才能说明对本次内容的掌握。在实训室的现场,要根据货物选择货位和堆码方式及工具,小组成员之间相互配合完成堆码作业,再总结堆码作业的注意事项和要求,到此整个堆码作业教学才算完成。
[4]牛耀芳, 宗晓波, 都韶婷, 黄利东, 章永松. 大气CO2浓度升高对植物根系形态的影响及其调控机理. 植物营养与肥料学报, 2011, 17(1): 240-246.
[6]尹飞虎, 李晓兰, 董云社, 谢宗铭, 高志建, 何帅, 刘长勇. 干旱半干旱区CO2浓度升高对生态系统的影响及碳氮耦合研究进展. 地球科学进展, 2011, 26(2): 235-244.
[7]葛勇, 介冬梅, 郭继勋, 刘红梅, 石连旋. 松嫩草原羊草植硅体对模拟全球CO2浓度升高的响应研究. 科学通报, 2010, 55(27/28): 2735-2741.
[8]侯颖, 杨红超, 王开运. 亚高山林线优势种形态结构和竞争力对CO2浓度和温度升高的响应. 生态学杂志, 2011, 30(11): 2413-2420.
[13]王云霞, 杨连新, Manderscheid R, 王余龙. C4作物FACE (free-air CO2enrichment) 研究进展. 生态学报, 2011, 31(5): 1450-1459.
[14]李永华, 卢琦, 吴波, 朱雅娟, 刘殿君, 张金鑫, 靳占虎. 干旱区叶片形态特征与植物响应和适应的关系. 植物生态学报, 2012, 36(1): 88-98.
[15]贾美清, 高玉葆, 杨勇. 内蒙古中东部草原克氏针茅和大针茅的叶性分析. 天津师范大学学报: 自然科学版, 2010, 30(1): 57-63.
[16]田青, 曹致中, 王国宏. 内蒙古多伦典型草原14种植物比叶面积对水分梯度变化的响应. 草原与草坪, 2008, (5): 23-26.
[17]黄菊莹, 袁志友, 李凌浩. 羊草绿叶氮、磷浓度和比叶面积沿氮、磷和水分梯度的变化. 植物生态学报, 2009, 33(3): 442-448.
[18]王坤, 杨继, 陈家宽. 不同土壤水分和养分条件下喜旱莲子草与同属种生长状况的比较研究. 生物多样性, 2010, 18(6): 615-621.
[19]尉秋实, 赵明, 李昌龙, 李爱德. 不同土壤水分胁迫下沙漠葳的生长及生物量的分配特征. 生态学杂志, 2006, 25(1): 7-12.
[22]许振柱, 周广胜, 肖春旺, 王玉辉. CO2浓度倍增条件下土壤干旱对两种沙生灌木碳氮含量及其适应性的影响. 生态学报, 2004, 24(10): 2186-2191.
[23]郭建平, 高素华. 高CO2浓度和土壤干旱对贝加尔针茅C, N积累和分配的影响. 水土保持学报, 2005, 19(2): 118-121.
[24]焦娟玉, 陈珂, 尹春英. 土壤含水量对麻疯树幼苗生长及其生理生化特征的影响. 生态学报, 2010, 30(16): 4460-4466.
[25]杜利霞, 李青丰. 放牧对荒漠草原短花针茅繁殖特性的影响. 山西农业大学学报: 自然科学版, 2008, 28(1): 4-6.
[26]张朋, 张文会, 苗秀莲, 李会, 刘丽丽, 张雯雯. CO2浓度倍增对大豆生长及光合作用的影响. 大豆科学, 2010, 29(1): 64-67.
[28]陈根云. 植物对开放式CO2浓度增高 (FACE) 的响应与适应研究进展. 植物生理与分子生物学学报, 2003, 29(6): 479-486.
[30]康辉. 环境CO2浓度升高对植物的影响研究. 安徽农学通报, 2008, 14(22): 42-45.
[31]王美玉, 赵天宏, 张巍巍, 史奕. CO2浓度升高与温度、干旱相互作用对植物生理生态过程的影响. 干旱地区农业研究, 2007, 25(2): 99-103.

