回顾性研究422例抗肿瘤类药物不良反应报告
钱锦,闫鹏,张凯 (南京大学医学院附属鼓楼医院,江苏南京210008)
抗肿瘤药具有不同程度的不良反应,不仅影响治疗效果和生活质量,严重时甚至危及患者生命[1]。本文通过对本院2011年发现并上报的422例抗肿瘤药ADR 报告进行回顾性研究,以分析抗肿瘤药ADR 特点、规律,加强临床医师在安全用药及ADR 监测中的作用,做到及早预防正确处理,进一步提高临床合理用药水平,减少肿瘤患者ADR 发生。
1 资料与方法
1.1 资料来源 收集我院2011年1月1日-2011年12月31日上报全国药品不良反应监测网数据库的422例抗肿瘤药ADR 报告。
1.2 方法 对422例抗肿瘤药ADR 报告按患者基本情况、抗肿瘤药种类及构成比、ADR 类型所累及系统-器官及临床表现、ADR 的报告情况、报告人对国内外ADR 了解状况、转归、预防和处理状况运用Excel统计分析,所得数据采用STATA10.0分析处理,计数资料采用χ2检验,P<0.05为差异有显著性统计学意义。
2 结果
2.1 患者基本情况 性别与年龄分布:422 例抗肿瘤药ADR 报告中,男性244例(57.82%),女性178例(42.18%);年龄为0~88岁,中年50~59岁患者构成比为35.78%,见表1。
2.2 ADR 涉及的抗肿瘤药种类及构成比 对422例ADR报告所用抗肿瘤药依据《新编药物学》第16版进行分类统计为6类43种,具体见表2。
2.3 引起ADR 最多的前10位药物 见表3。
2.4 抗肿瘤药ADR 类型 422例抗肿瘤药ADR 类型在此讨论累及系统-器官及临床表现,具体见表4。
2.5 铂类ADR 情况 铂类抗肿瘤药有奥沙利铂、顺铂、卡铂3种共92例,具体见表5。
2.6 不同职业ADR 报告情况 见表6。
2.7 ADR 级别分布与转归 依据2011 年《药品不良反应报告和监测管理办法》(卫生部令第81号)的规定,严重药物不良反应指因使用药品引起以下损害情形之一的反应:导致死亡;危及生命;致癌、致畸、致出生缺陷;导致显著的或者永久的人体伤残或者器官功能的损伤;导致住院或者住院时间延长;导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。新的药物不良反应指药品说明书中未载明的不良反应,说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。本文严重药物不良反应和新的药物不良反应判定标准均按卫生部令第81号执行,具体见表7。
3 讨论
3.1 性别与年龄分布 由表1可见男性多于女性;年龄为0~88岁,其中50~59岁患者构成比为35.78%。很明显高于其他年龄段,为肿瘤高发年龄和ADR 高发年龄,这与其他文献报道一致:多集中于41~60岁的中年人,这个年龄段也是肿瘤的高发阶段,中位年龄在54 岁[1]。60~69岁患者69例占16.35%,10~19岁患者58例占13.74%,肿瘤ADR 也较高发。近年来恶性肿瘤有年轻化趋势,所以对青壮年恶性肿瘤患者的ADR,尤其严重ADR 监测工作应予以高度关注。此外,50岁以上ADR 发生人数251例占59.48%,所以临床医师在给中老年患者选用抗肿瘤药时,要考虑到中老年患者的各脏器功能进行性衰退,对于药物吸收、分布、代谢和排泄的功能减低,尤其是对化疗药的耐受程度降低,也是老年患者ADR 发生率显著增加的原因之一[2]。要注意个性化给药,包括药物剂量能否适当减少。

表1 抗肿瘤药ADR 年龄、性别、构成比表(例)Tab 1 Age,gender and constituent ratio of ADR of antineoplastic drugs(case)

表2 抗肿瘤药种类及构成比Tab 2 Category and constituent ratio of antineoplastic drugs

表3 引起ADR 最多的前10位药物Tab 3 Top 10 drugs causing ADR

表4 抗肿瘤药ADR 累及系统-器官及临床表现Tab 4 The system-organ and clinical manifastation involving in the adverse drug reactions of antineoplastic drugs

表5 3种铂类抗肿瘤药ADR 情况表Tab 5 ADR of the three platinum antineoplastic
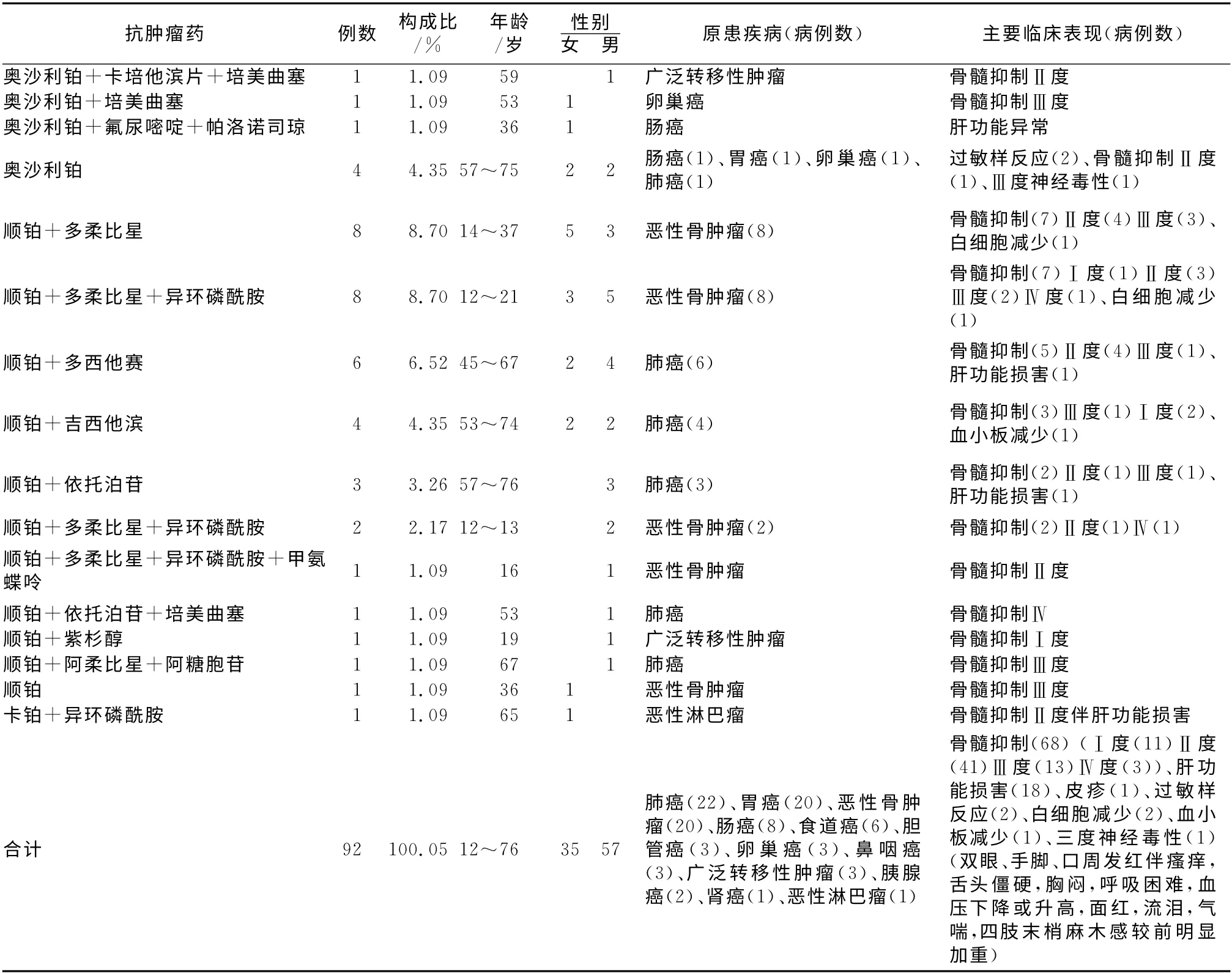
续表5 3种铂类抗肿瘤药ADR 情况表Tab 5 ADR of the three Platinum antineoplastic

表6 不同职业ADR 报告情况表Tab 6 ADR reports of different occupations
3.2 ADR 涉及的抗肿瘤药 由表2可见6类43种药物所致ADR 中,其他抗肿瘤药及辅助治疗药118例占27.96%位于第一,其他依次为抗代谢药108例占25.83%、植物来源的抗肿瘤药及其衍生物83例占19.67%等,具体引发ADR 最多的前10位药物见表3。另有4例女性患者因紫杉醇3例、多西他赛1例发生过敏性休克,经对症处理转危为安,3例好转、1例痊愈。挪威的研究显示,在住院的癌症死亡患者中,约有4%的患者是由于严重的不良药物相互作用所致,而对于非住院癌症患者,目前尚无相关的流行病学研究[3]。大多数肿瘤患者并非使用单一化疗药,而是联合用药或病情需要还使用其他药物。但很少研究、探讨肿瘤患者所用所有药物之间的相互作用,尤其是不良反应、拮抗作用,给患者造成的伤害。因此,临床医师在选用抗肿瘤药时,要充分考虑多种抗肿瘤药相互作用及与其他药物相互作用所致的ADR,尤其严重ADR 给患者造成的痛苦,这点应引起医务人员高度重视。
3.3 ADR 累及系统-器官 422例抗肿瘤药ADR 主要累及系统器官是血液系统、消化系统,共计503 例次占90.46%(同一ADR 可累及多个系统-器官),其中血液系统ADR 最高近60%,临床以骨髓抑制最为常见。根据WHO 骨髓抑制程度分为0~Ⅳ级,0级:白细胞≥4.0×109个/L,粒细胞≥2.0×109个/L,血红蛋白≥110 g·L-1,血小板≥100×109个/L,Ⅰ级:白细胞(3.0~3.9)×109个/L,粒细胞(1.9~1.5)×109个/L,血红蛋白95~100 g·L-1,血小板(75~99)×109个/L;Ⅱ级:白细胞(2.0~2.9)×109个/L,粒细胞(1.4~1.0)×109个/L,血红蛋白80~94 g·L-1,血小板(50~74)×109个/L;Ⅲ级:白细胞(1.0~1.9)×109个/L,粒细胞(0.9~0.5)×109个/L,血红蛋白65~79 g·L-1,血小板(25~4)×109个/L;Ⅳ级:白细胞(0~1.0)×109个/L,粒细胞<0.5×109个/L,血红蛋白<65 g·L-1,血小板<25×109个/L。也有ADR 表现为白细胞减少或中性粒细胞减少或血小板减少。其次消化系统ADR 以肝功能异常、药源性肝炎最为常见。这是因为化疗药物针对的是生长活跃的细胞,除恶性肿瘤细胞外,骨髓造血干细胞、消化道黏膜、皮肤及其附属器等器官或组织的细胞更新亦较快,因此相应的组织器官更易受化疗药物影响,临床医务人员可根据这一特点,在治疗过程中重点监测患者相关的不良反应。此外要严密监护化疗时的过敏反应,若出现面部潮红、胸闷、心慌、呼吸困难、血压下降、大汗淋漓等休克表现,应立即停药对症处理。另由表4、表5可见不良反应多以实验室检查、生化等定性、定量的客观指标在ADR 报告中报告为主,以临床症状为辅,这说明我院不良反应更注重主动监测客观指标,以便及早发现,及早处理。
3.4 铂类抗肿瘤药讨论 由表5可见铂类抗肿瘤药ADR奥沙利铂55例、顺铂36例、卡铂1例共92例。奥沙利铂作为第3代铂类广谱抗癌药,其临床疗效和安全性均优于顺铂和卡铂,顺铂和卡铂主要用于治疗睾丸癌、卵巢癌、头颈部癌和宫颈癌等,奥沙利铂对卵巢癌、淋巴瘤、非小细胞肺癌、头颈部肿瘤也有比较好的疗效。统计发现奥沙利铂ADR 所占比例最高,这与其在临床的广泛使用有关。表5中除奥沙利铂4例、顺铂1例为单独用药外,其余均为联合用药。92例不良反应中骨髓抑制68例(Ⅰ度11例、Ⅱ度41例、Ⅲ度13例、Ⅳ度3例),其次为肝功能损害18例,这与铂类化疗药的不良反应特点基本相符,但有报道显示铂类药物的主要不良反应为神经毒性,本次统计发现Ⅲ度神经毒性1例,提示临床医护人员在药物治疗的监护期间除了关注患者的实验室检查数据变化,还应多关注患者的症状、体征变化和主诉。
奥沙利铂+其他抗肿瘤药主要用于胃肠道肿瘤,其中奥沙利铂+氟尿嘧啶或再+其他抗肿瘤药治疗组有28例占使用奥沙利铂的50.91%,男性20 例占71.43%,女性8 例占28.57%,原发病为胃癌17例(还有3 例用其他治疗方案)、肠癌6例、食管癌2例、鼻咽癌3例,ADR 的主要临床表现为骨髓抑制Ⅱ度17例占该治疗组60.71%,肝功能异常8例占该治疗组28.57%,说明胃肠道肿瘤男性占比近3/4,ADR 大多数为骨髓Ⅱ度抑制。
顺铂+多柔比星或再+其他抗肿瘤药治疗组治疗恶性骨肿瘤19例(还有一例单独使用顺铂未计入)占使用顺铂的5 2.78%,性别无差异,在此特别强调患者年龄绝大多为12~20岁的青少年,ADR 临床表现均为血液系统损害,临床表现:骨髓抑制Ⅰ度1例、Ⅱ度10例、Ⅲ度4例、Ⅳ度1例,白细胞减少3 例,即Ⅱ度以上15 例,临床治疗又多以截肢为主,可见恶性骨肿瘤对青少年造成巨大伤害。医务工作者要研究青少年恶性骨肿瘤发病机制、预防措施,同时提高青少年自我保护等健康意识。表5还可见原发病为肺癌22例为铂类ADR 中肿瘤最多病种,患者年龄为45~76的中老年,男性16例占72.73%,女性6例占27.27%,说明肺癌以男性中老年为主。
由于铂类药物治疗癌症的机制为阻止细胞DNA 复制,目前在胃癌、肺癌、恶性骨肿瘤等恶性肿瘤化疗方案中仍具有一定不可替代性[4],医务工作者必须在提高肿瘤患者生存率和生存质量两者间取得共赢,目前可做的工作如下:(1)严格掌握铂类药物使用指征,不过度医疗,使患者充分认识到化疗作为一种治疗方式的局限性,不迷信化疗,严格按临床指南和指征制订化疗方案[5]。(2)重视铂类药物的使用时机,多项临床试验表明新辅助化疗使用顺铂能降低肿瘤等级,但不增加术后并发症的风险,改善患者的预后[6-10]。(3)坚持个体化医疗的方向,坚持多种手段联合抗癌。对于70%以上非小细胞肺癌EGFR 基因突变的患者,使用EGFR 酪氨酸激酶抑制剂能够大幅提高患者的生存率和生活质量,个体化基因用药在其中起到了关键性的作用[11]。在化疗方案制订的同时还应该兼顾例如放疗,营养等方方面面的临床细节,合理利用临床资源[4]。
3.5 不同职业ADR 报告分析 医疗单位ADR 监测小组成员主要由医师、护士、药师组成并负责填写ADR 报告。由表6可见422例ADR 医师报告82例、护士报告120例、药师报告220例,对国内外有无类似不良反应了解可反映不同职业对其药物特性、ADR 方面知识、重视程度、英文水平等情况。依据国家ADR 监测中心对国内、外有无类似不良反应填写规定为:有、无、不详3种,我们把有、无视为明确回答,医师明确回答国内外数是40例占48.78%、21例占25.61%;护士是77 例 占64.17%、15 例 占12.50%;药 师 是164 例 占74.55%、115例占52.27%。医师与护士、护士与药师、药师与医师对国内外有无类似不良反应的χ2值分别是4.731 5国内和5.716 4国外、4.052 5国内和52.010 5国外、18.090 3国内和17.155 9国外,P 值均<0.05,有统计学意义。说明护士比医师ADR 报告数多,对国内明确回答率64.17%比医师48.78%高,但医师平均学历高于护士,英文水平高于护士,对国外明确回答率25.61%比护士12.50%高。药师ADR 报告数220例高于护士、医师,对国内明确回答率74.55%也比护士、医师64.17%、48.78%高,对国外明确回答率52.27%也高于护士、医师。药师ADR 监测员均为本科以上学历,ADR 又是其本专业知识,故药师做得更好,医师有待提高。3.6 ADR 级别分布与转归 由表7的统计结果显示,与一般药物不良反应不同,肿瘤药物新的严重、严重ADR 占比较高,共350(82.94%)。由于肿瘤细胞与正常组织细胞间缺少根本性的代谢差异,化疗中使用的多数抗肿瘤药在抑制或杀伤肿瘤细胞的同时,对机体的某些正常细胞、组织和器官也造成不同程度损害,尤其是造血、皮肤黏膜等细胞更替较快的系统。同时,表7中各类药物的构成比基本与表2一致。422例ADR 好转365 例占86.49%,治愈57 例占13.51%。无一例死亡。
总之,恶性肿瘤目前占人类各种死因的第1、2 位,每年全世界约有700 万人死于癌症[2],并且有上升现象,抗肿瘤药应用显得尤为重要。作为临床医护人员要做好循证医学,给患者用药时要研究多种药物之间的相互作用,应高度重视抗肿瘤药相互作用的潜在危险,加强抗肿瘤药致ADR 的监测工作[12-13],对新的和严重ADR 要及时发现、及时预警,避免严重ADR 重复发生,做好抗肿瘤药ADR 预防和处理工作,提高医师药物选择合理性,加强患者用药依从性及安全性,实现个体化用药,减少ADR 发生。
[1] 章娟,吴洪斌,翟青.222例抗肿瘤药致不良反应报告分析[J].中国医院用药评价与分析,2011,11(10):937-940.
[2] 刘广宣,赵茜.抗肿瘤药物11030例处方分析[J].中国医院药学杂志,2011,31(1):72-73.
[3] 刘琳琳,孙言才,姜玲,等.661例抗肿瘤药不良反应报告回顾性分析[J].药物流行病学杂志,2011,20(5):229-232.
[4] Allum WH,Blazeby JM,Griffin SM,et al.Guidelines for the management of oesophageal and gastric cancer[J].Gut,2011,60:1449-1472.
[5] Weeks JC,Catalano PJ,Cronin A,et al.Patients'expectations about effects of chemotherapy for advanced cancer[J].N Engl J Med 2012;367:1616-1625.
[6] Ychou M,Boige V,Pignon JP,et al.Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma:an FNCLCC and FFCD multicenter phaseⅢtrial[J].J Clin Oncol,2011,29:1715-1721.
[7] Cunningham D,Allum WH,Stenning SP,et al.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J].N Engl J Med,2006,355:11-20.
[8] Ferrari S,Ruggieri P,Cefalo G,et al.Neoadjuvant chemotherapy with methotrexate,cisplatin,and doxorubicin with or without ifosfamide in nonmetastatic osteosarcoma of the extremity:an Italian sarcoma group trial ISG/OS-1[J].J Clin Oncol,2012,30:2112-2118.
[9] Mir O,Ropert S,Goldwasser F.Neoadjuvant chemotherapy with high-dose methotrexate in osteosarcoma[J].Lancet Oncol,2008,9:1198.
[10]Goldstraw P,Ball D,Jett JR,et al.Non-small-cell lung cancer[J].Lancet,2011,378:1727-1740.
[11]Ramalingam SS,Owonikoko TK,Khuri FR.Lung cancer:New biological insights and recent therapeutic advances[J].CA Cancer J Clin,2011,61:91-112.
[12]王燚.抗肿瘤药物的不良反应及防治[J].临床和实验医学杂志,2012,11(10):746-747.
[13]刘红,张艳华.我院281例抗肿瘤药致不良反应报告分析[J].中国药房,2011,22(38):3607-3610.

