D-氨基酸检测方法研究进展
李辉欣 鞠建松 张琳琳 徐书景
(河北师范大学生命科学学院,石家庄 050024)
一直以来,人们认为D-氨基酸只在细菌细胞壁的组成中起重要作用,但最近的一些分析技术研究表明,在真核生物中也存在着一些高浓度的D-氨基酸,如D-丝氨酸、D-天冬氨酸等。这些氨基酸在生物体内也发挥着重要的生理作用[1,2],研究发现,在哺乳动物中D-丝氨酸与记忆和学习有关[3],D-天冬氨酸与激素分泌功能有关[4],而在垂体前叶,胰腺和血浆中D-丙氨酸浓度的波动与激素调节有关[5]。一些D-氨基酸的存在与某些疾病有关,研究人员发现,在精神分裂症患者的血清和脊髓液中D-丝氨酸的浓度较低[6],而在肌萎缩性侧索硬化症患者的神经胶质细胞中其浓度较高[7]。此外,精子畸形患者精浆和精子中D-天门冬氨酸的浓度比正常人低[8]。
食品中D-氨基酸的浓度常取决于原材料中初始D-氨基酸的含量。D-丙氨酸,D-谷氨酸,D-天冬氨酸,D-丝氨酸,D-脯氨酸,D-苯丙氨酸,D-精氨酸和D-亮氨酸等已被认定为各种食物中的天然成分,在发酵产品中我们也可以检测到D-氨基酸,它们是在天然加工过程中产生的(D-丙氨酸、D-谷氨酰胺、D-天冬氨酸存在于奶酪、酸奶、酒和醋等中)[9,11]。另外,在食物中D-氨基酸的出现通常与蛋白的消化下降有关,从而影响必需氨基酸的生物利用度,也就是最终影响食物的营养价值[9]。因此,D-氨基酸的浓度与D/(D+L)的比率可以作为评价食物质量的指标(识别食物是否掺假)和成熟的分子标记。然而,D-氨基酸的含量也与细菌感染有关。细菌细胞壁中含有肽聚糖和多糖交联形成的多肽,其中D-丙氨酸是主要的成分;其次是D-谷氨酸。因此,D-丙氨酸和D-谷氨酸含量可以作为食物是否受到细菌污染的标志[10]:当果汁被细菌感染时可以检测到大量的游离的D-丙氨酸,牛奶在4℃放置1 h后游离的D-丙氨酸急剧增长[11]。除了这些特定的例子之外,所有氨基酸的D-型同分异构体还可以作为食物中掺假的推论依据:添加水解蛋白来掩饰低的营养成分或不合理的工艺流程都会导致D-氨基酸含量增加,而在一些婴幼儿奶粉中发现大量D-天冬氨酸就是由于L-型同分异构体在高温喷雾干燥或灭菌时经外消旋产生的[11]。
有鉴于此,必须建立快捷而精确的D-氨基酸检测方法。本文主要介绍几种主要的用于检测D-氨基酸的方法。
1 D-氨基酸检测方法
1.1 酶法
酶法是一种简单、实用的分析方法,由于酶的活性中心是不对称环境,有利于识别消旋体。在一定条件下,酶只能催化消旋体中的一种对映体发生反应而生成不同化合物,从而达到对映异构体分离和检测的目的。
D-氨基酸氧化酶(D-amino acid oxidase,DAAO)是一种以黄素腺嘌呤二核苷酸(Flavin adenine dinucletide,FAD)为辅基的典型黄素酶。DAAO催化D-氨基酸生成相应的α-酮酸和氨。在分子氧存在的条件下,还原性FAD被氧化,并将氧转化为过氧化氢;亚氨基酸水解成为α-酮酸和氨,当体内存在过氧化氢时,α-酮酸即发生脱羧产生相应的酸。在过氧化物与过氧化物酶存在的条件下,N-乙基-N-(2-羟基-3-磺丙基)间甲苯胺钠盐(TOOS)与4-氨基安替比林(4-Aminoantipyrine,4-AAP)氧化偶合,形成稳定的紫色或蓝色物质,该物质在550 nm下有吸收峰,根据550 nm下吸光度的变化可以定量测定D-氨基酸的含量。
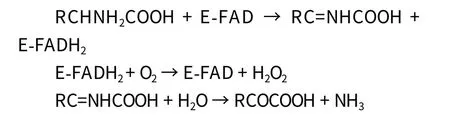
但D-氨基酸氧化酶并不能作用于所有的D-氨基酸,来自猪肾的D-氨基酸氧化酶对D-天门冬酰胺,D-半胱氨酸,D-谷氨酸等没有催化活性,而来自三角酵母的D-氨基酸氧化酶则对D-酪氨酸,D-谷氨酸,D-赖氨酸等没有催化活性[12]。因此,对于这些类型的D-氨基酸则需要更专一的酶来检测。Fisher等[13]发现阿尔茨海默病人脑灰质中D-Asp明显高于正常人,利用D-天门冬氨酸氧化酶(DAspO)催化 D-天门冬氨酸和 D-谷氨酸氧化生成草酰乙酸和α-酮谷氨酸,然后在苹果酸脱氢酶和谷氨酸脱氢酶的作用下与 NADH 反应生成 L-苹果酸和 L-谷氨酸,通过 NADH 的变化,可测定出人血液中D-氨基酸的含量[14]。
酶学检测方法具有很强的选择性,即只对D-同分异构体有活性。这种方法价格便宜,效率高,适宜于从混合样品中特异的专一的检测出D-氨基酸。
1.2 气相层析法
气相层析法先将氨基酸衍生为易气化的物质,利用气态试样中各组分在两相间的分配系数不同进行分析。目前有硅烷化、酯化和酰化等衍生法[15]。由于样品需要脱盐处理,衍生处理时还要求无水及高温条件,而且用一根色谱柱无法测定全部氨基酸,故此法在氨基酸分析检测中应用并不广泛。
1.3 高效液相法
高效液相法是根据各组分在两相间分配系数不同,经过反复的吸附—解吸过程对其进行分离检测。液相色谱法根据作用机理的不同又分为如下几种:手性衍生化试剂、手性固定相分离、手性流动相和柱切换系统。
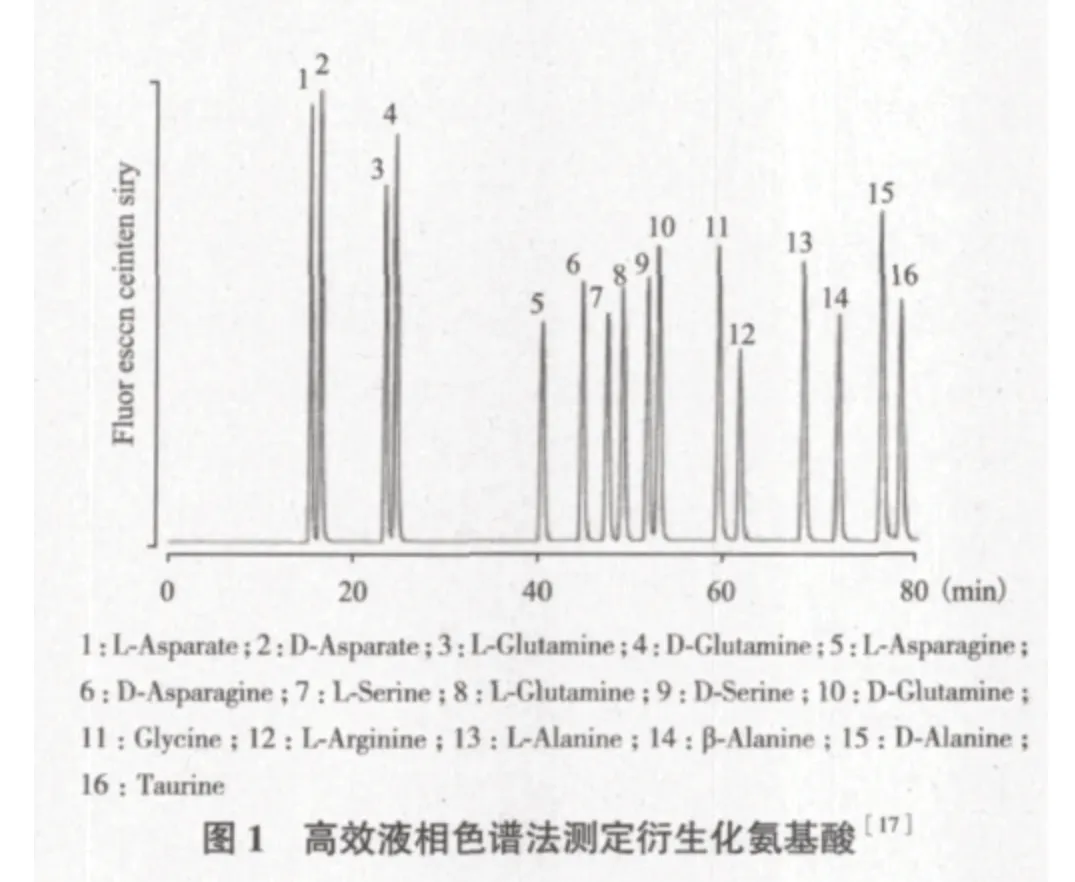
1.3.1 手性衍生化试剂 用于氨基酸对映体分离的手性衍生化试剂有很多种,其中邻苯二甲醛(o-Phthalaldehyde,OPA)-手性巯基化合物是最常用的衍生化试剂,所有伯胺类的氨基酸对映体都能与之反应从而实现分离。OPA与巯基试剂,通常是β-巯基乙醇(β-Mercap-toethanol,β-MCE)连用,在碱性条件下与一级胺反应产生荧光产物1-巯代-2-烷基-异吲 哚(λEX=340 nm,λEM-450 nm)[16]。OPA还可与Boc-L-Cys联用进行D-氨基酸的检测和分离,图1即为部分氨基酸以Boc-L-Cys-OPA为衍生化试剂衍生处理后的高效液相色谱检测图。由图1可知,通过这种方法处理后,D型和L型氨基酸可以得到很好的分离[17]。
1.3.2 手性固定相分离法(CSP) 由于大部分氨基酸没有紫外吸收,所以采用直接法分离氨基酸对映体时仍需要非手性试剂进行柱前或柱后衍生化(其中柱前衍生较为普遍),以提高检测灵敏度。常使用的非手性衍生化试剂多为强荧光试剂,如NBD-F、DBD-F和ABD-F等。对于生物样品中的氨基酸对映体分析,最常用的手性固定相为Pirkle型手性固定相,环糊精类手性固定相在氨基酸对映体分析中也有广泛应用。Hamase等[18]用 Pirkle 型手性柱分离了17对构成蛋白质的氨基酸对映体衍生物(NBDAA),并结合反相高效液相色谱法和Pirkle型手性固定相手性分离,分别测定了雄性和雌性大鼠脑组织内D-天门冬氨酸、D-丝氨酸、D-丙氨酸和D-亮氨酸的分布,以及它们随年龄的变化情况。
1.3.3 手性流动相色谱法 手性流动相色谱法(CMP)也称手性流动相添加法,在氨基酸对映体分析中,使用最早、最多的是配基交换型手性添加流动相(CLEC),主要分离方式是以光学活性的氨基酸(常用L-脯氨酸、亮氨酸和苯丙氨酸等)或其衍生物为手性配基,与二价金属离子(常用铜离子)形成螯合物,添加于流动相中,被分离的氨基酸对映体衍生物(非手性试剂衍生)与手性配基及二价金属离子形成非对映三元络合物,最后在反相色谱条件下实现分离。手性冠醚是常用的手性固定相,Armstrong等[19]用手性冠醚固定相结合ODS柱成功分离了苯丙氨酸、酪氨酸和色氨酸的对映异构体。
1.3.4 柱切换系统 手性固定相色谱和手性流动相色谱法对对映异构体的分离有很好的选择性,但对相似结构的物质(如L-氨基酸之间)分离效果较差。对于复杂的生物样品,可利用柱切换系统,采用多维色谱(或称串联色谱)法,高效、灵敏地分析生物样品中的D-氨基酸。
1.4 生物传感器检测法
一般来说,采用高效液相法、气相色谱法或毛细管电泳法是检测食品、饮料及生物样品中D-氨基酸含量的有效分析方法,这些方法安全可靠、灵敏度很高,但是其专业化程度高、操作耗时和成本昂贵等方面原因制约着它们在食品工业方面的应用。对于常规分析和质量控制措施来说,开发简单、快捷的分析方法迫在眉睫,生物传感器则恰好满足这些要求。
在过去的几年里,许多研究小组提出使用酶反应器检测D-氨基酸。通过测定固定化酶猪肾D-AAO催化反应所产生的过氧化氢的量计算出D-氨基酸的量。但这些传感器的使用在一定程度上因哺乳类来源的相关酶的底物特异性及对酸性氨基酸几乎没催化活力而受到限制。
Rosini等[20]开发了一种生物传感器,它解决了以上两个问题。第一个问题可以通过使用来自酵母的D-氨基酸氧化酶来解决,这个酶具有更高的转换率,更广泛的底物特异性,以及与FAD辅因子的紧密结合[21]。第二个问题最近也得到解决,Sacchi等[22,23]通过理性设计和定向进化技术相结合成功筛选获得了具有广泛的底物特异性的RgDAAO突变体,同时这些突变体对酸性、中性以及非天然的氨基酸的催化效率也有显著提高。
这个传感器以一个三极管电极和RgDAAO突变体为基础(图2)[20]。这个突变体酶蛋白最好能够作用于所有的D-氨基酸。Rosini等[20]成功构建了RgDAAO的多个突变体,其中M213G和T60A/Q144R/K152E突变体表现最佳。当混合物中的D-丙氨酸含量大于等于20%,且酶处于固定化形式时,这些酶对催化D-氨基酸的反应表现出很低的变化,即它们催化D-氨基酸的活力相差不多。这个基于RgDAAO的装置成功地用于检测奶酪样品中D-氨基酸的总量,所检测的奶酪中D-氨基酸的含量与文献报道相一致[11]。由此可见,这是一种有效地检测D-氨基酸的方法。

图2 生物传感器检测D-氨基酸示意图[20]
2 小结
酶法、高效液相法和生物传感器法是几种常用的D-氨基酸的检测方法。酶法价格便宜,效率高,适宜于从混合样品中检测D-氨基酸;而高效液相法检测结果精确,目前被广泛用于D-氨基酸的分离和检测,但该方法专业化程度和成本均较高。生物传感器法操作简单、准确度高,不过酶蛋白选择有一定的局限性,且需要固定化处理。所以,对于D-氨基酸的检测还需要在现有试验手段的基础上进一步加深研究,希望得到一种更加简便易行且灵敏度高的检测方法。
[1] 赵南生, 余志立. D-氨基酸在人体中的来龙去脉——人体中D-氨基酸、D-氨基酸氧化酶、D-天冬氨酸氧化酶研究进展[J]. 氨基酸和生物资源, 1995, 17(2):43-46.
[2] 赵南生. D-氨基酸广泛存在于生命物质中:关于生物分子手性研究发展的评述[J]. 生命的化学, 1996, 16(1):43-44.
[3] Bains JS, Oliet SHR. Glia:they make your memories stick![J]. Trends in Neurosciences, 2007, 30(8):417-424.
[4] D’Aniello A. D-Aspartic acid:An endogenous amino acid with an important neuroendocrine role[J]. Brain Research Reviews, 2007, 53(2):215-234.
[5] Hamase K, Morikawa A, Etoh S, et al. Analysis of small amounts of D-amino acids and the study of their physiological functions in mammals[J]. Analytical Sciences, 2009, 25(8):961-968.
[6] Kumashiro S, Hashimoto A, Nishikawa T. Free D-serine in postmortem brains and spinal cords of individuals with and without neuropsychiatric diseases[J]. Brain Research, 1995, 681(1):117-125.
[7] Sasabe J, Chiba T, Yamada M, et al. D-Serine is a key determinant of glutamate toxicity in amyotrophic lateral sclerosis[J]. The EMBO Journal, 2007, 26(18):4149-4159.
[8] D’Aniello G, Ronsini S, Guida F, et al. Occurrence of D-aspartic acid in human seminal plasma and spermatozoa:Possible role in reproduction[J]. Fertility and Sterility, 2005, 84(5):1444-1449.
[9] Friedman M. Chemistry, nutrition, and microbiology of D-amino acids[J]. Journal of Agricultural and Food Chemistry, 1999, 47(9):3457-3479.
[10] Gandol I, Palla G, Delprato L, et al. D-Amino acids in milk as related to heat treatments and bacterial activity[J]. Journal of Food Science, 1992, 57(2):377-379.
[11] Marchelli R, Galaverna G, Dossena A. D-Amino acids in food[M]//Konno R, Brückner H, D’Aniello A, Fisher G, Fujii N, Ho-mma H(Eds). A new frontier in amino acid and protein research. D-Amino Acids:Nova Science Publishers, 2006:299-315.
[12] Khoronenkova SV, Tishkov VI. D-amino acid oxidase:physiological role and applications[J]. Biochemistry, 2008, 73(13):1511-1518.
[13] Fisher GH, D’Aniello A, Vetere A, et al. Free D-aspartate and D-alanine in normal and Alzheimer brain[J]. Brain Research Bullet, 1991, 26(6):983-985.
[14] Nagata Y, Akino T, Ohno K. Microdetermination of serum D-amino acids[J]. Analytical Biochemistry, 1985, 150(1):238-242.
[15] 张佳, 王川丕, 阮建云. GC-MS及GC测定茶叶中主要游离氨基酸的方法研究[J]. 茶叶科学, 2010, 30(6):445-452.
[16] Halawa I, Baig S, Qureshi GA. Use of high performance liquid chromatography in defining the abnormalities in the free amino acid patterns in the cerebrospinal fluid of patients with aseptic meningitis[J]. Biomedical Chromatography, 1991, 5(5):216-220.
[17] Yoshikawa N, Ashida W, Hamase K, Abe H. HPLC determination of the distribution of D-amino acids and effects of ecdysis on alanine racemase activity in kuruma prawn Marsupenaeus japonicus[J]. Journal of Chromatography B, 2011, 879(29):3283-3288.
[18] Hamase K, Inoue T, Morikawa A, et al. Determination of free D-proline and D-leucine in the brains of mice lacking D-amino acid oxidase activity[J]. Analytical Biochemistry, 2001, 298(2):253-258.
[19] Armstrong DW, Yang XF, Han SM, Menges RA. Direct liquid chromatographic separation of racemates with an alpha-cyclodextrin bonded phase[J]. Analytical Chemistry, 1987, 59(21):2594-2596.
[20] Rosini E, Molla G, Rossetti C, et al. A biosensor for all D-amino acids using evolved D-amino acid oxidase[J]. Journal of Biotechnology, 2008, 135(4):377-384.
[21] Pollegioni L, Piubelli L, Sacchi S, et al. Physiological functions of D-amino acid oxidases:from yeast to humans[J]. Cellular and Molecular Life Sciences, 2007, 64(11):1373-1394.
[22] Sacchi S, Lorenzi S, Molla G, et al. Engineering the substrate specificity of D-amino acid oxidase[J]. The Journal of Biological Chemistry, 2002, 277(30):27510-27516.
[23] Sacchi S, Rosini E, Molla G, et al. Modulating D-amino acid oxidase substrate specificity:production of an enzyme for analytical determination of all D-amino acids by directed evolution[J]. Protein Engineering Design & Selection, 2004, 17(6):517-525.

