针刺对兔膝骨性关节炎软骨TGF-β1、TNFα的影响作用*
缪辉宇 万 雷 陈 宇 广州中医药大学附属骨伤科医院(广州510240)
骨性关节炎(OA)是一种慢性关节疾患,表现为关节内软骨退化以及损害后关节内骨的增生、变形导致关节功能改变甚至功能丧失。我国患膝关节骨性关节炎的人数占总人口约3%,其中55岁以上人群在X线上有膝关节骨性关节炎表现者约占6%,65岁以上老年人膝关节骨性关节炎发病率高达85%[1,2]。目前该病的治疗尚未取得突破性进展,防治OA 已成为当今国际上的研究热点。现有西医治疗多以非甾体类抗炎药缓解症状为主,但长期使用后胃肠道毒副作用明显,常使患者不能耐受而终止治疗。相对而言,针刺疗法具有简便价廉且适合长期使用的特点,故越来越引起了医学界的关注。针刺疗法在治疗OA方面的确切疗效已被临床实践所验证。研究发现,导致OA 关节破坏的主要原因是软骨合成和分解代谢的失衡[3,4],这种失衡很大程度在于病变关节部位细胞因子的异常活动,其中转化生长因子(TGF-β1)和肿瘤坏死因子(TNFα)参与软骨细胞的生长、分化,和软骨代谢关系最为密切。为了探索针刺防治OA 的分子细胞学机制,本课题引入TGF-β1、TNFα细胞因子,利用现代分子生物学技术研究针刺对TGFβ1、TNFα的影响,探讨针刺防治OA的作用机理。
1 材料与方法 1.1 动物 新西兰大白兔30只,体重2.5~3.0Kg,雄性,由广州中医药大学动物实验中心提供。所有大白兔均饲养于恒温恒湿的清洁环境中,环境温度为(25±1)℃,湿度70%,每天12h光照/黑暗,任意进食饲养者提供的大白兔标准饲料和自来水。
2 实验方法 2.1 分组与造模 将新西兰大白兔30只随机分为2组,即造模组27只,正常组3只。正常组不予任何处理,造模组用戊巴比妥钠(30mg/kg)静脉注射麻醉,消毒膝关节皮肤,将4%木瓜蛋白酶生理盐水溶液0.3mL通过髌上韧带两侧注入兔膝关节腔,每3d1次,连续注射3次。术后持续1周肌注青霉素20万U/d以预防感染。动物常规饲养,木瓜蛋白酶末次注入后第2天,以空气栓塞法处死C组动物,解剖左膝关节,于胫骨平台处切取关节软骨组织,观察关节软骨形态变化,评估造模是否成功。
2.2 干预方法 造模成功后再随机分3组,即模型组,针刺组,西乐葆组,每组8只。模型组不作任何处理,针刺组行针刺治疗,西乐葆组予西乐葆灌胃给药。
西乐葆组动物按24mg/d/只灌服西乐葆,每天1次,连续灌胃36d。
针刺组:取穴“内外膝眼”、“鹤顶”、“梁丘”、“血海”、“足三里”,备皮,穴位局部常规消毒,以毫针进行针刺,行提插捻转、平补平泻手法。留针20min,每隔5min捻针1次。每天1次,10次为1个疗程,疗程间休息3d,再行下1个疗程,共针刺3个疗程。
实验结束时,处死全部新西兰兔,取左膝股骨内侧髁关节软骨和关节液进行观察和检测。
2.3 指标检测 2.3.1 关节软骨组织的形态学观察 取股骨内侧髁关节软骨,用10%中性多聚甲醛溶液固定24h后,EDTA脱钙4~8w。HE染色:脱水,透明,浸蜡,包埋,切片,展片,染色。观察软骨层的完整性、软骨细胞的分布及数量、潮线及软骨下骨的改变。进行Mankin评分(1~5分为早期,6~9分中期,10~14分为晚期)[5],验证造模成功。
2.3.2 关节液的抽取检测 关节液的抽取:兔膝部毛剔干净,用2.5mL一次性无菌注射进行膝关节穿刺,注入无菌生理盐水1mL,反复抽吸、注入3~5次,使冲洗液混匀,最后尽量抽尽膝关节腔内液体。将抽取的关节液3000r/min 离心20min,收集上清液,最后得关节液0.5mL/膝,置于-20℃低温冰箱保待检采用ELISA法检测关节液中TGF-β1和TNF-α的水平,具体步骤按试剂盒说明书进行。
2.4 统计学方法 采用SPSS13.0统计学软件进行统计分析,数据用(±s)表示,采用方差分析,组间比较采用两样本t检验。
3 结 果 3.1 实验动物数量分析 实验共纳入30只白兔,其中6只用于膝关节骨性关节炎模型验证,最后24只进入结果分析,无脱落,见表1。
3.2 各组关节软骨组织形态学Mankin′s评分 Mankin′s评分结果显示,模型组Mankin′s评分较正常组明显升高(P<0.01),说明造模成功。针刺组和西乐葆组Mankin′s评分均较模型组低(P<0.01),但两组间差异无显著性意义(P>0.05),见表2。
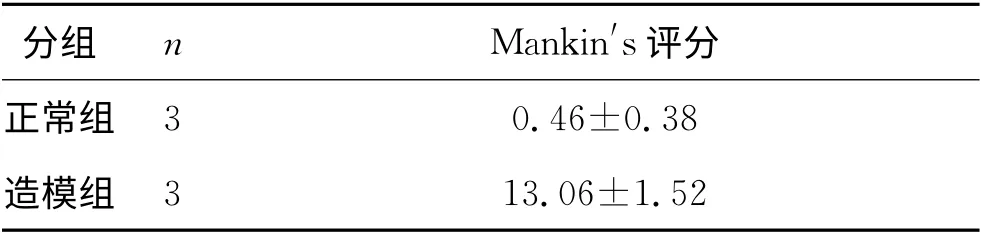
表1 两组关节软骨组织形态学Mankin′s评分结果

表2 造模后三组关节软骨组织形态学Mankin′s评分结果
3.3 三组兔膝关节液中TGF-β1和TNF-α的水平比较 见表3 兔膝骨性关节炎发生后,关节液中TNF-α的水平明显增高(P<0.01),TGF-β1水平明显降低。针刺和西乐葆治疗后关节液中TNF-α水平较模型组显著降低(P<0.01),两组间比较差异无显著性意义(P>0.05);而TGF-β1水平较模型组明显升高(P<0.01),且两组间比较差异有显著性意义(P<0.01)。

表3 三组兔膝关节液中TGF-β1和TNF-α的水平比较
4 讨 论 膝骨关节炎是一种多发于中老年人的慢性退行性疾病,其主要病理特征是膝关节软骨中细胞数目的减少和软骨基质的降解。随着分子生物学的发展,细胞因子在OA中的作用越来越受到人们的关注。细胞生长因子是一组具有促进细胞生长增殖和合成的蛋白质或多肽对骨和软骨的形成与修复起局部调节作用。其中TGF-β1表现出多重生物学特性,是各种生长因子中促进软骨细胞增殖最有效的生长因子,对修复软骨损伤具有重要作用。在牛软骨细胞的培养中,TGF-β1加快了蛋白多糖的代谢,并刺激胶原和葡糖胺聚糖在兔关节软骨中的合成,降低细胞外基质成分的降解[5]。Aral等[6]用腺病毒介导将TGF-β1基因成功地转入人软骨样细胞株HCS-2/8,显著增加了软骨特异性Ⅱ型胶原和蛋白多糖核心蛋白的表达,并抑制基质金属蛋白酶23表达,说明TGF-β1可刺激软骨细胞增生,促进糖蛋白转化,增加软骨基质的合成,拮抗炎症因子,从而有利于软骨修复。有实验显示,TGF-β1不足可能是OA 的致病的重要因素之一[7]。不过,也有资料表明TGF-β1对软骨细胞可能具有双向调节作用[8],一方面,它能促进未分化的和分化早期的软骨细胞DNA复制,促进软骨细胞增殖并促进蛋白多糖和Ⅱ型胶原的合成;另一方面,对分化末期的软骨细胞,TGF-β1则抑制其分化并抑制软骨基质的合成和钙化。
TNF-α是一种多功能炎性细胞因子,主要参与激活多型核细胞,刺激滑膜细胞的前列腺素E2(prostglandins E2,PGE2)的产生,增加骨和软骨的破坏,刺激人软骨细胞分泌纤维蛋白溶酶激活剂,使纤维蛋白溶酶原变成纤维蛋白溶酶而加重关节炎损伤,同时,破骨细胞减少糖蛋白合成,增加糖蛋白降解,并产生胶原酶和其他中性蛋白酶,释放骨钙等,从而导致骨和软骨的破坏。大量研究结果表明,TNF-α能促进成纤维细胞释放黏附分子,激活并增强血管内皮细胞对黏附分子的表达,使血液中的白细胞通过与黏附分子相互作用被集中到关节腔参与对软骨细胞的破坏,对于TNF-α水平增高的具体原因,多数学者认为可能主要与滑膜的炎性变有关[5]。
从本实验结果可以看出,造模成功后,模型组Mankin′s评分、TNFα水平明显升高(P<0.01),而TGF-β1明显降低(P<0.01),说明造模成功,造模后膝关节软骨开始退化,关节腔内促炎性细胞因子TNF-α和抗炎性细胞因子TGF-β1分泌增多。针刺和西乐葆虽然对各炎性细胞因子调节略有所差异,但总的看来,起调节趋势是一致的,均可降低TNF-α和升高TGF-β1。骨关节炎属中医“痹症”范畴,多以肝肾不足为本,气滞血瘀为标,临床治疗应从中医角度辨证,以补肝肾为总治则,施以辨证论治。针刺疗法是一种传统的中医治疗方法,具有简便价廉且适合长期使用的特点,针刺疗法在治疗OA方面的确切疗效已被临床实践所验证。本研究结果再次表明,针刺特定穴位可以减少关节液中TNF-α水平,改变关节局部的内环境,对早期兔膝OA起防治作用。值得注意的是,针刺组TGF-β1水平较西乐葆组明显升高(P<0.01),提示针刺不仅可降低受损关节局部炎症,更可以促进机体细胞生长因子的分泌,从而加速受损软骨修复,显示针刺具有良好的双向调节作用。总之,实验结果显示早期采用针刺特定穴位,能降低关节液TNF-α水平和升高TGF-β1水平,减轻关节软骨退行性变。因此,调控关节软骨细胞因子是针刺防治早期兔膝OA的作用机制之一。
[1] 曹建中.老年骨骼疾病治疗学[M].北京:中国医药科技出版社,1993:95.
[2] 曾庆徐,黄少弼.症状性骨关节炎临床和流行病学探讨[J].中华内科杂志,1995,34(20):88.
[3] Hedbom E,Hauselmann H J.Molecular aspects of pathogenesis in osteopath hits:the role of inflammation[J].Cell Mol Life Sic,2002,59(1):45-53.
[4] Vanderkraan P M,Vandenberg W B.Anabolic and destructive medators in osteoarthritis[J].Curr Opin Clin Nutr Metab Care,2000,3(3):205-211.
[5] Both SS,Watt I,Slag boom E,et al.Innate production of tumournecrosis factor alpha and interleukin 10is associated with radiological progression of knee osteoarthritis[J].Ann Rheum Dis,2008,67(8):1165.
[6] Arai Y,Kubo T,Koba Yashi K,et al.Adenovirus vector-mediated gene transduction to chondrocytes:in vitro evaluation of therapeutic efficacy of Transforming growth factorbeta 1and eat shock protein 70gene transduction[J].Rheumatic,1997,24(9):1787-1795.
[7] Fang P K,MA X C,MA D L,et al.Determination of interleukin-1receptor antagonist,interleukin-10,and transforming growth factorbeta1in synovial fluid aspirates of patients with temporomandibular disorders [J].Oral Maxillofacial Surge,1999,57(8):922-929.
[8] 陈百成,张洪斌,张汉杰,等.生长因子对软骨细胞的作用[J].中华骨科杂志,1999,19(12):746-748.

