溶胶凝胶燃烧法制备的CaO 吸附性能研究
黄 震,米 铁,余新明
(工业烟尘污染控制湖北省重点实验室(江汉大学); 江汉大学 化学与环境工程学院,湖北 武汉 430056)
0 引言
烟气CO2捕集分离技术主要有吸收法、吸附法、膜分离法、低温精馏法、生物性回收法、电化学法、离子液体回收法等[3]。其中,吸附法因采用了资源丰富、价格低廉并且可以循环使用的吸附材料,正越来越受到人们的重视。
目前,锂基吸附剂和钙基吸附剂是高温固体吸附剂的研究重点。锂基吸附剂进行吸附反应时间较长、吸附容量较低[4],而钙基吸附剂的吸附量较大。因此,钙循环吸附法被认为是最有前景的CO2捕集方法之一[5-8]。
钙循环吸附分为两个过程。首先是一个快速碳酸化反应阶段,在此过程中CO2与吸附剂表面的CaO 迅速发生反应。之后是一个慢速反应阶段,在这个过程中,CO2通过吸附剂表面形成的CaCO3层的孔隙扩散到吸附剂内部与内部未反应的CaO 进行反应[9-10]。钙基吸附剂的应用实质是CaO 的碳酸化和再生,反应方程式如下:
CaO +CO2→CaCO3,
CaCO3→CaO +CO2。
目前,已经有很多方法被用来改进钙基吸附剂的吸附性能。研究者通过水蒸气水合增加了不同石灰石样本的孔容积和比表面积[11-13]。他们发现水合能够改进钙基吸附剂的多次循环吸附性能。有些研究者用沉淀的碳酸钙制备了高表面积的CaO[14-16]。
本文用溶胶凝胶燃烧法制备出了CaO 吸附剂,研究了其CO2吸附性能,并与普通分析纯CaO 的吸附性能进行了比较。用X 射线衍射仪(XRD)来分析制备样本的相组成,用热重分析仪(TGA)来测试样本的吸附性能,用比表面积和孔径分析仪对吸附剂在循环前后比表面积和孔容的变化进行分析。
1 实验部分
1.1 吸附剂的制备
将一定量分析纯Ca(NO3)2·4H2O 放入烧杯中,加入适量去离子水使其溶解,按Ca 离子和分析纯一水枸橼酸C6H8O7·H2O 的摩尔比为1∶1 加入分析纯一水枸橼酸,搅拌使其溶解。将混合溶液在80 ℃恒温搅拌成浆糊状,在将烧杯放入120 ℃的干燥箱中干燥至形成干凝胶。然后将样品放入马弗炉中,在900 ℃下煅烧2 h 生成CaO 吸附剂。此外,用普通分析纯CaO(CaO(AR))进行对比研究。
1.2 实验条件
用TGA 对制备的吸附剂性能进行循环实验研究。称取5 mg 左右的样品放入到坩埚中,在100 mL/min 的氮气氛围中将温度从室温升高到650 ℃,此时将气氛切换为85 mL/min 的N2和15 mL/min 的CO2,并在650 ℃保温30 min 进行碳酸化反应。之后,气氛切换为100 mL/min 的氮气,并将温度从650 ℃升高到900 ℃,并在900 ℃保温10 min 进行煅烧。此时,完成一个循环。每组实验循环10 次。实验流程示意图如图1 所示。
加工仔鸡,力求整皮:宰杀仔鸡的方法稍有不同,将剪刀伸进鸡嘴里,然后剪断血管和气管。去内脏时,也只能在尾部划开一个小口,这都是为了保持鸡皮的完整,从而避免烤制时鸡皮破裂。
1.3 实验结果分析方法
吸附剂的转化率用以下公式计算:
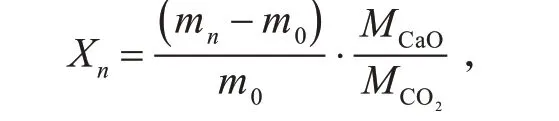
其中Xn为吸附剂n 次循环的转化率,mn为第n次碳酸化反应后样本的质量,m0为样本的初始质量,MCaO为CaO 的摩尔质量,MCO2为CO2的摩尔质量。
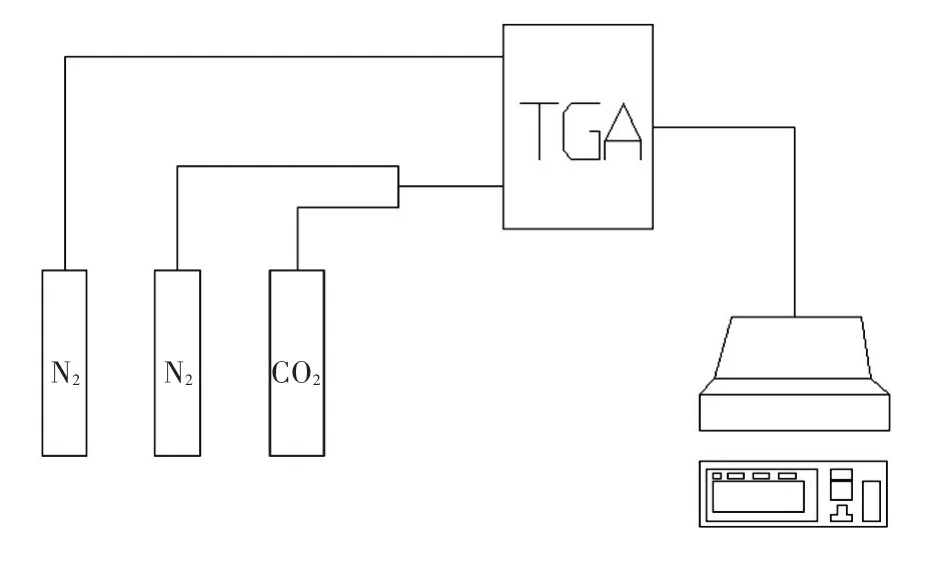
图1 实验流程示意图
2 结果和分析
图2 和图3 分别是CaO(AR)与所制备的样本的XRD 图像,通过比较发现所制备的样品的相组成与CaO(AR)的相组成一致。所制备的样品为CaO 粉体。
图4 为实验制备的CaO 吸附剂与普通分析纯CaO 吸附剂的吸附效率曲线。从图中可以看出,实验所制备的样本在每次循环中的碳酸化转化率都高于CaO(AR)。在第1 次循环中,实验所制备的样本和CaO(AR)的碳酸化转化率分别为98.3%和88.8%。10 次循环后用溶胶凝胶法制备的CaO 吸附剂的转化率为59.2%,而CaO(AR)吸附剂的转化率仅为46. 6%。实验所制备的CaO 吸附剂的吸附性能优于CaO(AR)吸附剂。

图2 CaO(AR)的XRD 图像

图3 制备样品的XRD 图像

图4 吸附效率曲线
表1 为CaO(AR)初始样本与制备的样本的比表面积和孔容对比。从表1 可以看出,实验所制备的样本的比表面积和孔容都明显大于分析纯CaO。实验所制备的样本的比表面积和孔容分别为13. 283 m2/g 和0. 064 cm3/g,而CaO(AR)的比表面积和孔容分别只有8.017 m2/g和0.047 cm3/g。大的比表面积和孔容使得CO2与吸附剂颗粒的接触面积增大,并且CO2在吸附剂颗粒之间的扩散阻力更小,从而使吸附剂的反应更加充分,最终得到较高的碳酸化转化率。

表1 CaO(AR)初始样本与制备的样本的比表面积和孔容对比
实验所制备的吸附剂之所以有这样大的比表面积和孔容,是因为在用溶胶凝胶燃烧法制备CaO 吸附剂的过程中,Ca(NO3)2·4H2O 与C6H8O7·H2O 在去离子水中溶解形成螯合物溶胶,使Ca2+在分子水平上得到分散。同时,干凝胶的煅烧过程中产生大量的气体和热,从而使所制备的吸附剂具有更丰富的孔隙结构。用溶胶凝胶燃烧法制备CaO 吸附剂的反应式如下:
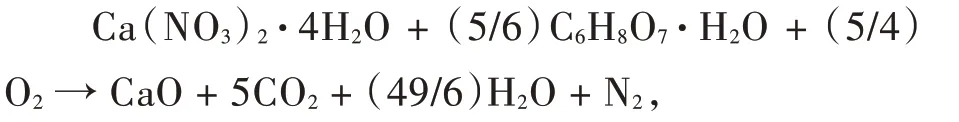
此反应中,金属硝酸盐作为氧化剂,而一水枸橼酸主要是作为燃料。
3 结论
钙基吸附剂的应用实质是CaO 的碳酸化和再生。本文采用溶胶凝胶燃烧法制备了CaO 吸附剂,并研究了其循环吸附性能。
(1)通过图2 和图3 的比较可知:用溶胶凝胶法制备出了CaO 吸附剂。
(2)实验结果表明,实验所制备的样本在每次循环中的碳酸化转化率都大于CaO(AR)。经过10 次循环后制备的吸附剂的转化率为59.2%,大于普通CaO 吸附剂的转化率46.6%。因此,此次实验所制备的CaO 吸附剂有较好的CO2吸附性能。
(3)实验所制备的样本的比表面积和孔容明显大于CaO(AR)。在用溶胶凝胶燃烧法制备CaO吸附剂的过程中,Ca(NO3)2·4H2O 与C6H8O7·H2O在去离子水中形成螯合物溶胶,使Ca2+在分子水平上得到分散分解。大的比表面积和孔容使得CO2与吸附剂颗粒的接触面积增大,并且CO2在吸附剂颗粒之间的扩散阻力更小,从而使吸附剂的反应更加充分,最终得到较高的碳酸化转化率。通过反应式可以看出在制备吸附剂过程中放出大量的气体和热,从而使吸附剂具有很丰富的孔隙结构使吸附反应更易进行。
[1] Aresta M,Dibenedetto A.Utilisation of CO2as a chemical feedstock:opportunities and challenges[J]. Dalton Transcutions,2007,(28):2975-2992.
[2] Nurhanna S R,Zhang Y G,Jackie Y. Conversion of carbon dioxide into methanol with silanes over N-Heterocyclic carbene catalysts[J]. Angewandte Chemie,Int Ed,2009,121(18):3372-3375.
[3] 米铁,黄震,余新明.CO2减排技术研究进展[J].江汉大学学报:自然科学版,2012,40(1):50-56.
[4] 王银杰,其鲁,江卫军.高温下硅酸锂吸收CO2的研究[J].无机化学学报,2006,22(2):268-272.
[5] Blamey J,Anthony E J,Wang J,et al. The calcium looping cycle for large-scale CO2capture[J]. Progress in Energy and Combustion Science,2010,36(2):260-279.
[6] Grasa G S,Abanades J C. CO2Capture capacity of CaO in long series of carbonation/calcination cycles[J]. Industrial & Engineering Chemistry Research,2006,45(20):8846-8851.
[7] Hughes R W,Lu D Y,Anthony E J,et al. Design process simulation and construction of an atmospheric dual fluidized bed combustion system for in Situ CO2capture using high-temperature sorbents[J].Fuel Process Technology,2005,86,1523-1531.
[8] Feng B,Liu W Q. Overcoming the problem of loss-in-capacity of calcium oxide in CO2capture[J].Energy Fuels,2006,20:2417-2420.
[9] Bathia S K,Perlmutter D D. Effect of the product layer on the kinetics of the CO2-lime reaction[J]. AIChE J,1983,29(1):79-86.
[10]Abanades J C,Alvarez D.Conversion limits in the reaction of CO2with lime[J]. Energy Fuels,2003,17:308-315.
[11]Zeman F. Effect of steam hydration on performance of lime sorbent for CO2capture[J]. International Journal of Greenhouse Gas Control,2008,2:203-209.
[12]Manovic V,Anthony E J. Steam reactivation of spent CaO-based sorbent for multiple CO2capture cycles[J].Enviromental Science Technology,2007,41:1420-1425.
[13]Fennell P S,Davidson J F,Dennis J S,et al. Regeneration of sintered limestone sorbents for the sequestration of CO2from combustion and other systems[J]. Journal of the Energy Institute,2007,80:116-119.
[14]Iyer M,Gupta H,Sakadjian B B,et al. Multicyclic study on the simultaneous carbonation and sulfation of high-reactivity CaO[J]. Industrial & Engineering Chemistry Research,2004,43:3939-3947.
[15]Florin N H,Harris A T. Preparation and characterization of a tailored carbon dioxide sorbent for enhanced hydrogen synthesis in biomass gasifiers[J]. Industrial &Engineering Chemistry Research,2008,47:2191-2202.
[16]Yang Z,Zhao M,Florin N H,et al. Synthesis and characterization of CaO nanopods for high temperature CO2capture[J]. Industrial & Engineering Chemistry Research,2009,48:10765-10770.

