鳜鱼生肌调节因子MyoD的克隆及其发育表达分析
李玉珑,农小献,李虹辉,王贝贝,刘希良,褚武英,张建社*,李琦华*
(1.云南农业大学动物科学学院,中国昆明 650201;2.长沙大学生物工程与环境科学系,中国长沙 410003;3.广西大学动物科学技术学院,中国南宁 530004)
生肌调节因子对成肌细胞的发育和分化起决定作用.自从1987年Devis 克隆得到第一个生肌调节因子MyoD 基因以来,对生肌调节因子的研究越来越受到科研工作者的重视,迄今已经克隆获得多种脊椎动物的MyoD 基因[1].MyoD 基因是生肌调节因子家族的主要成员之一,该家族基因具有一个保守的碱性螺旋-环-螺旋结构(bHLH,b basic helix-Loop-helix).b 区(碱性区)是MyoD 与DNA 结合的部位,其中含有一个称为生肌识别结构(MRM)的保守序列.是MyoD 识别、结合肌肉专一基因的关键[2].HLH 与蛋白聚合有关,MyoD 只有与自身或与其他b-HLH 因子形成二聚体后才能与特定的肌肉基因结合.MyoD 基因是脊椎动物胚胎期肌肉发育的主导调控基因之一,对骨骼肌的形成和分化起主要作用,可通过多个途径激活肌肉基因的转录,从而促进成肌细胞的分化[3].
胚胎发育过程中大量基因都是在特定的时间、特定的过程中起作用.整体胚胎原位杂交能够直观地观察基因在整体中的时空表达分布.MyoD 时空表达规律与肌肉的分化、形成密切相关.在发育过程中MyoD 具有特定的表达模式、存在时间、位置和不同表型,且存在种属差异[4].小鼠MyoD 首先在新生成的头部体节短暂表达,随后在生肌节强烈表达.爪蟾MyoD 表达先于体节形成,而海胆MyoD 在原肠形成后才表达[5].目前对MyoD 激活表达的机理所知甚少,决定MyoD 基因是否激活和表达的因素也不清楚,可能由发育、细胞生长状态及其他细胞因子等复杂因素共同调节.
鳜鱼(Siniperca chuatsi)属鲈形目,鮨科,鳜属.鳜鱼是原产于我国各主要江河湖泊的名贵食用鱼.鳜鱼味道鲜美,肉质细嫩,营养价值高,深受广大消费者欢迎[6].上世纪80年代鳜鱼人工繁殖成功并进行大规模推广养殖,使之成为我国主要名贵养殖鱼类之一.目前我国鳜鱼养殖年产量超过20 万吨,其产值每年在100亿人民币以上,而且近几年其价格稳中有升,人工养殖获经济效益较大,现已成为水产品市场中重要中高档产品[7].近年来,本课题组围绕鳜鱼优良肉质性状的理化特征、遗传控制的基因组学以及肌肉相关功能基因的克隆和表达分析进行了较系统的研究[8].这些前期工作为研究鳜鱼MyoD 激活表达的机理研究奠定基础.本文对鳜鱼早期发育过程中MyoD 时空表达规律研究不仅有助于我们更深一步研究鱼类MyoD 激活表达的调控机制,而且将为我国鱼类肉质品质改良和促进水产业优质、高效和健康发展提供重要的理论依据.
1 材料与方法
1.1 实验材料
鲜活鳜鱼购于长沙西长街特种水产品市场,解剖获取鱼背部新鲜肌肉组织用于MyoD 基因克隆.由湖南水产科学研究所提供的成熟雌、雄鳜鱼,人工受精后收集发育正常的鳜鱼胚胎用于MyoD 基因表达分析.取相应时期的胚胎于无菌的EP 管中,放入40 g/L 的胚胎固定液中固定过夜,24 h 后用溶液PBST 冲洗3 次,再分别用体积分数为25%、50%和75%PBST 的甲醇溶液脱水,100%的甲醇溶液脱水2 次,每次10 min,最后将处理的胚胎置于100%的甲醇中,放入-20 ℃冰箱中保存.
1.2 RNA 提取和cDNA 单链的合成
根据Trizol Reagent(Invitrogen)试剂盒使用说明,以鳜鱼背部肌肉样品和不同发育时期的样品提取总RNA并检测RNA 的质量,cDNA 单链的合成按Fermentas pureExtreme 公司cDNA 合成试剂盒按产品说明书进行.
1.3 引物设计及PCR 产物的扩增、转化和测序
根据NCBI 上已登录的石斑鱼、金头鲷、斑马鱼等的MyoD 序列,利用Primer premier 5.0 设计3 对引物来扩增MyoD 基因编码区序列(见表1),引物由上海博尚生物工程技术服务有限公司合成.

表1 用于克隆MyoD 及整体原位杂交引物Tab.1 Primers used for MyoD gene isolation and whole-mount in situ hybridization
以鳜鱼cDNA 第一链为模板,用M1 和M2 引物对鳜鱼MyoD 基因的编码区进行常规PCR 扩增.PCR 反应条件为:94 ℃预变性5 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸50 s,共进行30 个循环;最后72 ℃延伸10 min.反应完后,用1%琼脂糖电泳测定扩增产物浓度和纯度,并切取含有目的片段的凝胶,割胶回收纯化PCR 产物,纯化PCR 产物连接到pGEM-T Easy 载体上.取连接产物转化到大肠杆菌DH5α 感受态细胞中,涂在含氨苄青霉素的LA 平板上,挑取白色单菌斑培养,确定阳性克隆.将筛选出的阳性克隆抽提质粒,进行序列测定.
1.4 氨基酸序列比对和蛋白质功能区分析
序列拼接后,采用NCBI 中的BLAST 程序进行目的基因序列同源性比对和相似性搜索,序列分析使用DNAStar 分析软件,Edit Seq 用于ORF 分析以及蛋白序列的推测.蛋白质功能区由PROSITE tools(http://www.expasy.org/prosite)预测.
1.5 基因表达分析
将克隆得到的MyoD 基因的阳性克隆菌液,按照OMERA 质粒提取试剂盒的说明提取质粒,根据测序的结果用NEB Cut 寻找质粒上、片段外唯一的酶切位点,用ApaI 限制性内切酶将质粒线性化.根据线性化的酶切位点ApaI 确定逆转录的启动子为Sp6.20 μL 逆转录体系如下:3 μL DNA,5 μL ddH2O,2 μL 6.5×NTP,2 μL DTT,4 μL 5×Buffer,2 μL Dig-UTP,1 μL RNase Inhibitor,1 μL Sp6 RNA polyrnerase.将逆转录合成的探针保存于-80 ℃备用.
取出-20 ℃冰箱中保存在100%甲醇中的胚胎材料于1.5 mL 的离心管杂交前处理后,加入400 μL 杂交液,65 ℃水浴预杂交3 h.将合成的探针用杂交液按1∶150 稀释并65 ℃预热.加入稀释好的探针70 μL,65 ℃水浴过夜.回收探针,进行杂交后处理,然后进行冲洗和显色,染上清晰颜色以后,用PBST 清洗掉多余显色液,再用40 g/LPFA/PBS 室温下固定1 h 以上或4 ℃固定过夜.用PBST 清洗掉多余的固定液.将胚胎保存在体积比为1∶1 的甘油/PBST 混合液中.最后用体视镜观察并拍照.
2 结果与分析
2.1 MyoD cDNA 序列及其推导氨基酸序列分析
通过对鳜鱼MyoD cDNA 序列的克隆,得到了鳜鱼MyoD 基因的cDNA 序列(图1),序列已提交Genebank,登录号:JN561167.克隆得鳜鱼MyoD 基因cDNA813bp,编码270 个氨基酸,推导的氨基酸序列相对分子质量为19 954.86,等电点7.71,pH7 时带电量3.00.氨基酸序列含有1 个bHLH 结构(图2).

图1 MyoD cDNA 序列Fig.1 The sequence of MyoD cDNA

图2 各物种MyoD 氨基酸部分序列结构分析及其同源性比较Fig.2 Protein sequence comparison of MyoD from 14 vertebrates
2.2 鳜鱼MyoD 与其他物种的相应氨基酸同源性比较
用MEGA5.05 软件对不同物种MyoD 基因的氨基酸序列进行同源性比对,发现鳜鱼(Siniperca chuatsi,AEM98184)与石斑鱼(Epinephelus coioides,ADJ95348)的同源性较高,与绿变色蜥(Anolis carolinensis,XP_003214790)、绿头鸭(Anas platyrhynchos,ACO57137)、鼠(Mus musculus,EDL22927)的同源性较低,与人(Homo sapiens,CAA40000)的同源性最低.不同物种的MyoD 氨基酸序列差异大.例如鱼类与两栖类、爬行类、鸟类、哺乳类相比缺少了N 端的10 个氨基酸残基;虽然不同物种间MyoD 蛋白质序列差异大,但也存在一些共同点.例如图2所示存在3 个保守区,第一个保守区在bHLH 结构处.
2.3 鳜鱼胚胎时期MyoD 的表达情况
由图3 可见,鳜鱼MyoD 在胚胎刚受精、囊胚期和原肠期均无表达.MyoD 最早在肌节早期被检测到信号.当9 体节时期,MyoD 的表达量明显增多.伴随着鳜鱼体节从头部往尾部表达.体节期,MyoD 在中后部表达.尾芽期MyoD 的表达量达到最大值.然而,尾芽期过后,MyoD 的表达量急剧减少,尤其是头端,但是尾部仍然有强烈的信号.血流期在鳜鱼尾部检测到微弱信号.孵出期在鱼眼的后方和胸部检测到强信号,而身体其他部位检测不到信号.仔鱼期没有检测到MyoD 表达的信号.
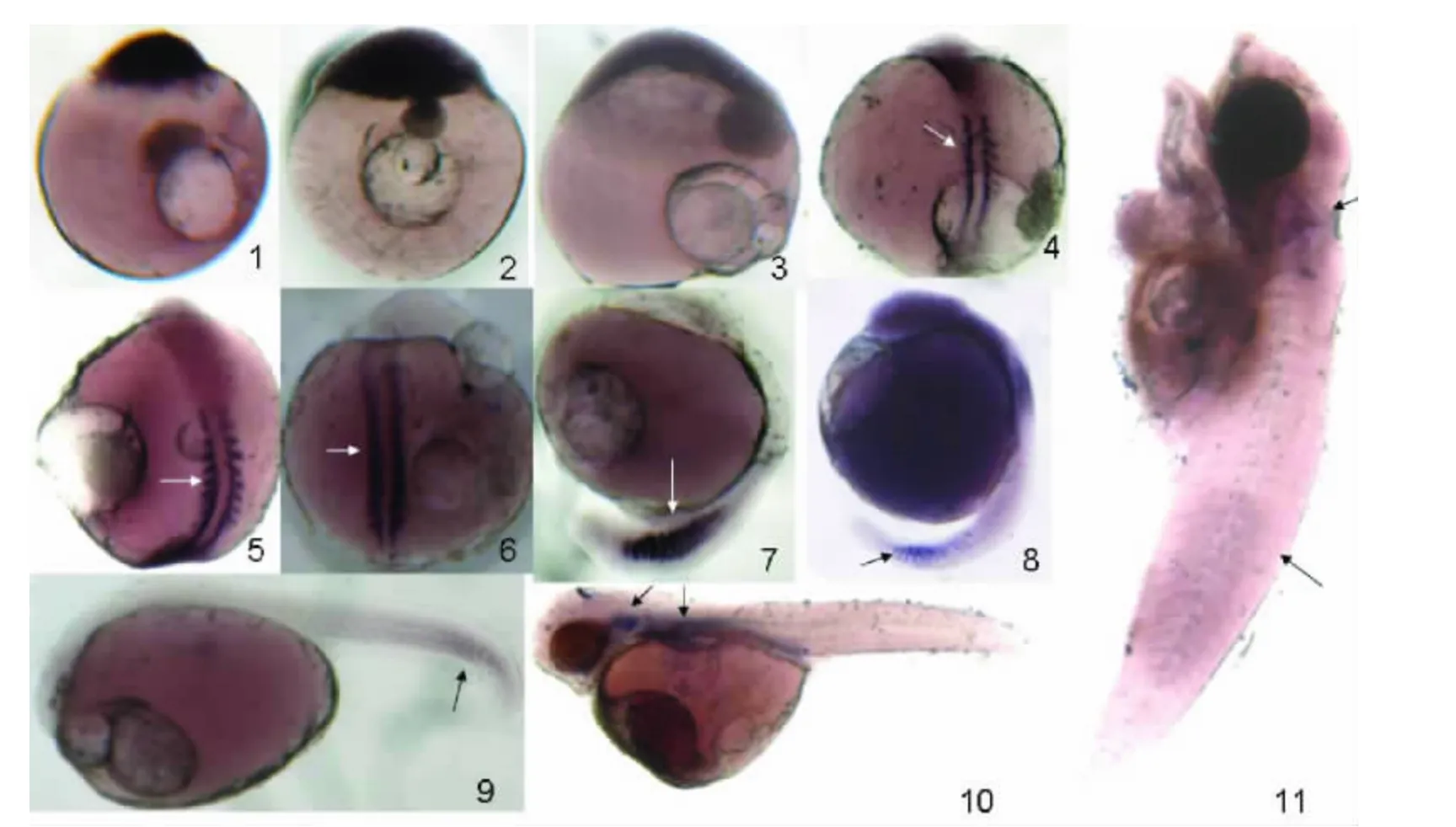
图3 鳜鱼胚胎MyoD 基因的整体原位杂交Fig.3 Temporal expression of MyoD during embryonic development with whole-mount in situ 509 hybridization
3 讨论
MyoD 基因作为肌肉转录因子家族成员之一,可通过多个途径激活肌肉基因的转录,从而促进成肌细胞的分化,是骨骼肌细胞分化的决定性基因,其表达对维持肌分化有重要作用[9-10].
各物种MyoD 的氨基酸残基数量不尽相同,例如石斑鱼含有269 个氨基酸残基,大西洋比目鱼含有296个氨基酸残基;非洲爪蟾含有288 个氨基酸残基;绿变色蜥含有305 个氨基酸残基;鸟类的绿头鸭和火鸡都含有297 个氨基酸残基;亚洲水牛和人类都含有319 个氨基酸残基.随着物种由低等向高等进化,MyoD 氨基酸残基的数目有增加的趋势,从石斑鱼的269 个增加到牛和人的319 个.即使同属于鱼类,不同鱼的肽链长度也有差异[11-12].通过PROSITE tools 在线工具对鳜鱼MyoD 推导的蛋白质功能预测分析发现,鳜鱼MyoD 的蛋白质有一个含有bHLH 结构,且bHLH 结构保守性高.高度保守的bHLH 结构与MyoD 的生物学功能相关.碱性区域是与许多肌肉特异基因DNA(CK、myogenin 等)的启动子或增强子结合所必需的结构域[13-14],例如当MyoD 的蛋白质与MyoG 等靶基因的E-box(CANNTG)结合后能够促进靶基因的特异性转录[15-16].Davis等人研究发现碱性区域的几个氨基酸(Arg、Ala、Thr、Lys)是激活肌肉基因转录的关键,当用其他bHLH 蛋白相应位置的氨基酸取代这些氨基酸,MyoD 对其家族的肌肉基因转录的作用消失,但不会影响其与DNA结合[17].
本文运用整体胚胎原位杂交法对鳜鱼MyoD 基因在胚胎发育中的表达情况进行研究.结果表明,鳜鱼MyoD 基因在肌节早期或原肠晚期表达,且先于体节形成.在尾芽期(约24 体节)之后,MyoD 在近头端先形成的体节中的表达减少,但尾部的信号依然强.在刚孵出的鳜鱼眼睛后方和胸部腹侧检测到强烈的MyoD 信号.Cheng-Yung Lin 等人用基因敲除技术敲除斑马鱼MyoD 基因后,发现斑马鱼的上直肌、内直肌、下直肌、外直肌和咽喉腹侧的肌肉都不能形成[18];鳜鱼眼睛后方的信号是否是MyoD 在调节咽喉腹侧的肌肉形成,以及MyoD 胸部腹侧信号在调节哪些肌肉形成还有待进一步研究.
[1]ZHANG K,GAO L.Effect of basic helix-loop-helix transcription factors on retinal cell fate decisions[J].Int J Ophthalmol,2007,7(3):759-762.
[2]DAWSON S R,TURNER D L,WEINTRAUB H,et al.Specificity for the hairy/enhancer of split basic helix-loop-helix(bHLH)proteins maps outside the bHLH domain and suggests two separable modes of transcriptional repression[J].Mol Cell Biol,1995,15(12):6923-6931.
[3]成 嘉,褚武英,张建社.鱼类肌肉组织发生和分化相关基因的研究进展[J].生命科学研究,2010,14(4):355-362.
[4]TAPSEOTT S J.The circuitry of a master switch:MyoD and the regulation of skeletal muscle gene transcription[J].Developmemt,2005,132(12):2685-2695.
[5]KIM H J,GUTH R,JONSSON C B,et al.S.Macrurus myogenic regulatory factors induce mammalian skeletal muscle differentiation:Evidence for functional conservation of MRFs[J].Int J Dev Biol,2009,53(7):993-1002.
[6]赵发兰,周瑞雪,成 嘉,等.鳜鱼与鲢鱼肌球蛋白轻链2 启动子的克隆及其序列比较分析[J].湖南师范大学自然科学学报,2011,34(1):75-79.
[7]农小献,赵发兰,宾石玉,等.斑鳜轻链3 基因(MLC3)cDNA 的克隆及纵向表达分析[J].湖南师范大学自然科学学报,2011,34(2):79-83.
[8]CHU W Y,FU G H,CHEN J,et al.Gene expression profiling in muscle tissues of the commercially important teleost,Siniperca chuatsi L.[J].Aquacult Int,2010,18(4):667-678.
[9]KABLAR B,KRASTEL K,TAJBAKHSH S,et al.Myf5 and MyoD activation define independent myogenic compartments during embryonic development[J].Dev Biol,2003,258(2):307-318.
[10]POWNALL M E,GUSTAFSSON M K,EMERSON JR C P.Myogenic regulatory factors and the specification of muscle progenitors in vertebrate embryos[J].Annu Rev Cell Dev Biol,2002,18:747-783.
[11]TAN X,DU S.Differential expression of two MyoD genes in fast and slow muscles of gilthead seabream(Sparus aurata)[J].Dev Genes Evol,2002,212(5):207-217.
[12]DELALANDE J M,RESCAN P Y.Differential expression of two nonallelic MyoD genes in developing and adult myotomal musculature of the trout(Oncorhynchus mykiss)[J].Dev Genes Evol,1999,209(7):432-437.
[13]LIU C,MCFARLAND D C,VELLEMAN S G.Effect of genetic selection on MyoD and myogenin expression in turkeys with different growth rates[J].Poult Sci,2005,84(3):376-384.
[14]AGUIAR D H,BOCK C,PADOVANI C R,et al.MyoD,Myogenin and proliferating cell nuclear antigen expression in growing Niletilapia(Oreochromis niloticus L.)[J].Aquacult Res,2008,39(15):1673-1679.
[15]LASSAR A B,BUSKIN J N,LOCKSHON D,et al.MyoD is a sequence-specific DNA binding protein requiring a region of myc homology to bind to the muscle creatine kinase enhancer[J].Cell,1989,58(5):823-831.
[16]CHEN Y H,LIANG C T,TSAI H J.Expression,purification and DNA-binding activity of tilapia muscle-specific transcription factor,MyoD,produced in Escherichia coli[J].Comp Biochem Physiol Part B,2002,131(4):795-805.
[17]DAVIS R L,CHENG P F,LASSAR A B,et al.The MyoD DNA binding domain contains a recognition code for muscle-specific gene activation[J].Cell,1990,60(5):733-746.
[18]LIN C Y,YUNG R F,LEE H C,et al.Myogenic regulatory factors Myf5 and Myod function distinctly during craniofacial myogenesis of zebrafish[J].Dev Biol,2006,299(2):594-608.

