静态顶空气相色谱法测定原料药硫酸氢氯吡格雷有机残留溶剂
罗忠华,文景兵
(东阳光药业研究院,中国东莞 523871)
硫酸氢氯吡格雷(Clopidogrel Bisulfate)是一种新型的抗血小板聚集药物,是法国Sanofi-Aventis 公司研制的血小板聚集抑制剂,1998年首次在美国和英国上市,临床上广泛用于治疗心脏病、中风、确诊的外周血管疾病[1-2],特别是联合其他药物临床上报道较多[3-6],对心脑血管的预防与治疗取得了很好的疗效.化学合成药的生产工艺中不可避免地使用各类溶剂,当药品中所含的残留溶剂水平高于安全值时,对人体或环境将产生危害[7-8],人用药品注册技术规范国际协调会(ICH)与各国药典对药品中残留溶剂的限度水平做出了严格的规定,残留溶剂的检测与控制是原料药质量研究的重点与难点.目前残留溶剂的检测主要采用气相色谱法,其中又以静态顶空气相色谱法应用最为广泛[9-12].原料药硫酸氢氯吡格雷的合成工艺中使用了甲醇、丙酮、异丙醇、乙腈、二氯甲烷、正己烷、乙酸异丙酯和甲苯等8 种溶剂,故本文按《中国药典》2010年版(二部)残留溶剂测定法(Ch.P.2010 二部附录VIII P)[13]与ICH 相关要求,开发了静态顶空气相色谱法同时测定原料药硫酸氢氯吡格雷中甲醇、丙酮、异丙醇、乙腈、二氯甲烷、正己烷、乙酸异丙酯和甲苯8 种溶剂残留量,所用溶剂经济环保,方法简便,灵敏度高,结果准确、可靠.
1 实验部分
1.1 仪器与试剂
气相色谱仪(Agilent 公司7890A),配氢火焰离子检测器;静态顶空色谱仪(Agilent 公司7697A);20 mL顶空瓶(Agilent 公司).二甲基亚砜(DMSO,色谱纯,德国默克公司);N,N-二甲基甲酰胺(DMF,色谱纯,德国默克公司);甲醇、丙酮、异丙醇、乙腈、二氯甲烷、正己烷、乙酸异丙酯、甲苯(DMF,色谱纯,德国默克公司);纯水由Milli-Q 水纯化系统(实验值自制)制备.
1.2 试验方法
1.2.1 色谱条件 色谱柱:DB-624 毛细管柱(60 m×0.53 mm,3.0 μm);载气及流速:氮气(纯度>99.999%),3.3psi(恒压);进样口温度:200 ℃;分流比:10∶1;检测器温度:250 ℃;进样量:1 mL;色谱柱升温程序:42 ℃保持15 min,以10 ℃/min 升至60 ℃,保持4 min,再以10 ℃/min 升至175 ℃,保持5 min,最后以25 ℃/min 升至220 ℃,保持5 min.
1.2.2 对照溶液的配制 对照储备液1:取600 mg 二氯甲烷、410 mg 乙腈、290 mg 正己烷、890 mg 甲苯,精密称定,至50 mL 容量瓶中,用DMF 定容至刻度;
对照储备液2:取300 mg 甲醇、500 mg 丙酮、500 mg 异丙醇、500 mg 乙酸异丙酯,精密称定至50 mL 容量瓶中,再精密移取5.0 mL 对照储备液1 至上述50 mL 容量瓶中,用DMF 定容至刻度;
对照液:精密移取5.0 mL 对照储备液2 至100 mL 容量瓶中,用DMF 定容至刻度,再精密移取5 mL 上述溶液和2 mL 超纯水至20 mL 顶空瓶中,密封摇匀,即得.
1.2.3 供试液的配制 取500 mg 供试品,精密称定至20 mL 顶空瓶中,精密移取5.0 mL DMF 和2 mL 超纯水至上述顶空瓶中,密封摇匀,即得.
1.2.4 供试品加标溶液的配制 准确称取500 mg 供试品,精密称定至20 mL 顶空瓶中,精密移取5.0 mL对照液和2 mL 超纯水至上述顶空瓶中,密封摇匀,即得.
2 结果与讨论
2.1 方法的建立与优化
2.1.1 色谱条件的优化 比较了DB-1(30 m×0.53 mm,3.0 μm),DB-1701(30 m×0.53 mm,3.0 μm),DB-Wax(30 m×0.53 mm,3.0 μm),DB-624(30 m×0.32 mm,3.0 μm),DB-624(30 m×0.53 mm,3.0 μm),DB-624(60 m×0.53 mm,3.0 μm)对8 种待测残留溶剂的分离效果.结果表明,DB-1 毛细管柱不能有效分离丙酮与异丙醇;B-1701 毛细管柱不能有效分离丙酮、二氯甲烷与异丙醇;DB-Wax 毛细管柱不能有效分离二氯甲烷与异丙醇;DB-624(30 m×0.32 mm,3.0 μm)毛细管柱中乙腈与二氯甲烷的分离度也只有1.0;改用粗口径的DB-624 柱(30 m×0.53 mm,3.0 μm),乙腈与二氯甲烷的分离度能达1.5;继续提高柱长以提高柱效,使用DB-624(60 m×0.53 mm,3.0 μm)乙腈与二氯甲烷能完全基线分离(>3.0),且其他各溶剂峰形与分离度都良好.因此,本研究最终选用DB-624(60 m×0.53 mm,3.0 μm)毛细管柱分离8 种待测的溶剂,典型色谱图见图1.
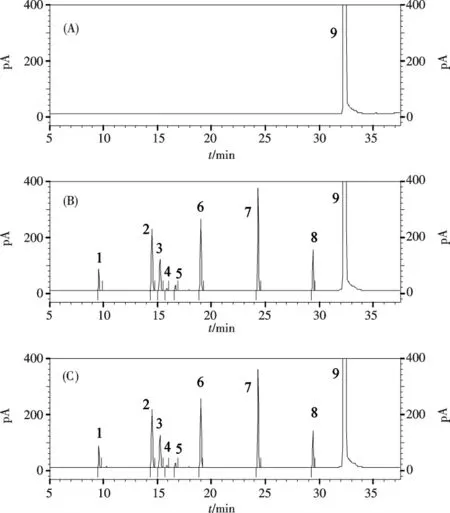
图1 空白液(A)、对照液(B)、供试品加标液(C)的色谱图:1.甲醇,2.丙酮,3.异丙醇,4.乙腈,5.二氯甲烷,6.正己烷,7.乙酸异丙酯,8.甲苯,9.N,N-二甲基甲酰胺(DMF,溶剂)Fig.1 Chromatograms of blank solution(A),reference solution(B),and spiked sample solution(C):1.methanol,2.acetone,3.isopropanol,4.acetonitrile,5.dichloromethane,6.n-hexane,7.isopropyl acetate,8.toluene,9.DMF(solvent)
2.1.2 溶剂的选择 根据样品的溶解性考察几种适用于顶空气相的溶剂:DMF、DMI、DMSO.DMI 与DMSO在所选用的顶空条件下均出现未知峰并干扰测定,原因可能是相应溶剂在高温条件下与样品基质发生反应产生杂质.DMF 作为溶剂未出现未知峰,但在回收率考察的实验中,发现甲醇、异丙醇灵敏度低,且回收率很低(甲醇仅为10%,异丙醇仅为40%),原因应为甲醇与异丙醇极性较大,在DMF 中难以挥发,气液分配系数小,且易受样品基质的影响.考察发现考虑往DMF 样品溶剂中加水,可以有效增强甲醇与异丙醇的灵敏度,同时也能降低甲醇与异丙醇的基质效应,提高回收率.本研究最终选用5 mL DMF 样品溶液加2 mL 超纯水作为顶空溶液,甲醇和异丙醇的响应与回收率均显著增加(甲醇95.0%~98.9%,异丙醇99.5%~101.8%),其他溶剂的响应也都有提高且回收率均满足要求.
加水即可以增强灵敏度又能提高回收率的原因应该为加入一定量的水后提高顶空溶液的极性,增大甲醇、异丙醇等与顶空溶剂的极性差别,从而使甲醇和异丙醇更易从顶空溶剂中释放出来,即增加甲醇和异丙醇的响应强度,也使甲醇和异丙醇受基质影响的程度也变小,提高了回收率.该机理应该与文献中加盐能诱导均相溶液分相的机理一致[14],即加入一极性差别大的溶剂能改变原溶液中组分的分配性能.
2.2 方法学考察
2.2.1 系统适用性 取对照溶液,重复进样6 次,甲醇、丙酮、异丙醇、乙腈、二氯甲烷、正己烷、乙酸异丙酯和甲苯的峰面积的RSD 见表1.

表1 8 种残留溶剂的系统适用性Tab.1 System suitability of the determination of eight solvents
2.2.2 专属性 取对照品溶液、供试品加标溶液、空白稀释液,分别进样分析.对照品溶液、供试品加标溶液中各测定溶剂的与邻近峰的分离度均大于2.0;供试品加标溶液与对照品溶液中各待测溶剂保留时间一致;空白稀释液中在各待测溶剂出峰处均无干扰.专属性实验证明该方法专属性良好.
2.2.3 方法精密度 平行配制6 份供试品加标溶液,分别进样分析,计算8 种残留溶剂含量的RSD,结果见表2.各测定溶剂的RSD 小于3%,表明方法精密度良好.

表2 8 种残留溶剂的精密度Tab.2 Precision of the determination of eight solvents
2.2.4 线性范围 配制不同浓度水平的对照溶液(各溶剂ICH 限度的20%至150%),分别进样分析,计算各测定溶剂的线性回归方程,并计算相关系数,结果如表3所示.各测定溶剂线性相关系数均大于0.99,表明线性良好.

表3 8 种残留溶剂的线性Tab.3 Linearity of the determination of eight solvents
2.2.5 准确度 配制高(150%)、中(100%)、低(20%)3 个浓度水平的供试品加标溶液,各浓度水平配制3份,分别进样分析.8 种待测残留溶剂的回收率和RSD 值见表4.结果表明,各溶剂的各加标水平回收率均在90%~110%范围内,说明方法准确度良好.
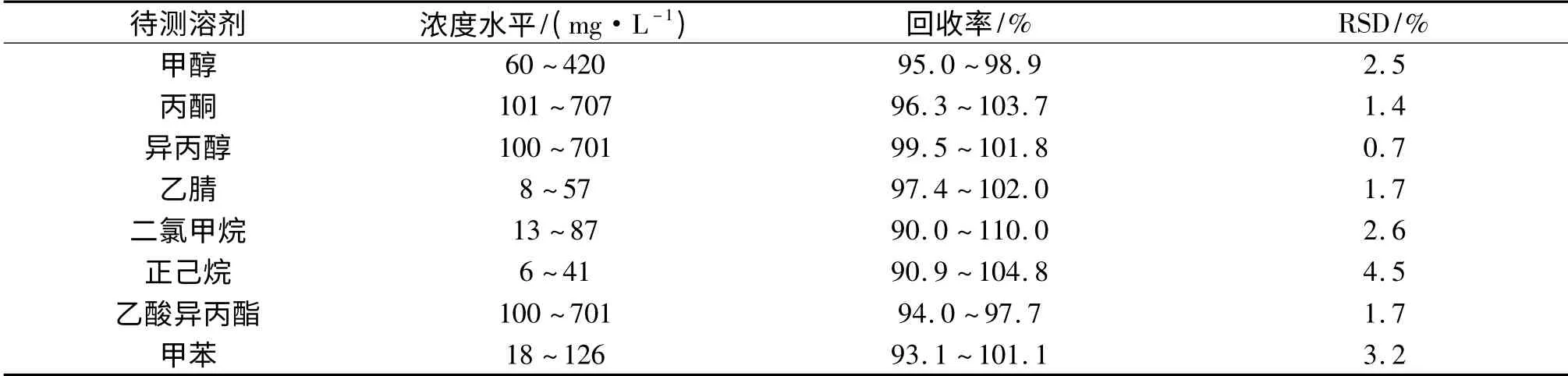
表4 8 种残留溶剂的回收率Tab.4 Recovery of the determination of eight solvents
2.3 实际样品的分析
对自研的3 批硫酸氢氯吡格雷样品进行检测,发现只检出甲醇、异丙醇和乙酸异丙酯(表5),其他溶剂均未被检出.
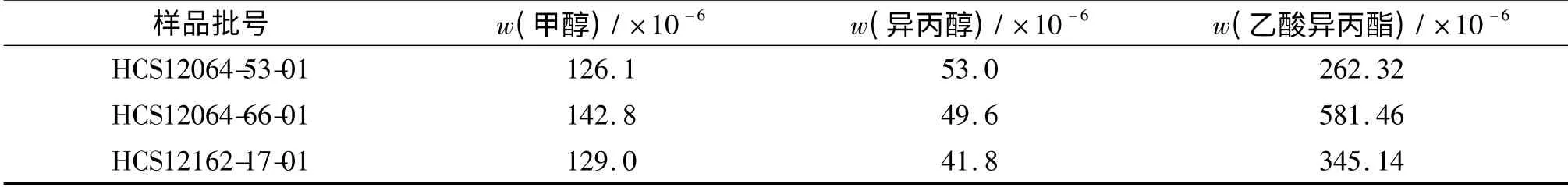
表5 自制样品中8 种残留溶剂的检测结果Tab.5 Determination results of the eight solvents in actual samples
3 结论
本研究采用DB-624 毛细管柱(60 m×0.53 mm,3.0 μm),通过常规的静态顶空的分析方法,就可以同时分离分析硫酸氢氯吡格雷原料药中8 种潜在的残留溶剂.本方法具有良好的专属性、线性、准确度,为更好的控制硫酸氢氯吡格雷产品的质量奠定了基础.
[1]杜 希.氯吡格雷的药理作用与临床评价[J].首都医药,2002(7):44.
[2]杨 熠,何小云,赵专友,等.硫酸氯吡格雷的药理作用研究[J].中国新药杂志,2000,9(10):712-714.
[3]李丽丽,吕晓东.氯吡格雷联合阿司匹林治疗不稳定型心绞痛疗效观察[J].辽宁中医药大学学报,2012,14(10):182-183.
[4]刘先仕,李爱霞,张 鹏.2 型糖尿病对阿司匹林和氯吡格雷双联抗血小板药物治疗效应的分析[J].心肺血管病杂志,2012,31(5):584-587.
[5]姚丽梅,黄海定,朱 伟.复方丹参滴丸增强氯吡格雷对高血脂症小鼠血小板的抑制作用[J].中成药,2012,34(9):1648-1652.
[6]胡梦梅,朱 伟.叶下珠提取物和氯吡格雷联合使用对高血脂症小鼠血小板活化功能的影响[J].中成药,2012,23(9):2121-2123.
[7]胡昌勤,刘 颖.药物残留溶剂的监控及其分析方法[J].药学学报,2007,42(12):1237-1242.
[8]秦 立,胡昌勤,刘文英.顶空气相色谱法测定药品中残留溶剂的影响因素考察[J].药物分析杂志,2005,25(7):823-826.
[9]吴朝华,王秀梅,顾保明.顶空毛细管气相色谱法测定盐酸丁卡因原料药中的残留溶剂[J].药物分析杂志,2011,31(6):1188-1192.
[10]宋更申,姜建国,付 焱,等.顶空毛细管气相色谱法测定盐酸莫雷西嗪中残留溶剂的含量[J].沈阳药科大学学报,2011,28(1):51-54.
[11]肖进近.静态顶空气相色谱法及其在药品有机溶剂残留测定中的应用[D].石家庄:河北大学,2006.
[
12]刘丰华.药物中残留溶剂的检测研究[D].石家庄:河北医科大学,2008.
[13]国家药典委员会.中国药典2010[M].2 版.北京:中国医药科技出版社,2010.
[14]陈继涛,刘国柱,陈 波.柱前衍生高效液相色谱-质谱法测定血浆中的氨基葡萄糖浓度[J].湖南师范大学自然科学学报,2010,33(10):77-81.

