不同地区取样点土壤中木质素降解优势菌株的筛选及生长特性比较
别春雨 姜 涛 蒋晓云 章世元
(扬州大学动物科学与技术学院,扬州 225009)
农作物秸秆是人类从事作物栽培生产过程中大量产生的一类含有一定数量木质素的纤维类可再生资源。据统计,1998年我国秸秆总产量为7.9亿 t[1]。通过对秸秆中木质素的降解,提高农作物秸秆的饲用率,对畜禽养殖中饲料资源的开发具有重要意义。秸秆中的木质素和植物细胞壁中的纤维素、半纤维素紧密结合在一起,使纤维素降解酶不易与纤维素分子接触,限制了各种来源的消化酶对植物体成分的消化[2]。白腐菌能够分泌胞外木质素过氧化物酶(lignin peroxidase,LiP)、锰过氧化物酶(manganese-dependent peroxidase,MnP)、漆酶(laccase)[3-4],具有降解木质素的特性,且被认为是目前主要的木质素降解微生物[5-6]。而不同地区的气候类型、植被种类和土壤成分等因素都会影响到土壤中微生物的种类、数量、群系结构和产酶性能。为此,本文旨在通过探讨不同取样点土壤中的真菌密度及木质素降解菌的生长特性,探讨植被类型、土壤成分对木质素降解菌生长特性的影响,拟为后续从土壤中筛选高效木质素降解菌提供研究依据。
1 材料与方法
1.1 培养基
马铃薯葡萄糖琼脂(PDA)综合培养基:PDA 37 g、KH2PO43.0 g、MgSO4·H2O 1.5 g、尿素0.01 g、维生素 B1微量,初始 pH 7.0,加蒸馏水至1 000 mL[7]。
选择培养基:愈创木酚 1.0 g、尿素 0.02 g、酒石酸 0.05 g、蛋白胨 2.6 g、KH2PO41.0 g、MgSO4·7H2O 0.5 g、Na2HPO40.2 g、琼脂 18 g,初始 pH 7.0,加蒸馏水至 1 000 mL[8]。
PDA-RB亮蓝培养基(过氧化酶鉴定培养基):将RB亮蓝单独灭菌后按625μg/mL的浓度加入到PDA培养基中。
PDA-Bavendamm培养基(漆酶鉴定培养基):在PDA培养基中加入鞣酸至终浓度为0.001 g/L。
1.2 土壤主要成分测定
在扬州大学文汇路校区农学院实验基地、南京师范大学仙林校区、临沂市兰山区、潍坊市、连云港市选定5个采样点,采集枯枝败叶下10 cm左右的深层土壤,每个取样点取10份土样,共50份土壤样品。测定土壤中的总有机碳(total organic carbon,TOC)和氮、磷、钾等主要成分的含量。土壤中TOC含量的测定采用K2Cr2O7-H2SO4氧化法,总磷含量的测定采用分光光度计法,总氮含量的测定采用凯氏定氮法,全钾含量的测定则采用火焰光度计法。
1.3 菌落总数测定及菌株初选
在取得的土壤样品中各取1 g土壤,分别用无菌水按倍比稀释的方法稀释为10-1~10-1010个浓度梯度的土壤悬浮液。结合涂布法在PDA综合培养基上进行培养,观察并记录每个平板培养基上的菌落总数。然后将前面培养所得的菌落接种到选择培养基上,同时通过不断挑取单个菌株划线分离直至获得多个纯菌株,观察并测量记录各个菌株在选择培养基上培养6 d时的菌丝直径(d1)、棕色变色圈直径(d2),计算两者比值(d1/d2)。
1.4 菌株复选及生长量测定
菌株生长量的高低一般用其在PDA固体培养基上的菌丝生长速度来表示,而菌丝生长速度的测定常采用菌落直径测定法[9]。
将初选菌株变色圈外围形成的菌丝接种于PDA-Bavendamm平板上,在温度30℃、湿度80%条件下培养。观察并记录产生变色圈的情况及时间,如果能够产生棕褐色变色圈则为阳性(+),反之则为阴性(-)[10]。选择变色圈直径大的显色快的菌株接种到PDA-RB亮蓝培养基上进一步选择,在温度30℃、湿度80%条件下培养5 d。观察并记录产生橙黄色变色圈的直径及时间。通过上述2个变色反应可筛选出具有产生木质素降解酶的优势菌株,并可对不同取样点优势菌株的产酶特性进行比较。
1.5 统计分析
试验数据采用Excel建立数据库,采用SPSS 18.0软件中的单因素方差分析法(one-way ANOVA,LSD)进行分析,并进行数据间的相关性分析,结果以平均值±标准差表示。
2 结果与分析
2.1 不同取样点土壤成分及真菌密度
2.1.1 土壤成分
由表1可见,5个取样点土壤的TOC、总氮、总磷和全钾含量差异较大。连云港取样点土壤的TOC、总氮和全钾含量最高。其中TOC含量比扬州取样点高3.09%(P <0.05),比南京、临沂和潍坊这 3个取样点分别高 191.90%、86.57%和77.63%(P<0.01)。南京取样点土壤的 TOC含量最低,极显著低于其他取样点(P<0.01)。连云港取样点土壤总氮含量分别比扬州、南京、临沂和潍坊取样点高 51.72%、225.93%、266.67% 和64.49%(P<0.01),临沂取样点土壤总氮含量最低,扬州与潍坊及南京与临沂取样点土壤总氮含量间差异不显著(P>0.05)。扬州取样点土壤总磷含量最高,分别比南京、临沂、潍坊和连云港取样点高 144.44%、52.78% 、69.23% 和 103.70%(P<0.01),南京取样点土壤总磷含量最低。连云港、潍坊和南京3个取样点土壤全钾含量相近(P>0.05),并极显著高于临沂和扬州2个取样点(P<0.01)。各取样点土壤成分间的相关性分析结果表明,土壤中TOC含量与总氮(r=0.84,P<0.01)、总磷(r=0.52,P < 0.05)的含量相关关系显著。
2.1.2 真菌及木质素降解菌密度比较
由表2可知,扬州取样点土壤中真菌和木质素降解菌的密度均极显著大于其他各取样点(P<0.01)。临沂取样点土壤中的真菌密度居中,连云港、潍坊、南京3地土壤中的真菌密度较低,且这3地间无显著差异(P>0.05);而另外4地土壤中木质素降解菌的密度则较低。对各指标间的相关性分析表明,土壤中TOC含量分别与真菌(r=0.52)、木质素降解菌(r=0.57)密度有显著正相关(P <0.05),总磷含量与真菌(r=0.88)、木质素降解菌(r=0.85)密度呈显著的强正相关(P<0.01),真菌密度与木质素降解菌的密度呈显著的正相关(r=0.64,P <0.05)。
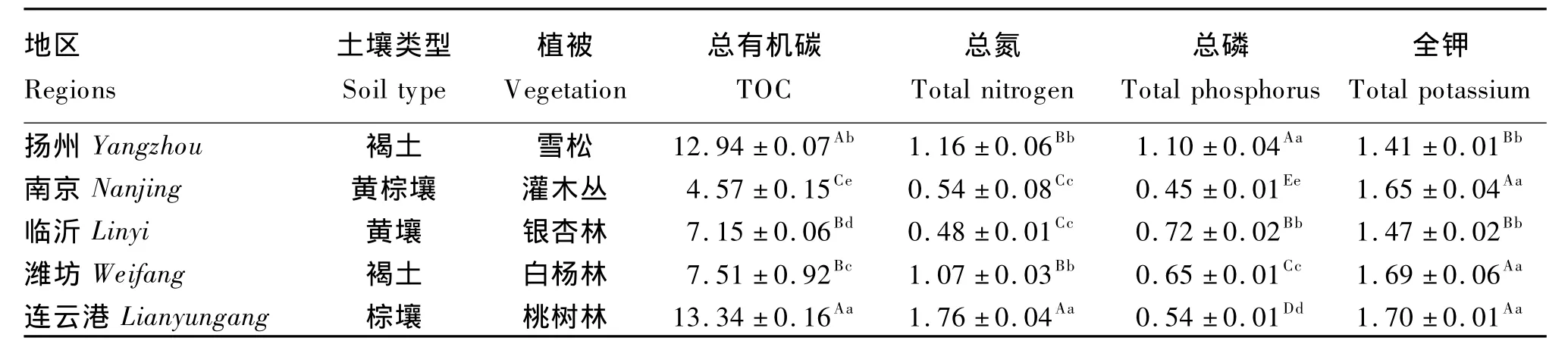
表1 各个取样点土壤主要成分的比较Table 1 The comparison of soil main components in each sampling point mg/g

表2 不同地区土壤中真菌及木质素降解菌密度的比较Table 2 The comparison of fungi and lignin-degradating bacteria densities in soil of different areas
2.2 各地优势菌株的比较
2.2.1 菌株初选
(2)此工件左侧有阶梯和槽,在中间还有M24的螺纹,故左侧不方便装夹,须先加工右侧,再调头装夹右侧,加工左侧。
利用选择培养基初步挑选出10个菌株培养6 d后的菌丝直径(d1)和变色圈直径(d2)的测定及d1/d2计算结果见表3。可以看出,所选菌株的d1/d2均小于1。部分菌株在选择培养基上生长与变色圈的出现情形如图1(表及图中的编号为:Y——扬州,N——南京,L——临沂,W——潍坊,G——连云港)。
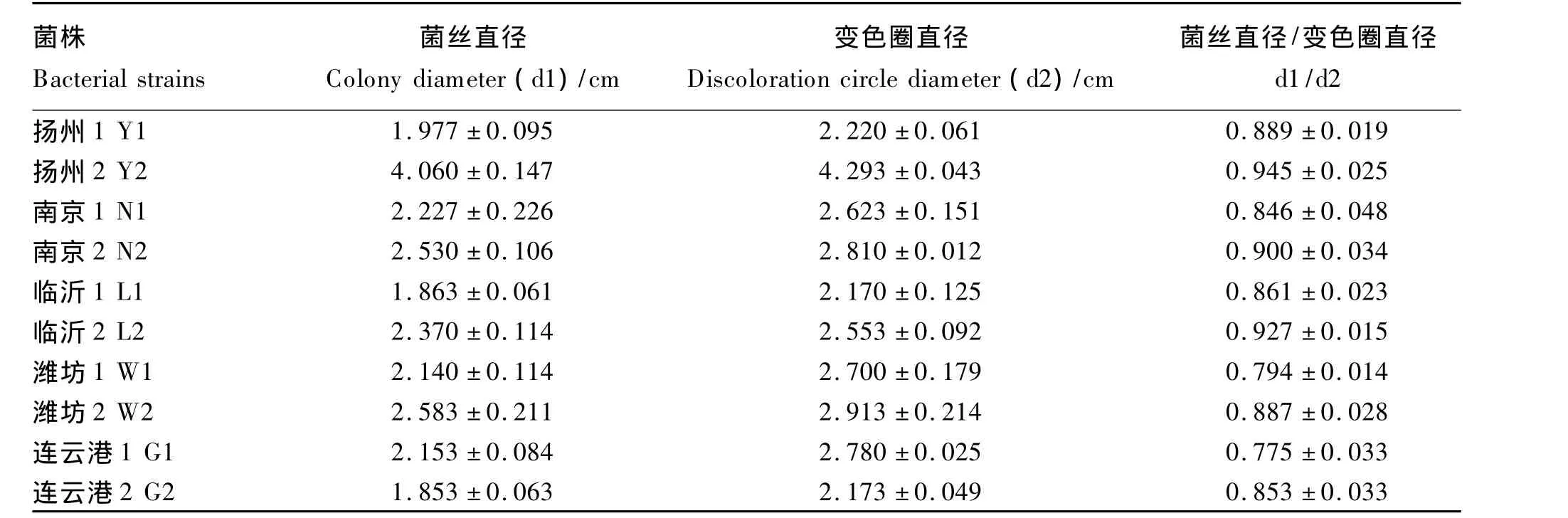
表3 初选10株菌株培养6 d后菌株菌丝直径(d1)与变色圈直径(d2)比值Table 3 The ratio of colony diameter(d1)and discoloration circle diameter(d2)of 10 strains after 6 days of culture
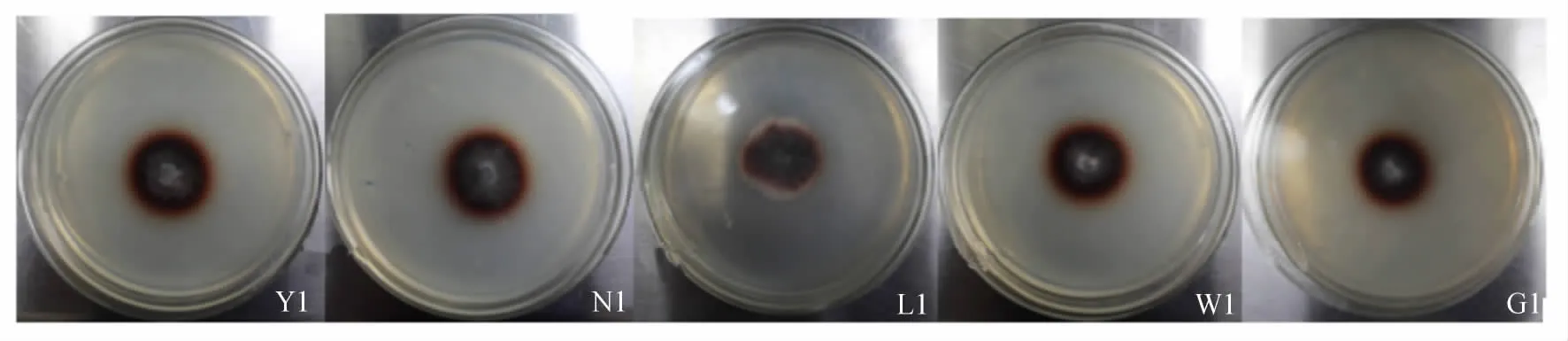
图1 部分菌株选择培养基上棕色变色圈Fig.1 Part of the bacterial strains produce brown discoloration circles in selection medium
2.2.2 菌株复选及各优势菌株产酶特性比较
将初选所得的10个菌株接种到PDA-Bavendamm培养基和PDA-RB亮蓝培养基进行复选,并对各地区取样点土壤中优势菌的生长特性比较。在显微镜下观察,所有被选菌株的菌落均呈类似菊花状,其菌丝体为白色絮状,菌体为圆形绒毛状,菌落呈现乳白色且均匀,扁平,有同生圆。据此菌落形态,利用《真菌鉴定手册》可初步鉴定本试验所选木质素降解菌为白腐真菌属。
对被选5个优势菌株产酶特性的定性比较结果见表4。可以看出L1、Y1、G1在接种PDA-Bavendamm培养基后第1天即产生变色圈,其中Y1变色圈的表现最为迅速明显,而W1和N1接种后第2天才开始产生变色圈。培养5 d后,菌株L1、Y1、W1所产生的变色圈几乎布满整个PDA-Bavendamm平板,其中Y1在培养4 d后产生的变色圈几乎布满整个平板(图2),而G1和N1培养后第5天产生的变色圈相对较小。
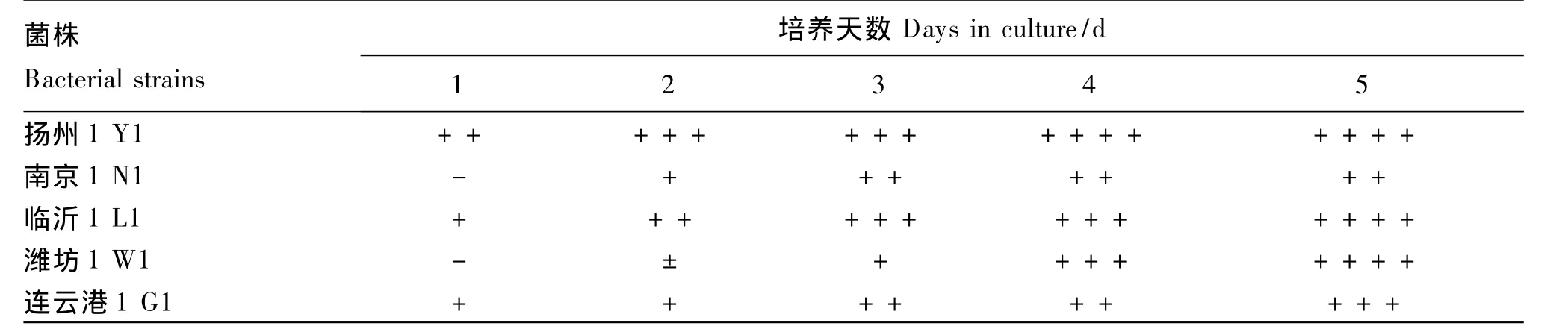
表4 优势菌株在PDA-Bavendamm平板显色反应Table 4 Discoloration reaction of advantage strains in PDA-Bavendamm medium

图2 部分菌株PDA-Bavendamm平板黄褐色变色圈Fig.2 Part of the bacterial strains produce tan color circles in PDA-Bavendamm medium
5株优势菌株接种后1~5 d的观察结果见表5。5株菌株接种后第1天均产生脱色圈,但脱色圈直径无显著差异(P>0.05),而到接种后第2天菌株N1脱色圈直径明显增大,分别比Y1、L1、W1和 G1 直径大 136.14%、123.27%、134.52% 和131.19%(P<0.05)。接种后第3天菌株 N1仍保持较高的优势(图3)。但到接种后第5天菌株Y1和W1产生的脱色圈直径则表现为大于菌株N1、L1 和 G1,但差异不显著(P >0.05)。

表5 优势菌株在PDA-RB亮蓝平板上脱色圈直径Table 5 The decolorizing circle diameter of advantage strains in PDA-RB bright blue plate cm
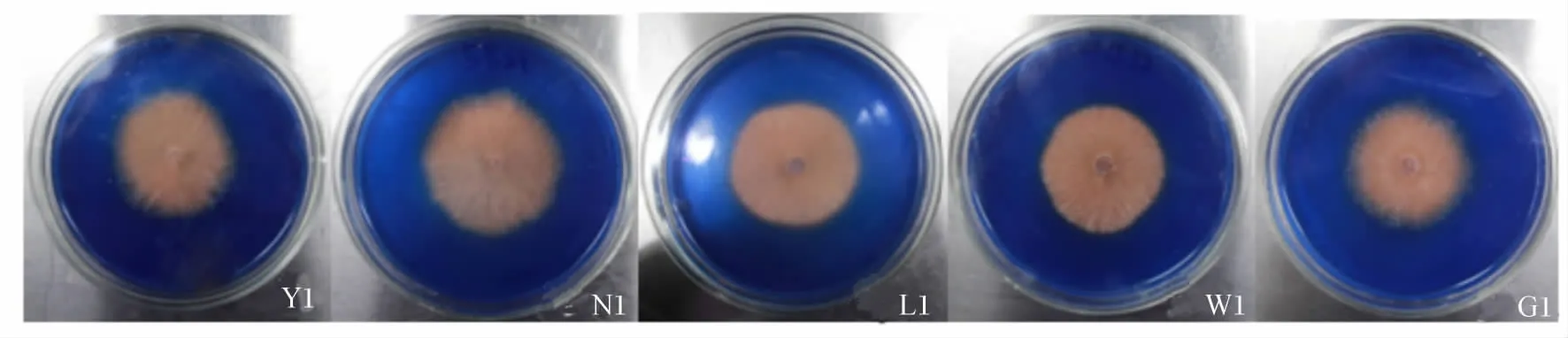
图3 部分菌株PDA-RB亮蓝平板上浅褐色脱色圈Fig.3 Part of the bacterial strains produce shallow brown decolorizing circles in PDA-RB medium
2.2.3 菌株生长速度
通过测量菌落在基础培养基上的直径确定不同菌株的生长速度,试验结果如表6,通过初选和复选最终得到的5株优势菌株在温度30℃、湿度80%条件下基础培养基上培养5 d。接种后第2天菌株L1、N1和G1生长速度显著高于Y1和W1(P<0.05),接种后第5天菌落直径最大的是W1,为7.92 cm,几乎长满整个平板,分别比 Y1、N1、L1 和 G1 大 2.99%、9.03%、5.74% 和14.29%,G1菌落生长速度最慢。

表6 菌株生长速度比较Table 6 The comparison of bacterial strain growth rates cm
3 讨论
据研究,土壤中微生物的数量及其群系结构受土壤有机组成、总氮、总磷、全钾和土壤生态环境(如植被)等的影响较大[11]。在本试验的5个采样地区中,南京取样点土壤中真菌和木质素降解菌密度均较低,而扬州取样点中的真菌和木质素降解菌密度均极显著高于其他取样点,分析原因可能是南京取样点的土壤采于灌木丛,并没有高大的植被覆盖,紫外线具有强烈的杀菌作用且能部分透过低矮的灌木丛,故其土壤中真菌受紫外线影响较大。扬州取样点的土壤植被为常绿针叶林,对紫外线有良好的遮挡作用,从而减少了紫外线对土壤真菌的杀灭作用。土壤中真菌密度还受到土壤类型的影响,其中扬州地区褐土中真菌密度极显著高于另外4地。此外本试验中不同采样点土壤中的TOC含量与木质素降解菌的密度呈正相关(r=0.57,P <0.05),说明木质素降解菌的密度还受到土壤中TOC含量的影响。
生长速度较快的菌株能在短时间内获得大量菌丝体生物量,而大量的菌丝体生物量是产酶的物质基础[12]。因此,选择一定时间内生物量高的菌株是筛选高效菌株的重要措施之一。本试验以菌落生长直径代表菌丝体生物量,选择在PDA培养基中菌落生长直径大的菌株作为复选的后备菌株。经过复选每个地区最终各选留了1株生长量高的菌株作为下一步产酶特性研究的对象,并取得了较理想的效果。这一结果表明在菌株筛选的初期,用菌落生长直径的大小来代表菌丝体生物量是可行的。
由于木质素结构复杂,目前人们常利用具有木质素类似结构的一类化合物,如愈创木酚、单聚物香草酸、苯酚、磷甲基苯酚;二聚物愈创木基甘油-B-松柏醇醚(GGE)、1,2-二愈创木基丙烷-1,3-二醇、脱氢联松柏醇(DCA)等其中的任意1种,作为唯一碳源制作成选择培养基来筛选木质素降解菌[13]。Nishida 等[14]认为,能在以愈创木酚等为唯一碳源的选择培养基上产生变色圈的微生物表明其具有降解木质素的能力。本试验利用愈创木酚为唯一碳源的选择培养基,从土壤中筛选出了具有木质素降解能力的菌株。进一步的研究表明:真菌在以前述化合物制作的选择培养基上产生的变色圈有2类:一类是在菌丝圈外围形成棕色变色圈,菌丝圈与变色圈的比值小于1;另一类则是在菌丝圈以内形成变色圈,菌丝圈与变色圈比值大于 1[15]。Rodrguez 等[16]的试验表明,菌丝圈直径与变色圈直径的比值可作为判断该菌是否能优先选择性地降解木质素的依据:比值小于1的真菌能首先选择性降解木质素,而比值大于1的真菌则优先选择降解纤维素。本试验选择菌丝圈直径与变色圈直径比值小于1的10个菌株经进一步纯化后作为后续复选的研究对象。
研究表明白腐真菌对木质素的降解是通过几种酶共同作用的结果,其中起主要作用的有漆酶和过氧化物酶[17]。真菌分泌的漆酶能够使鞣酸等酚类化合物聚合,其反应特征是可在含有酚类化合物的漆酶鉴定培养基上形成棕褐色变色圈,并可根据变色圈的呈现时间及大小来定性地鉴定白腐真菌产生漆酶与降解木质素的能力[18]。而具有木质素降解能力的真菌所产生的过氧化物酶能够使RB亮蓝脱色,据其在PDA-RB亮蓝培养基上出现淡黄色脱色圈的时间和直径大小可定性地检测各个菌株产生过氧化酶的能力。经定性鉴定的结果表明,本试验筛选得到的木质素降解菌株均具有明显产生漆酶和过氧化物酶的特性,而且来自于不同地区取样点土壤中的优势菌株木质素降解酶产生的速度与持续时间差异明显。扬州取样点土壤中木质素降解优势菌产生漆酶的速度较快,临沂、扬州和连云港取样点土壤中优势菌产生漆酶的能力较强。南京取样点土壤中木质素降解优势菌产生过氧化酶的速度较快,扬州和潍坊取样点土壤中优势菌产生过氧化物酶的能力较强。这些均为后续进一步研究木质素降解菌对秸秆的降解及饲料原料的开发奠定了良好的基础。
4 结论
①不同地区土壤中木质素降解菌的种群结构差异较大。在有机物含量高、常绿植被覆盖率高的褐土地区采集土壤有助于获得理想的高效木质素降解优势菌株。
②本试验筛选获得的菌株均能够产生漆酶和木质素过氧化酶等木质素降解酶。
[1] 谢光辉,王晓玉,任兰天.中国作物秸秆资源评估研究现状[J].生物工程学报,2010,26(7):855 -863.
[2] 陶用珍,官映亭.木质素的化学结构及其应用[J].纤维素科学与技术,2003,11(1):42 -50.
[3] TUOR U,WINTERHALTER K,FIECHTER A.Enzymes of white-rot fungi involved in lignin degradation and ecological determinants for wood decay[J].Journal of Biotechnology,1995,41(1):1 -17.
[4] AKIN D E,MORRISON Ⅲ W H,RIGSBY L L,et al.Biological delignification of plant components by the white rot fungi Ceriporiopsis subvermispor and Cyathus stercoreus[J].Animal Feed Science and Technology,1996,63(1/2/3/4):1 -17.
[5] 张力,邵喜霞,韩大勇.白腐真菌木质素降解酶系研究进展[J].畜牧与饲料科学,2009,30(1):35 -37.
[6] ROBINSON T,CHANDRAN B,NIGAM P.Studies on the production of enzymes by white-rot fungi for the decolourisation of textile dyes[J].Enzyme and Microbial Technology,2001,29(8/9):575 -579.
[7] 徐晓峰,何北海,徐丽丽,等.白腐菌的筛选及对松木片木质素和树脂的脱除[J].华南理工大学学报:自然科学版,2007,35(4):105 -111.
[8] 吕镇梅,李硕文,同帜.白腐菌降解造纸黑液中木质素的研究[J].西北纺织工学院学报,2000,14(4):406-411.
[9] 邢来君.普通真菌学[M].北京:高等教育出版社,1999:270-280.
[10] 吴坤,朱显峰,张世敏,等.杂色云芝产漆酶的发酵条件研究[J].菌物系统,2001,20(2):207 -213.
[11] 杨刚,何寻阳.不同植被类型对土壤微生物量碳氮及土壤呼吸的影响[J].土壤通报,2008,39(1):189-191.
[12] MADHAVIS,LELE S.Enhanced production of laccase using a new isolate of white rot fungus WR-1[J].Process Biochemistry,2006,41(3):581 -588.
[13] LEE K,MOON S H.Electroenzymatic oxidation of veratryl alcohol by lignin peroxidase[J].Journal of Biotechnology,2003,102(3):261 -268.
[14] NISHIDA T,TSUTSUMI Y,LIYOSHI Y,et al.Polyethylene degradation by lignin-degrading fungi and manganese peroxidase[J].The Japan Wood Research Society,1998,44(3):222 -229.
[15] MOSAI S,WOLFAARDT J F,PRIOR B A.Evaluation of selected white-rot fungi for biosulfite pulping[J].Bioresource Technology,1999,68(1):89 -93.
[16] RODRGUEZ A,PERESTELO F,CARNICERO A.Degradation of natural lignins and lignocellulosic substrates by soil-inhabiting fungi imperfecti[J].FEMS Microbiology Ecology,1996,21(3):213 -219.
[17] 池玉杰,伊洪伟.木材白腐菌分解木质素的酶系统——锰过氧化物酶、漆酶和木质素过氧化物酶催化分解木质素的机制[J].菌物学报,2007,26(1):153-160.
[18] 关艳丽,李莉.1株产漆酶白腐真菌的筛选和鉴定[J].微生物学杂志,2010,30(3):74-77.

