维生素E在罗非鱼幼鱼饲料中的应用及耐受性研究
李志华 付京花 唐雪莲 侯梦杰 吴海斌 潘 庆
(华南农业大学动物科学学院,广州 510642)
近年来,营养素被用作免疫增强剂以防治疾病的发生和降低疾病感染[1]。维生素E是水产动物饲料中最重要的营养素之一,特别是在高密度的养殖条件下显得尤为重要。维生素E与水产动物机体的新陈代谢、抗氧化能力、免疫功能、繁殖性能都有着密切的关系。它通过提高机体内抗氧化酶的活性、抑制自由基的形成、加快受损脱氧核糖核酸的清除等途径减轻自由基对细胞膜中多不饱和脂肪酸、富含巯基的蛋白质及细胞骨架和核酸的损伤[2-3],从而使得水产动物保持正常的生理状况。已有的研究发现,维生素E能促进鲤鱼(Cyprinus carpio)[4]、大菱鲆(Scophthalmus maximus)[5]的生长,高于 NRC(2011)推荐量的高水平维生素E能显著提高斑点叉尾(Ictalurus punctatus)[6]、尼罗罗非鱼(Oreochromis niloticus)[7]的生长性能,并提高其体内抗氧化酶的活性。但过高水平维生素E会降低许氏平的生长速度和血色素浓度[8]。过量的维生素E导致香鱼红细胞脆性增强,并且促进体内的脂肪过氧化[9]。这些研究结果提示,过量的维生素E可能对鱼类具有毒性作用。本研究旨在运用营养学和毒理学的方法,对维生素E作为抗氧化饲料添加剂的有效性和罗非鱼对其的耐受性进行评价,获得其最大未观察到有害作用剂量(no observed adverse effect level,NOAEL),以确定维生素E发挥最佳功效并不致对机体产生副作用的最大剂量,从而为罗非鱼饲料中合理有效地应用维生素E的抗氧化性能提供理论依据。
1 材料与方法
1.1 试验鱼和维生素E
试验用吉富罗非鱼幼鱼购于广州番禺国家罗非鱼良种场。试验用维生素E购自Sigma公司,活性成分为α-生育酚,为微黄绿色黏稠液体,维生素E含量≥96%。
1.2 试验设计
试验选用400尾大小均匀[平均体重为(3.25 ±0.02)g]、健康的吉富罗非鱼幼鱼,随机分为5组,每组4个重复,每个重复20尾。5组(G0、G1、G2、G3、G4)试验饲料维生素 E 添加量分别为0(对照)、25、50、250、2 500 mg/kg,测得维生素 E 实际含量分别为 8.5、33.0、56.0、220.0、2 580.0 mg/kg,试验饲料组成及营养水平见表1。有效剂量50 mg/kg依据NRC(2011)和相关文献推荐的罗非鱼对维生素 E 的需要量[7,10-11]确定,最高剂量为有效剂量的50倍。剂量设计原则依据农业部《饲料和饲料添加剂水产靶动物有效性和耐受性评价试验指南》和欧盟 EFSA[12]标准。饲料原料经粉碎后过60目筛,于搅拌机中混匀30 min,边搅拌边缓慢加入豆油和鱼油,然后再加入30%的水,最后用双螺旋挤压机挤压成直径1.5 mm的面条状,再制成粒状饲料,自然风干后,保存于-20℃的冰柜中备用。
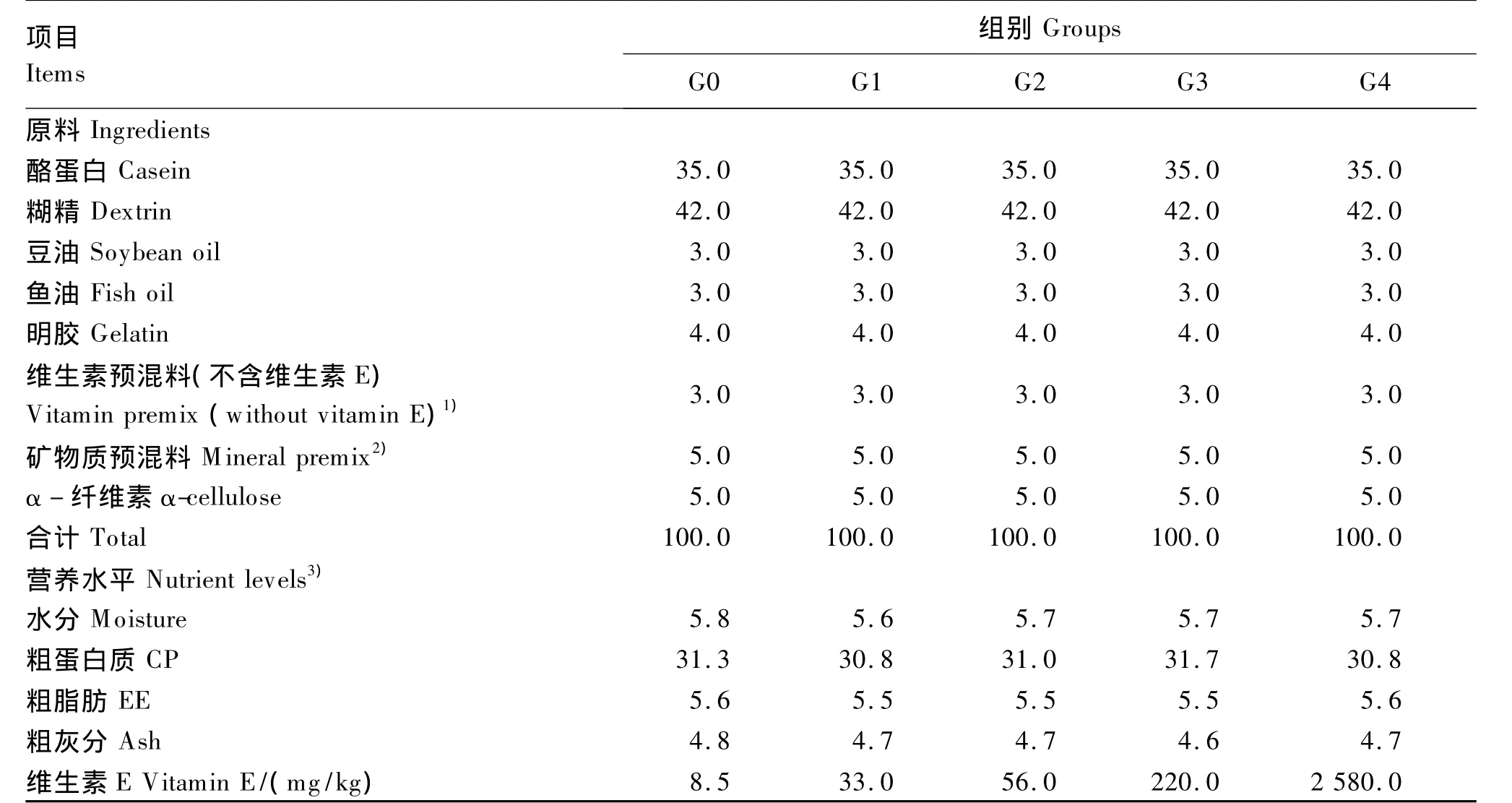
表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) %
1.3 饲养管理
试验在室内循环过滤水族箱(68 cm×48 cm×42 cm,容积约130 L)中进行,试验鱼暂养14 d,期间投喂G0组饲料。驯化结束后,将试验鱼(初始体重约为3.25 g)随机分配到20个水族箱中,每箱20尾,每天定时定量投喂饲料2次,前4周投饲率为体重的4%,后4周投饲率为体重的5%。水源为曝气自来水。试验期间水温为(26.6± 1.2)℃,pH 7.40 ~ 7.80,溶 解 氧 >5.0 mg/L,氨氮 <0.3 mg/L。每天定时吸污、换水,换水量为水族箱的1/3。试验期56 d。
1.4 样品采集
生长试验结束后,禁食24 h进行称重,然后分别采集罗非鱼的肝脏与血清。每箱随机选取6尾规格一致的试验鱼,丁香酚麻醉后解剖取肝胰脏,液氮速冻,-80℃保存。另从每箱中取8尾,尾静脉取血,在3 h内完成取血,将血液静置3 h,以5 400 r/min离心15 min,取血清,-80℃保存,用于抗氧化指标的测定。将保存于-80℃的组织样品在冰上解冻,取组织块约1 g在冰冷的生理盐水中漂洗,除去血液,滤纸吸干,称重,放入匀浆玻璃管中,按1 g样品10 mL的比例加入0.68%冰冻生理盐水,用玻璃匀浆机1.1×104r/min匀浆2次,每次 30 s,后将组织匀浆液在 4℃下3 000 r/min离心10 min,取上清液,-80℃保存。
1.5 计算与分析
1.5.1 生长性能指标计算

1.5.2 饲料营养成分分析
饲料水分含量采用105℃烘箱干燥法(GB/T 6435—1986)测定;粗蛋白质含量采用凯氏定氮法(GB/T 6432—1994)测定;粗脂肪含量采用索氏抽提法(GB/T 6433—1994)测定;粗灰分含量采用550℃灼烧法(GB/T 6438—1992)测定;维生素E含量采用高效液相色谱法(JY/T 024—1996)测定。
1.5.3 生化指标分析
采用羟胺法、钼酸铵法、比色法及芬顿(Fenton)反应测定罗非鱼肝胰脏与血清超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性及丙二醛(MDA)、羟自由基(·OH)含量,所有指标均采用南京建成生物工程研究所提供的试剂盒检测,相应操作参照说明书进行。
1.6 统计分析
数据采用SPSS 13.0软件进行one-way ANOVA方差分析,采用Duncan氏法进行多重比较,结果用平均值±标准差表示,P<0.05表示组间差异显著。
2 结果与分析
2.1 维生素E对罗非鱼幼鱼生长性能的影响
由表2可见,G4组罗非鱼幼鱼增重率、特定生长率均低于其他各组,并与G1、G3组达到显著水平(P<0.05),表现出一定的毒性效应。在其他组中,随着维生素E添加量的提高,增重率、特定生长率呈上升趋势。G3组罗非鱼幼鱼增重率、特定生长率显著高于其他4组(P<0.05)。除G3组外,各组的饲料效率差异不显著(P>0.05)。与G0组相比,各组的存活率都得到提高,其中G2、G4组显著高于 G0组(P<0.05),而其他各组之间差异不显著(P>0.05)。一定剂量的维生素E能够显著提高罗非鱼幼鱼的摄食及生长,当添加量达到最适摄入量的50倍时,可能会在一定程度上抑制其生长。
2.2 维生素E对罗非鱼幼鱼抗氧化酶活性的影响
由表3可见,血清和肝胰脏中的SOD活性均随着饲料中维生素E添加量的增加呈先升高后降低的趋势,G4组罗非鱼幼鱼的SOD活性出现大幅下降。在血清中,G4组SOD活性显著低于G2、G3组(P<0.05),与 G0、G1组差异不显著(P >0.05)。在肝胰脏中,G4组SOD活性显著低于G2组(P<0.05),与其他3组差异不显著(P>0.05)。血清CAT活性也随饲料中维生素E添加量增加呈先升高后降低的趋势,以G2组最高;G4组显著低于 G2组(P<0.05),显著高于 G0、G1组(P <0.05),与 G3组差异不显著(P >0.05)。肝胰脏CAT活性也以G2组最高,G4组显著低于G2组(P<0.05),与其他3组差异不显著(P>0.05)。
2.3 维生素E对罗非鱼幼鱼生化指标的影响
由表4可见,饲料不同的维生素E添加量对罗非鱼肝胰脏维生素E含量产生了一定的影响,表现为 G2、G3、G4组显著高于 G0、G1组(P<0.05),而G0与G1组差异不显著(P>0.05)。血清和肝胰脏的MDA含量均随维生素E添加量的增加而下降,G3和G4组显著低于G0和G1组(P<0.05)。除了G1组,血清羟自由基含量在其他4组间差异不显著(P>0.05)。肝胰脏羟自由基含量以 G4组最低,显著低于 G0、G1、G2组(P <0.05),与 G3组差异不显著(P >0.05)。
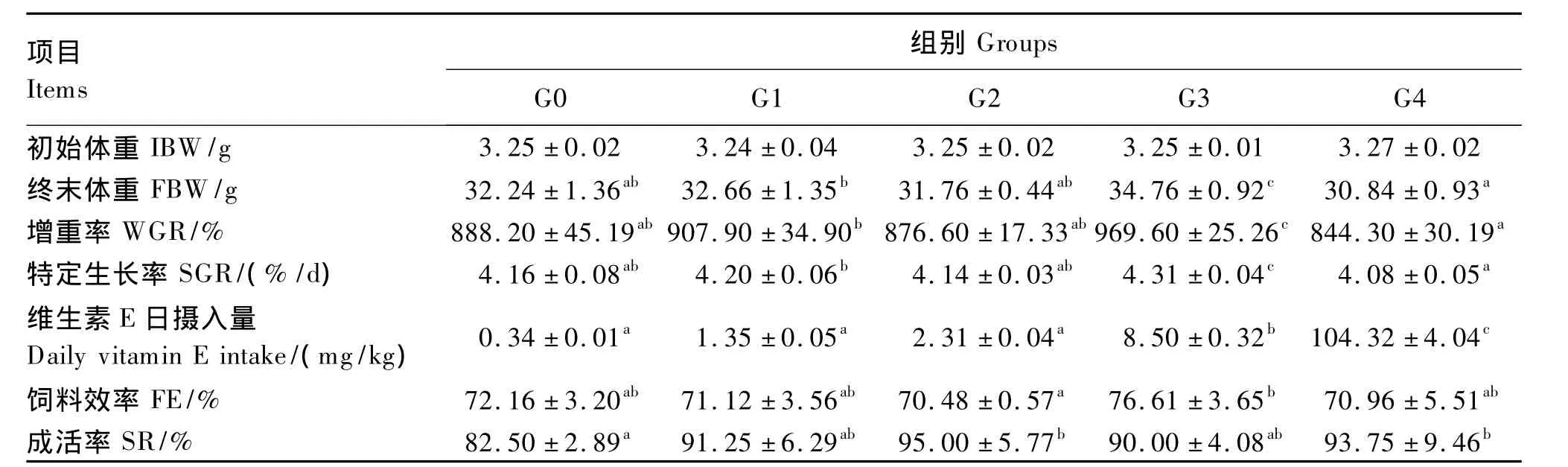
表2 维生素E对罗非鱼幼鱼生长性能的影响Table 2 Effects of dietary vitamin E on growth performance of juvenile tilapia
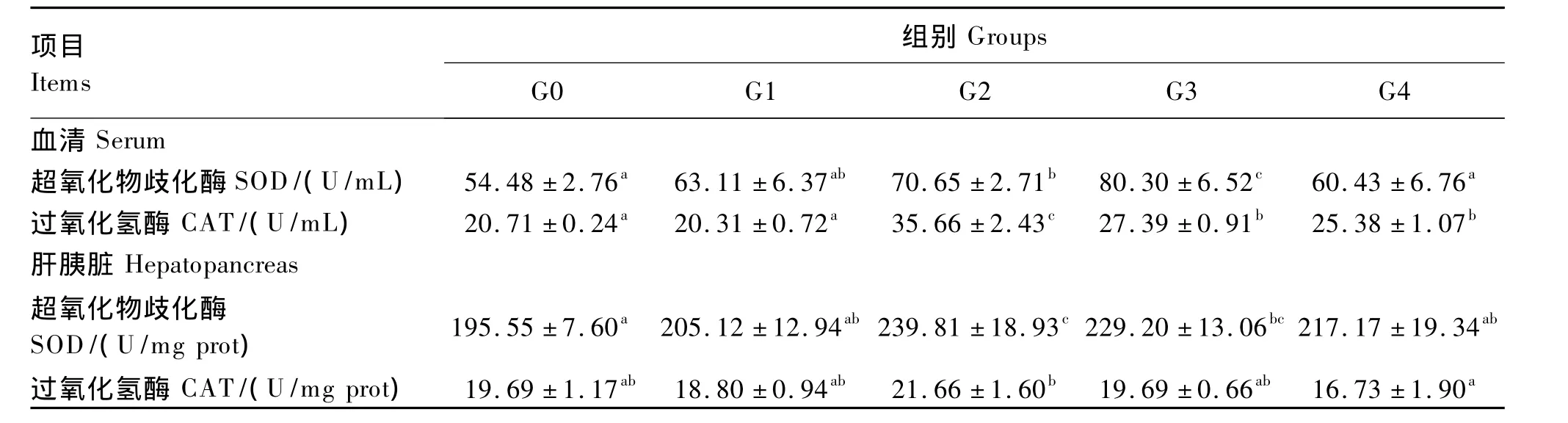
表3 维生素E对罗非鱼幼鱼血清和肝胰脏中SOD、CAT活性的影响Table 3 Effects of dietary vitamin E on activities of SOD and CAT in serum and hepatopancreas of juvenile tilapia
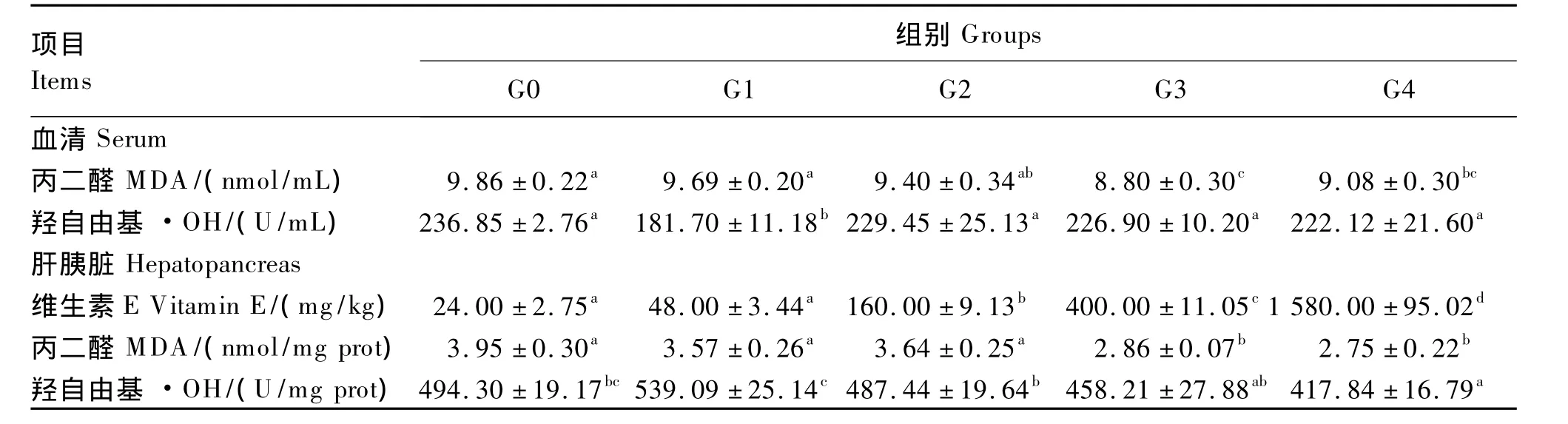
表4 维生素E对罗非鱼幼鱼血清和肝胰脏中丙二醛、羟自由基和维生素E含量的影响Table 4 Effects of dietary vitamin E on contents of MDA,·OH and vitamin E in serum and hepatopancreas of juvenile tilapia
3 讨论
3.1 饲料中维生素E的适宜添加水平
目前大多数试验中所确定的维生素E需求量是指试验期内鱼类不出现缺乏症状的最低需求量,只有少数试验是采用最佳生长或最佳免疫状态时维生素 E的适宜需求量[13-15]。越来越多的研究表明,高于最低需求量数倍的维生素E对水生动物具有促生长和提高免疫力的作用。南亚野鲮摄食150 mg/kg维生素E(5倍NRC需求量)时,其增重率达到最大值[13]。幼建鲤摄食1 500 mg/kg维生素E(15倍 NRC需求量)时,其增重率、白细胞吞噬率分别达到最大值[16]。Paul等[14]给幼印鲮投喂5个添加水平维生素E的饲料12周后,用折线法确定其最佳增重率所需维生素E水平为99 mg/kg(4倍NRC需求量)。
然而鱼体对维生素E的营养需求存在一个适宜的剂量范围,在这个范围内维生素E具有营养作用,而在这个范围之外可能会引起生长抑制、缺乏或中毒。因为维生素E是脂溶性维生素,与水溶性维生素不同,动物摄入过量的脂溶性维生素,不能在短时间内代谢并排出体外,会在体内积累,对机体产生毒害作用[17]。本研究发现,试验进行8周后,G0组的成活率低于其他各组,维生素E添加量最高的G4组则出现增重率、特定生长率低于其他组的现象,生长性能表现最好的为G3组。这与周显青等[18]、张琼[16]研究结果相似。维生素 E缺乏固然会使鱼类生长缓慢,但同时维生素E过量也不利于鱼类的生长,并可能对鱼体有毒害作用,因此需要研究鱼类对维生素E的最适需要量。
3.2 维生素E对罗非鱼幼鱼抗氧酶活性的影响
SOD、CAT是生物体内2种十分重要的具有抗氧化作用的酶,是生物体抗氧化防御系统中的重要成员。SOD是一种金属酶(辅基为金属离子),能有效地清除超氧阴离子自由基,以保护机体细胞免受攻击,而CAT能将SOD清除活性氧时产生的过氧化氢(H2O2)转化为水(H2O),保护机体细胞稳定的内环境及细胞的正常生活。大量研究表明,维生素E能够提高抗氧化酶的活性[19-21]。本试验结果与前人一致,与G0组相比,G2、G3组罗非鱼幼鱼血清和肝胰脏中SOD与CAT活性得到显著提高。但是当维生素E添加量达到2 500 mg/kg时,机体的抗氧化状态在大剂量维生素E作用下出现了变化,与G2、G3组相比,血清和肝胰脏的SOD、CAT活性均明显下降。
因此,我们认为低剂量的维生素E具有诱导产生抗氧化酶的能力,而过大剂量的维生素E则会抑制抗氧化酶的活性。Andersen[22]对大鼠的研究发现,当过大剂量维生素E作用于大鼠时,骨髓中的不成熟细胞膜的脂质过氧化水平会减少,这个情况使得某些抗氧化酶在未成熟细胞中表达下降,进而导致抗氧化酶活性下降。至于在鱼类中,维生素E与抗氧化酶是否也存在相似的剂量效应则需要进一步的探讨,特别是分子水平上的研究。
3.3 饲料中维生素E对脂质过氧化及肝胰脏维生素E含量的影响
本研究中,饲料中的维生素E添加量显著影响鱼体肝胰脏中的维生素E含量,随着饲料中维生素E添加量的增加,罗非鱼幼鱼肝胰脏中维生素E含量也相应增加。这与张永明等[23]对大鼠,Bai等[24]对许氏平,周显青等[18]对中华鳖幼鳖的研究是一致的。肝胰脏是机体最重要的器官之一,被称为机体内部的“加工厂”,对机体自身的解毒功能和代谢功能起至关重要的作用。有研究表明,饲料中过大剂量的添加剂会对机体造成损伤,而这种损伤往往会首先表现在肝胰脏组织结构上[25-26]。由于样品处理不当,本试验并没有做出罗非鱼肝胰脏组织横切图。
维生素E是最有效的生物抗氧化剂之一,能够与自由基反应,中断脂质过氧化链式反应的进行,因而组织中较高的维生素E含量往往能够有效阻止组织中的脂质过氧化反应[27]。本试验发现,随着维生素E添加量的增加,罗非鱼幼鱼肝胰脏中维生素E含量逐渐升高,羟自由基的含量逐渐下降。这说明罗非鱼肝胰脏所承受的抗氧化压力有所减轻。MDA是多不饱和脂肪酸氧化降解的主要产物之一。因而MDA可以用来反映机体内脂质过氧化的程度及间接反映细胞损伤的程度,并且MDA也是评价维生素E在抑制组织脂质过氧化有效性的一个指标[28-29]。本试验结果显示,饲料中维生素E添加量升高可以使得鱼体中MDA含量显著降低,提示饲料中添加维生素E能够有效抑制脂质过氧化,从而减轻脂质过氧化对细胞的损伤。蔡中华等[20]对幼鲤,彭士明[30]对黑鲷的研究中均发现,饲料中添加维生素E均可显著降低组织中MDA含量。但 Kaewsrithong等[9]在对香鱼的研究中发现,饲料中较多的维生素E反而会加强香鱼机体脂质过氧化的程度。原因可能是维生素E与MDA间存在某种剂量效应关系,过大剂量维生素E具有促氧化性。已经发现,某些维生素E在从机体分离出的低密度脂蛋白(LDL)中存在抗氧化剂性质[31],维生素E自由基与LDL的多不饱和脂肪酸的化学反应是这种抗氧化性质产生的原因。维生素E对脂质过氧化的调节作用,特别是其中具体的作用机制需要进一步的研究。
综合罗非鱼幼鱼的生长与生理情况,本试验中维生素E对罗非鱼幼鱼的最大未观察到有害作用剂量组为250 mg/kg组,即维生素E日摄入量8.50 mg/kg,故维生素E对罗非鱼幼鱼56 d的最大未观察到有害作用剂量值为8.50 mg/(kg·d)。
4 结论
①饲料中添加50~250 mg/kg维生素E对罗非鱼幼鱼具有促进生长的作用,但添加量达到2 500 mg/kg时,罗非鱼幼鱼出现轻微的生长抑制症状。
②高于需求量数倍的维生素E能够增强罗非鱼幼鱼的抗氧化酶活性。过大剂量维生素E虽然可以减轻鱼体的脂质过氧化反应,但会抑制抗氧化酶活性,显示一定的毒性效应。
③本试验中维生素E对罗非鱼幼鱼的最大未观察到有害作用剂量为8.50 mg/(kg·d)。
[1] 许群,王安利.营养素对水生经济动物免疫机能的影响[J].动物营养学报,2004,16(1):6 -11.
[2] HUNDHAUSEN C,BLANK R,WOLFFRAM S,et al.Effect of vitamin E and polyphenols on ochratoxin A-induced cytotoxicity in liver(HepG2)cells[J].Journal of Plant Physiology,2005,162(7):818 -822.
[3] TOCHER D,MOURENTE G,VAN D A,et al.Effects of dietary vitamin E on antioxidant defence mechanisms of juvenile turbot(Scophthalmus maximus L.),halibut(Hippoglossus hippoglossus L.)and sea bream(Sparus aurata L.)[J].Aquaculture Nutrition,2002,8(3):195 -207.
[4] 王桂芹,牛小天,闫先春,等.饲料中添加维生素E和二十二碳六烯酸对鲤鱼生长和抗病力的影响[J].上海交通大学:农业科学版,2008,28(2):125-127.
[5] 魏玉亭,麦康森,艾庆辉.饲料中的维生素E对大菱鲆幼鱼生长、脂肪过氧化及抗氧化能力的影响[J].中国海洋大学学报,2011,41(6):45 -50.
[6] 何敏,汪开毓,张宇,等.维生素E对斑点叉尾生长性能和消化酶活性的影响[J].水产学报,2009,33(2):288-294.
[7] LIM C,YILDIRM-AKSOY M,LIM H,et al.Influence of dietary levels of lipid and vitamin E on growth and resistance of Nile tilapia to Streptococcus iniae challenge[J].Aquaculture,2009,298:76 - 82.
[8] BAI S C,LEE K J.Different levels of dietary DL-αtocopherol acetate affect the vitamin E status of juvenile Korean rockfish(Sebastes schlegeli)[J].Aquaculture,1998,161:405 -414.
[9] KAEWSRITHONG J,OHSHIMA T,USHIO H,et al.Effects of an excess dose of dietaryα-tocopherol on hydroperoxide accumulation and erythrocyte osmotic fragility of sweet smelt(Plecoglossus altivelis)[J].Aquaculture Research,2001,32:191 -198.
[10] HUANG C H,CHANG R J,HUANG SL,et al.Dietary vitamin E supplementation affects tissue lipid peroxidation of hybrid tilapia(Oreochromis niloticus×O.aureus)[J].Comparative Biochemistry and Physiology:Part B,2003,134(2):265 -270.
[11] NRC.Nutrient requirements of fish and shrimp[S].Washingon,D.C.:National Academy Press,2011.
[12] EFSA.Technical guidance:tolerance and efficacy studies in target animals,prepared by the panel on additive and products or substances used in animal feed[J].The EFSA Journal,2008,778:1 - 14.
[13] SAU S K,PAUL B N,MOHANTA K N,et al.Dietary vitamin E requirement,fish performance and carcass of composition of rohu(Labeo rohita)fry[J].Aquaculture,2004,240:359 -368.
[14] PAUL B N,SARKAR S,MOHANTY S N.Dietary vitamin E requirement of mrigal,Cirrhinus mrigala fry[J].Aquaculture,2004,242:529 -536.
[15] LEE M H,SHIAU SY.Vitamin E requirements of juvenile grass shrimp,Penaeus monodon,and effects on non-specific immune responses[J].Fish and Shellfish Immunology,2004,16:475 -536.
[16] 张琼.不同水平维生素E对幼建鲤免疫功能的影响[D].硕士学位论文.雅安:四川农业大学,2004:45-56.
[17] 付京花.脂溶性维生素对皱纹盘鲍代谢反应和贝壳生物矿化影响的研究[D].博士学位论文.青岛:中国海洋大学,2005:54-62.
[18] 周显青,牛翠娟,孙儒泳.维生素E对中华鳖幼鳖生长、肝胰脏维生素E以及血清皮质醇含量的影响[J].动物学报,2002,49(1):40 -44.
[19] 朱勇飞,吴天星,张晓东.饲料维生素E对黑鲷抗氧化能力和鱼肉货架期的影响[J].水生态学杂志,2009,2(3):131 -135.
[20] 蔡中华,邢克智,董双林.维生素E对鲤鱼健康的影响[J].动物学报,2001,47:120 -124.
[21] WISE D J,TOMASSO J R,GATLIN D M,et a1.Effects of dietary selenium and vitamin E on red blood cell peroxidation,glutathione peroxidase activity and macrophage superoxide anion production Channel catfish[J].Journal of Aquatic Animal Health,1993,5(3):177-182.
[22] ANDERSEN H R.Effects of dietary alpha-tocopherol and beta-carotene on 1ipid peroxidation induced by methyl mercuric chloride in mice[J].Pharmacol Toxicol,1993,73(4):192 - 201.
[23] 张永明,李奇芬,李平.不同维生素E含量饲料对D-氨基半乳糖致大鼠肝坏死的影响[J].营养学报,1991,13(1):25 -30.
[24] BAI S C,LEE K J.Different levels of dietary DL-αtocopherol acetate affect the vitamin E status of juvenile Korean rockfish(Sebastes schlegeli)[J].Aquaculture,1998,161:405 -414.
[25] 刘海燕,郑银桦,薛敏,等.饲料中三聚氰胺对花鲈生长、生理机能及组织残留的影响[J].水生生物学报,2010,34(6):1097 -1104.
[26] 葛红云,丁建华,薛敏,等.半胱胺盐酸盐在大口黑鲈饲料中的应用及耐受性评价[J].水生生物学报,2010,34(6):1142 -1148.
[27] HUANG C H,HUANG S L.Effect of dietary vitamin E on growth,tissue lipid peroxidation and liver glutathion level of juvenile hybrid tilapia,Oreochromis niloticus× O.aureus,fed oxidized oil[J].Aquaeulture,2004,237:381 -389.
[28] 黄进,杨国宇,李宏基,等.抗氧化剂作用机制研究进展[J].自然杂志,2003,26(2):74 -78.
[29] SHAO H B,LIANG Z S,SHAO M A.Changes of anti-oxidative enzymes and MDA content under soil water deficits among 10 wheat(Triticum aestivum L.)genotypes at maturation stage[J].Colloids and Surfaces B:Biointerfaces,2005,45:7 -13.
[30] 彭士明.黑鲷(Acanthopagrus schlegeli)脂类与维生素E的营养生理研究[D].博士学位论文.上海:华东师范大学,2008:93-101.
[31] KIRSH V A,HAYES R B,MAYNE S T,et al.Supplemental and dietary vitamin E,beta-carotene,and vitamin C intakes and prostate cancer risk[J].Journal of the National Cancer Institute,2006,98(4):245 -254.

