枯草芽孢杆菌对免疫和未免疫黄河鲤免疫功能和抗病力的影响
殷海成 赵红月 黄 进 贾 峰
(河南工业大学生物工程学院,郑州 450001)
黄河鲤是河南省水产科学研究院自1985年经连续8代的系统选育而培养出的优良养殖品种(品种登记号:GS01-001-2004)。近10年来,随着黄河鲤养殖的迅速发展,各种病害也随之增加,使得抗生素的使用逐渐增多,危害人类健康。枯草芽孢杆菌(Bacillus subtilis)是被农业部认定的鱼类饲料益生菌添加剂,因其具有无残毒、无抗药性、不污染环境等优点在水产养殖业中被广泛使用。Shen等[1]对大菱鲆(Scophthatmus maximus)仔鱼、Ziaei-Nejad等[2]对印度明对虾(Fenneropenaeus indicus)、Nayak 等[3]对露斯塔野鲮(Labeo rohita)的研究均表明,在饲料中添加枯草芽孢杆菌能提高免疫功能,增强抗病力。目前,有关枯草芽孢杆菌对黄河鲤免疫功能和抗病力的研究较少。因此,本试验拟在黄河鲤饲料中添加枯草芽孢杆菌,探讨其对免疫和未免疫黄河鲤免疫功能和抗病力的影响,为枯草芽孢杆菌在该鱼种养殖中的应用提供理论依据。
1 材料与方法
1.1 抗原和吞噬原的制备
依据郭玉娟等[4]的方法分别将本实验室保存的鲤源嗜水气单孢菌(Aeromonas hydrophila,A.hydrophila)、黄色葡萄球菌(Staphylococcus aureus,S.aureus)接种在淡水琼脂(FWA)培养基中,28℃培养36 h后,富集菌株备用。然后在富集的菌株悬液中加入终浓度为0.5%的福尔马林,28℃灭活24 h,即为福尔马林灭活的A.hydrophila菌苗(抗原)和S.aureus菌体(吞噬原)。经平皿法证实菌株已被彻底灭活后,置4℃冰箱中保存备用。
1.2 试验饲料
1.2.1 菌株培养
用普通肉汤琼脂培养基,采用固体平板法培养枯草芽孢杆菌。首先将枯草芽孢杆菌(本实验室保存)从保种斜面上转接于普通肉汤琼脂培养基中,培养18 h后,再将培养的菌液接种在固体平板上,培养24 h后收集菌体,加入适量的碳酸钙载体,55℃烘干,稀释法检测菌粉活菌数,制作枯草芽孢杆菌菌粉(活菌数为1.0×1010CFU/g)。
1.2.2 饲料配制
根据鲤鱼配合饲料营养标准(SC/T 1026—1998)配制基础饲料,其组成及营养水平见表1。在基础饲料中分别添加 0、1.5 ×1011、3.0 ×1011、4.5×1011CFU/kg的枯草芽孢杆菌,制成4种试验饲料。将试验饲料中各原料充分拌匀后,用SZLH系列高档水产制粒机(洛阳市洛达特机械设备有限公司)加工成直径为2.0 mm的颗粒饲料,于45℃下烘干,-4℃保存备用。
1.3 试验设计与饲养管理
试验用黄河鲤购于河南省水产科学研究院种鱼繁殖场。选择体格健壮、平均体重为(35.36±0.46)g的黄河鲤1 920尾,随机分为8组(Ⅰ~Ⅷ组),每组设3个重复,每个重复80尾,以重复为单位饲养于规格为2 m×2 m×1 m的水泥池中。以0.65%的无菌生理盐水将灭活的 A.hydrophila菌苗浓度调整为1×108mL-1后,对Ⅰ~Ⅳ组试验鱼以0.2 mL/尾的剂量进行腹腔注射,作为免疫组;Ⅴ~Ⅷ组试验鱼以0.2 mL/尾的剂量腹腔注射无菌生理盐水,作为对照组。免疫注射后,试验鱼分别投喂枯草芽孢杆菌添加量为0(Ⅰ、Ⅴ组)、1.5 ×1011(Ⅱ、Ⅵ组)、3.0 ×1011(Ⅲ、Ⅶ组)、4.5×1011CFU/kg(Ⅳ、Ⅷ组)的试验饲料;投喂28 d后,所有试验鱼均改投Ⅰ或Ⅴ组的试验饲料,即基础饲料。
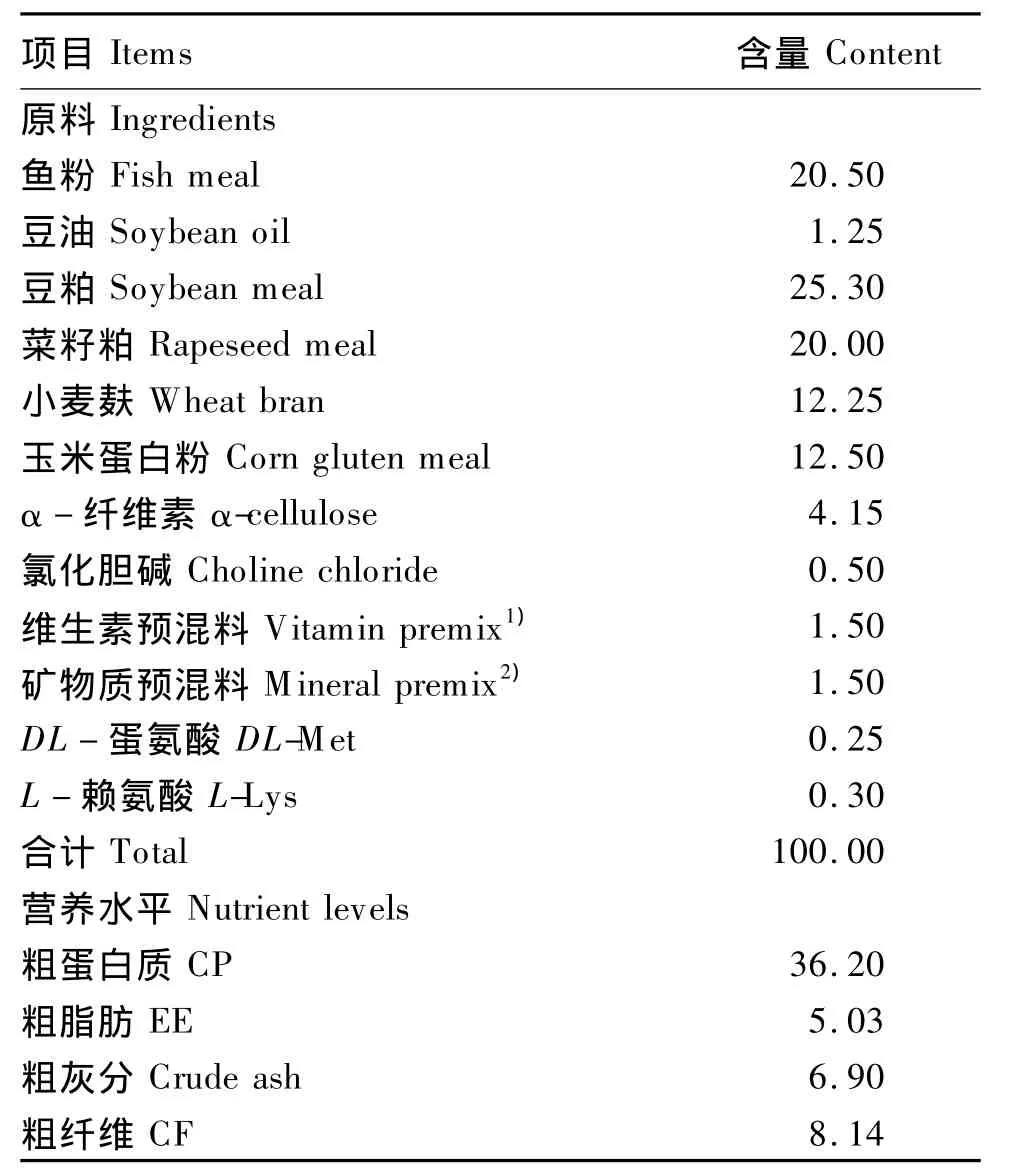
表1 基础饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
试验鱼分组后先驯养2周,再进行为期56 d的正式试验,试验于2012年7月1日开始,至2012年8月25日结束。在整个试验期间,水质为曝气自来水,采用自动循环微流水系统,保持溶氧6.0 mg/L,pH 6.8 左右。每日饲喂 2 次(08:00—08:30、17:30—18:00),每日投喂量为鱼体重的4.0% ~4.5%。
1.4 样品采集
于投喂枯草芽孢杆菌前(第0天)和投喂后的第7、14、21、28天及停止投喂枯草芽孢杆菌后的第7、14天(即试验第35、42天)的相同时间内进行血样收集。每重复取6尾鱼,尾动脉取血;取血后,将每尾鱼的血液分成2份,1份置室温1 h,再置4℃冰箱内4 h,以3 000 r/min离心15 min分离血清,供检测溶菌酶活性;另1份以肝素抗凝,供测定白细胞吞噬活性。在相同时间以同样方法对每重复4尾鱼取血制备抗血清,用于测定血清抗体效价。
1.5 指标测定
1.5.1 白细胞吞噬活性测定
参照孟小亮等[5]介绍的方法统计细胞数,并按下式计算白细胞的吞噬百分比(phagocytic percentage,PP)和吞噬指数(phagocytic index,PI)。
PP(%)=(100个白细胞中参与吞噬的细胞数/100)×100;
PI=被吞噬的细菌数/吞噬细菌的细胞数。
1.5.2 血清溶菌酶活性测定
采用溶菌酶试剂盒(南京建成生物工程研究所产品)测定。
1.5.3 血清抗体效价测定
采用96孔V型血凝板按常规方法进行,反应抗原为福尔马林灭活的A.hydrophila菌苗。具体操作如下:取96孔微量滴定板,用微量移液管于第1孔中加入80μL生理盐水,其余各孔分别加50μL生理盐水;向第1孔中加入20μL的抗血清,吹吸混匀后取50μL加入到第2孔中,同样方法加入到第3孔中,依此类推至倒数第2孔,弃去50μL,最后1孔作为对照孔;将A.hydrophila培养液12 000 r/min离心后用等量生理盐水重悬,将菌悬液置于37℃,水浴加温0.5 h;向每个孔中加入50μL菌悬液,吹吸混匀,置于37℃培养箱中1 h,之后移至4℃冰箱12 h,用显微镜观察凝集反应的强度。
1.6 攻毒试验
于免疫后第42天采用 A.hydrophila(1×108个mL-1)对各组试验鱼进行攻毒。每组分别取试验鱼40尾进行攻毒试验,按每千克体重注射3.5 mL A.hydrophila活菌悬液计算,经胸鳍基部注射0.2 mL(体重不同时,进行微调)。饲养观察14 d后统计各组的死亡率,依下式计算免疫保护率。
免疫保护率(%)=[1-(免疫组死亡率/对照组死亡率)]×100。
1.7 数据处理
试验数据以平均值±标准差表示。采用STATISTIC 6.0软件进行双因素方差分析,采用Duncan氏法进行多重比较,组间差异显著性水平为0.05。
2 结果与分析
2.1 枯草芽孢杆菌对免疫和未免疫黄河鲤白细胞吞噬活性的影响
由表2可知,在投喂枯草芽孢杆菌前4个注射抗原的免疫组黄河鲤白细胞PP和PI无显著差异(P >0.05);投喂枯草芽孢杆菌后第 7、14、21、28天,Ⅱ、Ⅲ、Ⅳ组的白细胞PP、PI均显著高于Ⅰ组(P<0.05),而Ⅱ、Ⅲ、Ⅳ组之间差异不显著(P>0.05);投喂枯草芽孢杆菌后第14天,Ⅱ、Ⅲ、Ⅳ组的白细胞PP和PI均达到最大值,分别为(63.04 ±0.44)%、(69.99 ± 2.17)%、(68.87 ±1.27)% 和 4.44 ± 0.16、4.58 ± 0.21、4.82 ±0.02;停止投喂枯草芽孢杆菌后第7、14天,Ⅱ、Ⅲ、Ⅳ组的白细胞PP和PI虽较停喂前均有不同程度地降低,但仍显著高于Ⅰ组(P<0.05)。上述结果说明饲料添加枯草芽孢杆菌可提高免疫黄河鲤的白细胞吞噬活性。
由表3可知,枯草芽孢杆菌对未免疫黄河鲤白细胞PP和PI的影响与对免疫黄河鲤白细胞PP和PI的影响规律完全一致,说明饲料添加枯草芽孢杆菌也能提高未免疫黄河鲤的白细胞吞噬活性;但从数值上看,同一添加量下未免疫黄河鲤白细胞PP和PI均低于免疫黄河鲤。
2.2 枯草芽孢杆菌对免疫和未免疫黄河鲤血清溶菌酶活性的影响
由表4可知,投喂枯草芽孢杆菌前4个注射抗原的免疫组黄河鲤血清溶菌酶活性无显著差异(P >0.05);投喂枯草芽孢杆菌后第 7、14、21、28天,Ⅱ、Ⅲ、Ⅳ组的血清溶菌酶活性均显著高于Ⅰ组(P<0.05),Ⅲ(第7天除外)、Ⅳ组的血清溶菌酶活性还显著高于Ⅱ组(P<0.05);投喂枯草芽孢杆菌后第14天,Ⅱ、Ⅲ、Ⅳ组的血清溶菌酶活性均达到最高值,分别为(112.04±1.12)U/mL、(118.90 ±1.70)U/mL、(124.98 ±1.79)U/mL。在停止投喂枯草芽孢杆菌后第7、14天,血清溶菌酶活性虽有所下降,但Ⅱ、Ⅲ、Ⅳ组仍均显著高于Ⅰ组(P<0.05),Ⅲ、Ⅳ组仍显著高于Ⅱ组(P<0.05)。上述结果说明饲料添加枯草芽孢杆菌可提高免疫黄河鲤的血清溶菌酶活性,且添加量为3.0 ×1011、4.5 ×1011CFU/kg时效果较佳。
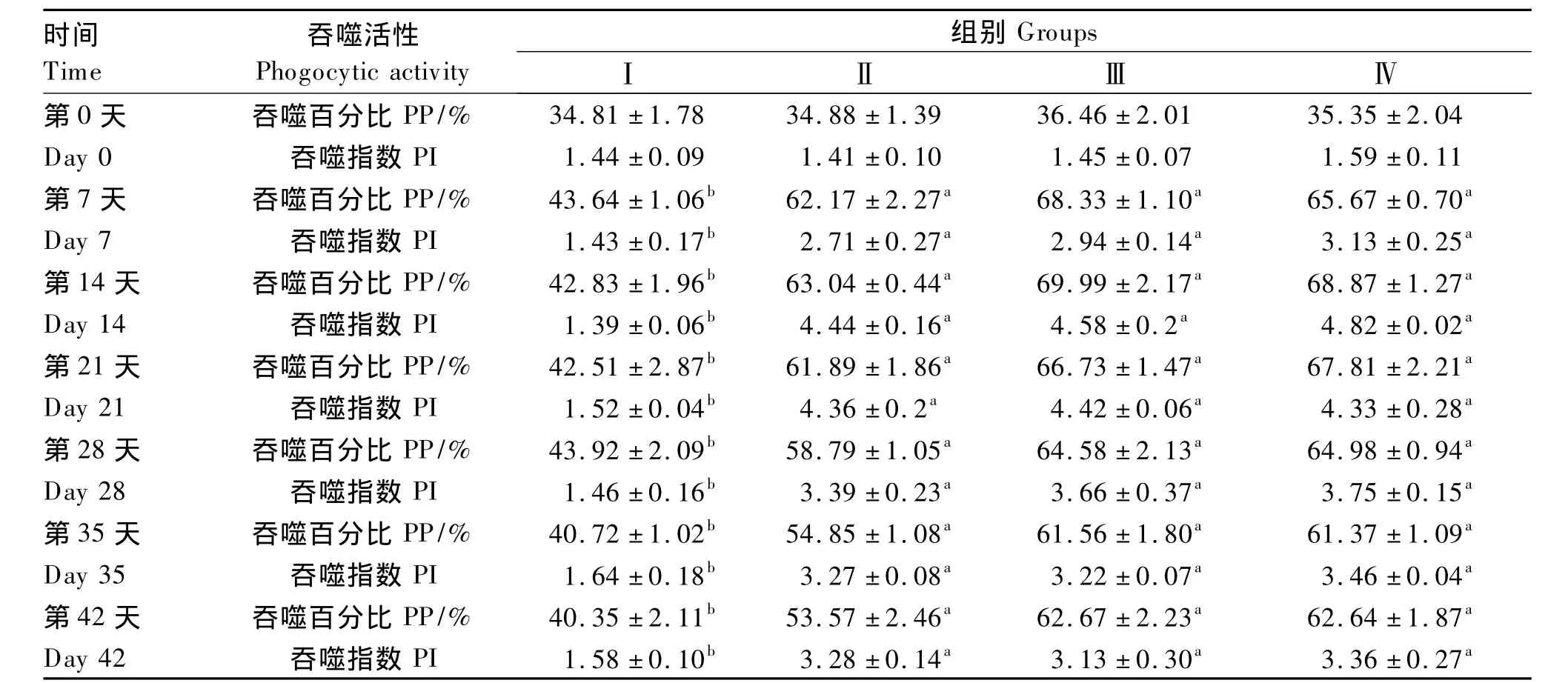
表2 枯草芽孢杆菌对免疫黄河鲤白细胞吞噬活性的影响Table 2 Effects of Bacillus subtilis on leukocytes phagocytic activity of immunized Huanghe carp(Cyprinus carpio Huanghe var.)
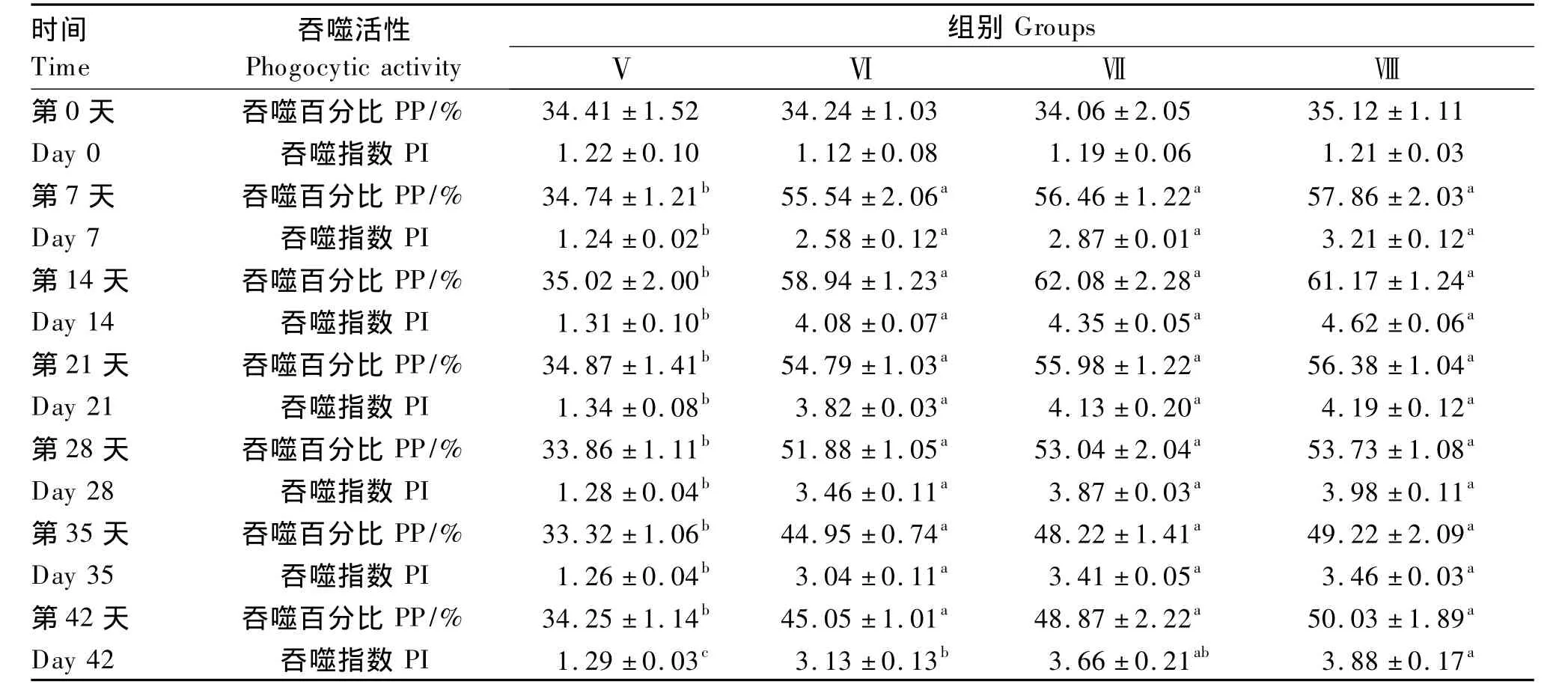
表3 枯草芽孢杆菌对未免疫黄河鲤白细胞吞噬活性的影响Table 3 Effects of Bacillus subtilis on leukocytes phagocytic activity of unimmunized Huanghe carp(Cyprinus carpio Huanghe var.)
由表5可知,枯草芽孢杆菌对未免疫黄河鲤血清溶菌酶活性的影响与对免疫黄河鲤血清溶菌酶活性的影响规律完全一致,说明投喂含枯草芽孢杆菌饲料也能提高未免疫黄河鲤的血清溶菌酶活性,以 3.0 ×1011、4.5 ×1011CFU/kg添加量为佳;但从数值上看,同一添加量下未免疫黄河鲤的血清溶菌酶活性均低于免疫黄河鲤。
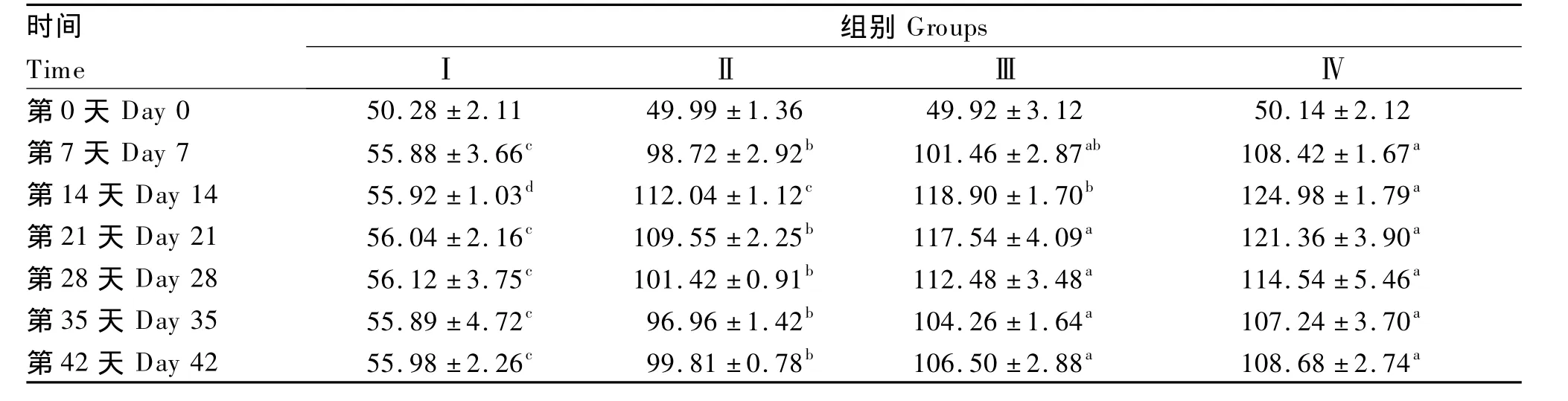
表4 枯草芽孢杆菌对免疫黄河鲤血清溶菌酶活性的影响Table 4 Effects of Bacillus subtilis on serum lysozyme activity of immunized Huanghe carp(Cyprinus carpio Huanghe var.) U/mL
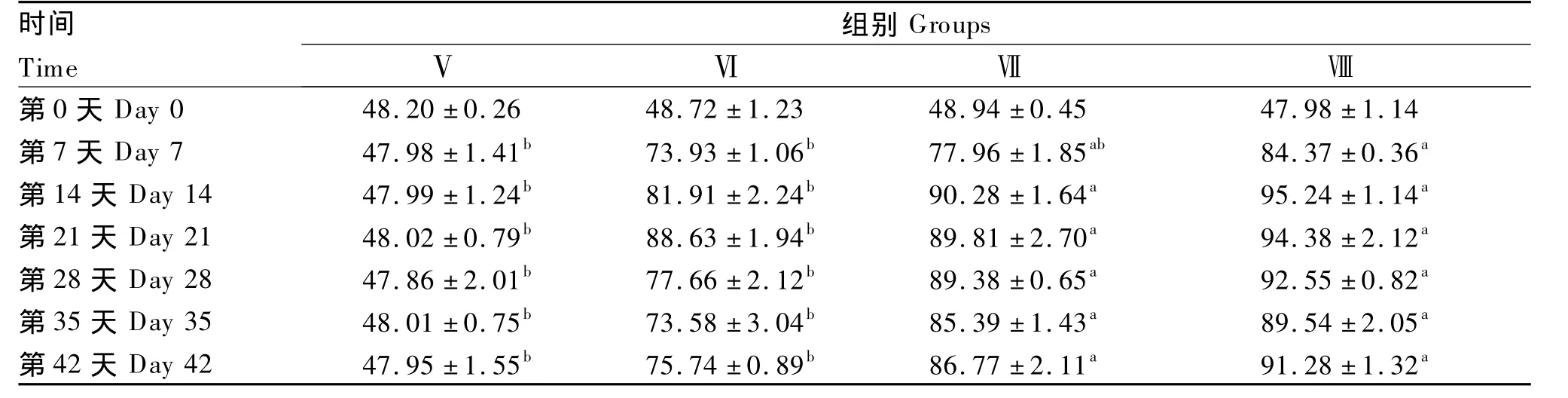
表5 枯草芽孢杆菌对未免疫黄河鲤血清溶菌酶活性的影响Table 5 Effects of Bacillus subtilis on serum lysozyme activity of unimmunized Huanghe carp(Cyprinus carpio Huanghe var.) U/mL
2.3 枯草芽孢杆菌对免疫和未免疫黄河鲤血清抗体效价的影响
由表6可知,4个注射抗原的免疫组黄河鲤的血清抗体效价随试验天数的增加逐渐上升,并均于第21天达到最高值,之后有所降低。其中,Ⅲ组黄河鲤的血清抗体效价最高,其几何平均值为486.7;其次是Ⅳ组,为 372.6;再次是Ⅱ组,为234.6;而Ⅰ组最低,为192.8。上述结果说明饲料添加枯草芽孢杆菌可提高免疫黄河鲤的血清抗体效价,且添加量为 3.0 ×1011、4.5 ×1011CFU/kg时提高效果明显。4个未注射抗原的对照组黄河鲤的血清抗体效价多为1∶<4,仅有个别个体达到1∶8。
2.4 枯草芽孢杆菌对 A.hydrophila攻毒后黄河鲤免疫保护率的影响
由表7可知,4个注射抗原的免疫组黄河鲤均获得了一定的免疫保护率,说明饲料添加枯草芽孢杆菌能提高免疫黄河鲤的免疫功能,增强抗病毒能力。当枯草芽孢杆菌添加量为4.5×1011CFU/kg时,免疫黄河鲤获得了最高的免疫保护率。
3 讨论
3.1 枯草芽孢杆菌对免疫和未免疫黄河鲤白细胞吞噬活性、血清溶菌酶活性的影响
鱼类的非特异性免疫系统在其抵抗病原菌过程中发挥着十分重要的作用,溶菌酶是非特异性免疫因子,能提高白细胞的吞噬活性[6-7]。因此,通过测定鱼类血液中白细胞吞噬活性以及血清中的溶菌酶活性,可以从一定程度上反映被测鱼类的非特异性免疫状态[8]。已有研究证实,口服枯草芽孢杆菌后,罗非鱼[9]、石斑鱼[10]、虹鳟[11]等鱼类血清溶菌酶活性均显著提高[9-11]。本研究中发现,投 喂 添 加 1.5 × 1011、3.0 × 1011、4.5 ×1011CFU/kg枯草芽孢杆菌饲料后黄河鲤的白细胞吞噬活性和血清溶菌酶活性也显著提高;而且,随着饲料中枯草芽孢杆菌添加量的升高,黄河鲤白细胞吞噬活性和血清溶菌酶活性具有上升的趋势。Marja等[12]研究表明,在一定程度上,血清溶菌酶活性与循环系统中的白细胞数量变化存在正相 关 关 系。Nayak 等[3]发 现,以 含 1.0 ×108CFU/g芽孢杆菌的饲料饲喂已感染 A.hydrophila的露斯塔野鲮(Labeo rohita)后,其白细胞数量和白细胞吞噬活性均显著提高。有研究表明,在肠道内枯草芽孢杆菌能够释放某些抗菌物质,调节肠道菌群结构与功能,同时激活肠道淋巴组织和T、B淋巴细胞,从而促进巨噬细胞吞噬与杀菌活性[13]。Tejada-Simon 等[14]研究发现,芽孢杆菌可以改善动物肠道菌群,同时提高血液中白细胞数量和白细胞吞噬活性,并增强溶菌酶活性。研究发现,枯草芽孢杆菌细胞壁的主要成分葡聚糖具有提高鱼类的非特异性免疫功能的作用[15],细胞壁的脂磷壁酸(LTA)和肽聚糖、磷壁酸复合物也具有很强的免疫佐剂活性作用,能够提高鱼类的免疫力[16]。潘康成等[13]研究认为,饲用芽孢杆菌可提高水产动物免疫识别力,诱导T、B淋巴细胞和巨噬细胞产生细胞因子,通过淋巴细胞再循环而活化全身免疫系统,从而增强机体的非特异性和特异性免疫功能。
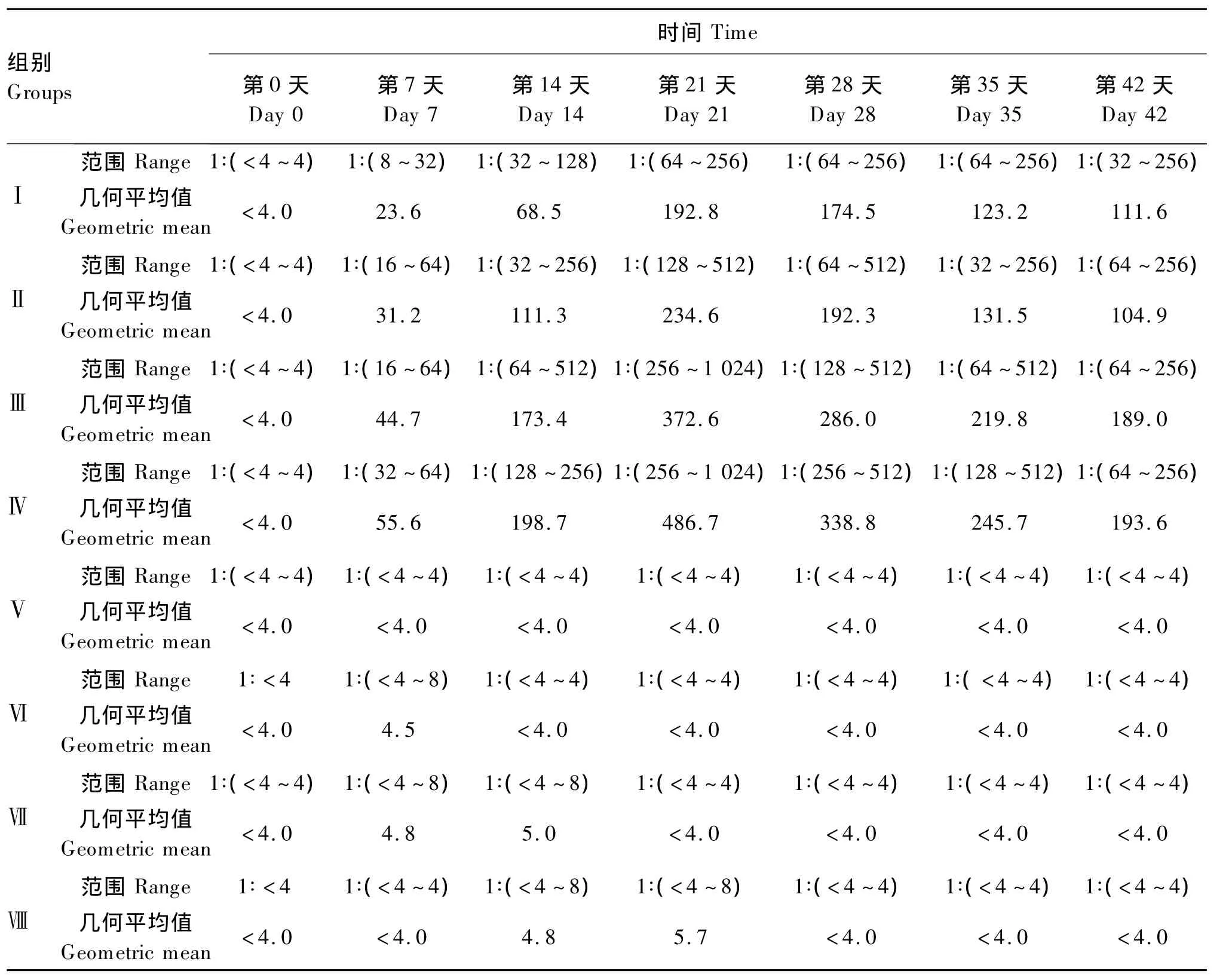
表6 枯草芽孢杆菌对免疫和未免疫黄河鲤血清抗体效价的影响Table 6 Effects of Bacillus subtilis on serum antibody titer of immunized and unimmunized Huanghe carp(Cyprinus carpio Huanghe var.)
安利国等[17]利用 A.hydrophila灭活苗免疫鲤鱼,结果发现鲤鱼的溶菌酶活性和白细胞吞噬活性显著提高。这与本试验结果相同,而本试验还发现投喂枯草芽孢杆菌后,注射抗原的免疫组黄河鲤的白细胞吞噬活性和血清溶菌酶活性均显著高于未注射抗原的对照组黄河鲤,说明枯草芽孢杆菌和疫苗对黄河鲤的非特异性免疫力的提高具 有 协 同 作 用。Rajesh等[18]研 究 发 现,经A.hydrophila疫苗免疫后的露斯塔野鲮,再投喂含枯草芽孢杆菌的饲料后鱼体非特异性免疫指标亦显著提高。类似结果在虹鳟(Oncorhynchus mykiss)[10,19]的研究中也得到验证。
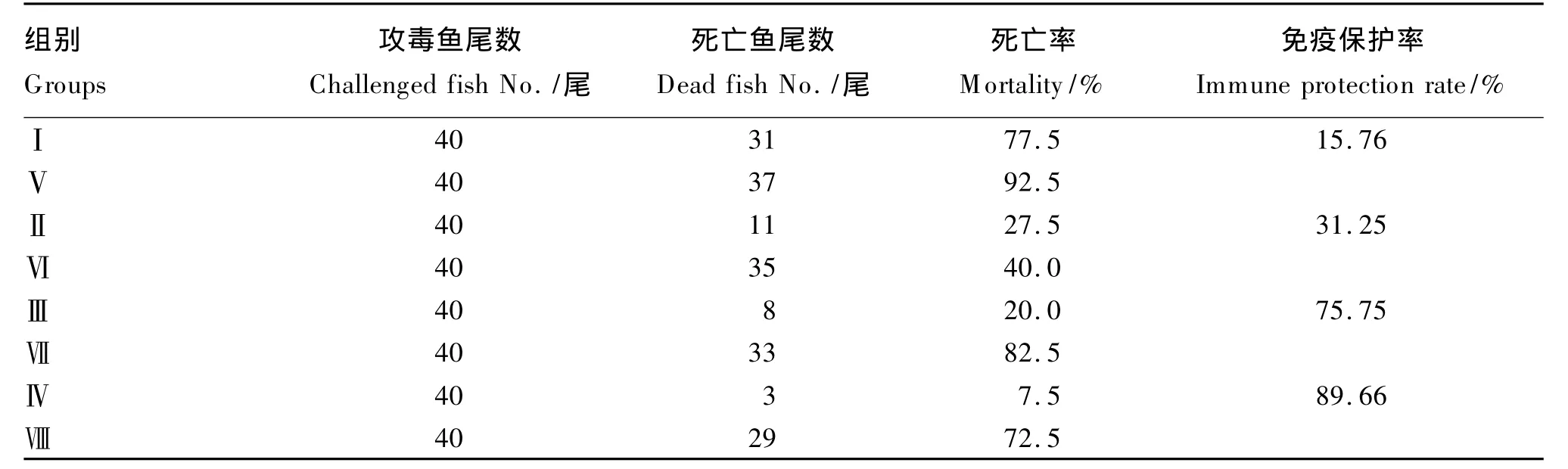
表7 A.hydrophila攻毒后黄河鲤的死亡率和免疫保护率Table 7 Mortality and immune protection rate of Huanghe carp(Cyprinus carpio Huanghe var.)after challenged with A.hydrophila
3.2 枯草芽孢杆菌对黄河鲤血清抗体效价及免疫保护率的影响
益生菌或多糖具有提高水产动物免疫保护和机体抗体水平的作用已有很多报道[20]。Rajesh等[18]研究证明枯草芽孢杆菌具有良好的佐剂作用:鲤鱼经A.hydrophila疫苗免疫后,再投喂枯草芽孢杆菌,其先天免疫功能明显增强。孙建和等[21]将A.hydrophila外毒素与多糖偶联免疫鲫后发现其血清抗体出现早,抗体效价高且持续时间长。从本试验结果看,注射抗原的黄河鲤白细胞吞噬活性和血清溶菌酶活性增强效果高于未注射抗原的黄河鲤,血清抗体效价和存活率也有明显提高,表明枯草芽孢杆菌与A.hydrophila疫苗联合使用效果优于单独使用疫苗。但也有文献报道A.hydrophila对鱼类免疫保护率低的现象[22]。Post[23]给虹鳟注射不加佐剂的热灭活 A.hydrophila 疫苗,免疫保护率为 62.5%;Schacte[24]采用皮下注射A.hydrophila免疫斑点叉尾,免疫保护率只有37.5%。这种免疫保护率的差异可能与A.hydrophila菌种的差异有关。Schroer等[25]研究发现,采用2种不同的A.hydrophila菌株制成的免疫疫苗,一种A.hydrophila 60对鲤鱼的肠道黏膜免疫具有明显的促进作用,而另外一种A.hydrophila 38则明显破坏了试验鱼的肠道黏膜结构,降低了鱼类对致病菌的抵抗能力。此外,疫苗对试验鱼免疫保护作用的差异与试验鱼之间存在较高的相关性。Ardó等[26]的研究就证实,即使同为鲤鱼,亦存在 A.hydrophila敏感系和 A.hydrophila抵抗系的区别,且这2种类型的鲤鱼在基因上存在较大差异。
4 结论
饲料添加枯草芽孢杆菌可提高免疫和未免疫黄河鲤的免疫功能和抗病力,建议添加量为3.0~4.5 ×1011CFU/kg。
[1] SHEN W Y,FU L L,LI W F,et al.Effect of dietary supplementation with Bacillus subtilis on the growth,performance,immune response and antioxidant activities of the shrimp(Litopenaeus vannamei)[J].Aquaculture Research,2010,41:1691 -1698.
[2] ZIAEI-NEJAD S,REZAEI M H,TAKAMI G A,et al.The effect of Bacillus sp.bacteria used as probiotics on digestive enzyme activity,survival and growth in the Indian white shrimp Fenneropenaeus indicu[J].Aquaculture,2006,252:516 -524.
[3] NAYAK S K,SWAIN P,MUKHERJEE S C.Effect of dietary supplementation of probiotic and vitamin C on the immune response of Indian major carp,Labeo rohita[J].Fish & Shellfish Immunology,2007,23(4):892-896.
[4] 郭玉娟,陈学年.肽聚糖对鲫鱼嗜水气单胞菌灭活疫苗免疫增强效果的研究[J].中国兽医科学,2006,36(1):33 -36.
[5] 孟小亮,陈昌福,吴志新,等.嗜水气单胞菌3种疫苗对斑点叉尾免疫原性比较研究[J].淡水渔业,2009,39(14):49 -53.
[6] AMAR E C,KIRON V,SATOH S,et al.Enhancement of innate immunity in rainbow trout(Oncorhynchus mykiss Walbaum)associated with dietary intake of carotenoids from natural products[J].Fish & Shellfish Immunology,2004,16:527 -537.
[7] ZHOU X,TIAN Z,WANG Y,et al.Effect of treatment with probiotics as water additives on tilapia(Oreochromis niloticus)growth performance and immune response[J].Fish Physiology and Biochemistry,2010,36:501 -509.
[8] 大野尚仁.βグルカンの生体防御系修饰作用[J].日本细菌学杂志,2000,55(3):527 -537.
[9] ALY SM,ABDEL-GALIL A Y,ABDEL-AZIZ G A,et al.Studies on Bacillus subtilis and Lactobacillus acidophilus,as potential probiotics,on the immune response and resistance of Tilapia nilotica(Oreochromis niloticus)to challenge infections[J].Fish & Shellfish Immunology,2008,25:128 -136.
[10] YANG H L,SUN Y Z,MA R L,et al.PCR-DGGE analysis of the autochthonous gut microbiota of grouper Epinephelus coioides following probiotic Bacillus clausii administration[J].Aquaculture Research,2011.doi:10.1111/j.1365 -2109.2011.02852.X.
[11] NEWAJ-FYZUL A,ADESIYUNA A,MUTANI A,et al.Bacillus subtilis AB1 controls Aeromonas infection in rainbow trout(Oncorhynchus mykiss Walbaum)[J].Journal of Applied Microbiology,2007,103(5):1669-1706.
[12] MARJA M,ANTTI S.Changes in plasma lysozyme and blood leucocyte levels of hatchery-reared Atlantic salmon and sea trout(Salmo tuotta L)during parrsmolt transformation[J].Aquaculture,1992,106:75-87.
[13] 潘康成,杨汉博.饲用芽孢菌作用机理的研究进展[J].饲料工业,1997,18(9):32 -34.
[14] TEJADA-SIMON M V,PESTKA J J.Proinflammatory cytokine and nitric oxide induction in murine macrophages by cell wall and cytoplasmic extracts of lactic acid bacteria[J].Journal of Food Protection,l999,62(12):1435-1444.
[15] ANDERSON D P.Immunostimulants,adjuvants,and vaccine in fish:applications to aquaculture[J].Annual Review of Fish Diseases,1992,2:281 -307.
[16] HIMANEN J P,SARVAS M,HELANDER I M.Assessment of non-protein impurities in potential vaccine proteins produced by Bacillus subtilis[J].Vaccine,1993,11(9):970 -973.
[17] 安利国,冯程强,邢维贤,等.灭活疫苗对鲤鱼血清溶菌酶和腹腔吞噬细胞活性的作用[J].山东师范大学学报:自然科学版,1999,l4(2):175 -179.
[18] RAJESH K,MUKHERJEE SC,RITESH R,et al.Enhanced innate immune parameters in Labeo rohita(Ham.)following oral administration of Bacillus subtilis[J].Fish & Shellfish Immunology,2008,24(2):168-172.
[19] MERRIFIELD D L,DIMITROGLOU A,BRADLEY G,et al.Probiotic applications for rainbow trout(Oncorhynchus mykiss Walbaum):Ⅱ.Effects on growth performance,feed utilization,intestinal microbiota and related health criteria postantibiotic treatment[J].Aquaculture Nutrition,2010,16(5):496 -503.
[20] NIKL L,ALBRIGHT L J,EVELYN T P T.Influence of seven immunostimulants on the immune responses of coho salmon to Aeromonas salmonicida[J].Diseases Aquactic Organisms,1991,12:7 -12.
[21] 孙建和,严亚贤,陈怀青.嗜水气单胞菌亚单位疫苗的研制[J].中国兽医学报,1996,16(1):11 -15.
[22] MICHEL C B,FAIVTE B.Occurrence and significance of agglutinating antibodies in experimental forunculosis of rainbow trout,Salmo gairdneri[J].Journal of Fish Diseases,1982,5:429 -432.
[23] POST G.Response of rainbow trout to antigens of Aeromonas hydrophila[J].Journal of the Fisheries Research Board of Canada,1966,23:1487 -1494.
[24] SCHACTE J H.Studies on the immunization of the channel catfish against two bacterial pathogens[D].Ph.D.Thesis.Auburn,A.L.:Auburn University,1976:81-89.
[25] SCHROERS V,VAN DER MAREL M,NEUHAUS H,et al.Changes of intestinal mucus glycoproteins after peroral application of Aeromonas hydrophila to common carp(Cyprinus carpio)[J].Aquaculture,2009,288(3/4):184 -189.
[26] ARDÓ L,JENEY Z,ADAM A,et al.Immune responses of resistant and sensitive common carp families following experimental challenge with Aeromonas hydrophila[J].Fish & Shellfish Immunology,2010,29(1):111-116.

