分光光度计法测定磷脂酶A1酶活条件优化
苏燕南,薛正莲,马琦亚,王 洲,赵世光
(安徽工程大学生物与化学工程学院,安徽芜湖 241000)
磷脂酶A1是一类专一性水解卵磷脂sn-1位酰基的酶类,属于脂肪酶的一种[1]。磷脂酶A1可用于植物油脱胶。相对于传统的物理和化学脱胶方法,酶法脱胶可以大大降低能耗和污染,且效率高,是一种绿色环保高效的脱胶方法[2]。目前,用于油脂脱胶的磷脂酶A1为诺维信公司生产的Lecitase Ultra(E.C.3.1.1.3)[3]。磷脂酶 A1 酶活检测主要是检测磷脂酶A1水解卵磷脂过程中脂肪酸的生成速度,有滴定法、比色法和气相色谱法。滴定法是通过滴定消耗的碱量来计算脂肪酸的产量。比色法则是将特定的底物与脂肪酸结合后,通过测定吸光度值来测量其含量[4]。气相色谱法则是通过将酶反应生成的脂肪酸甲酯化后测定脂肪酸甲酯的含量[5]。滴定法是现在通用的脂肪酶的测定方法,但是酶反应需要在一定的缓冲体系中进行,而脂肪酸是弱酸,会影响滴定结果的准确度,而且碱滴定终点的控制要非常精确,否则对于酶活高的样品会产生较大的误差。虽然酸碱自动滴定仪也可以避免实验误差的产生,但是一次只能测定一个样品,耗时长。气相色谱法是相对比较精确的方法,但是样品处理繁复,耗时长,一般用于定性实验。采用醋酸铜络合法可以避免碱滴定过程中缓冲液的影响,并且不存在滴定终点的问题。铜皂-分光光度计法用于脂肪酶酶活的测定已经比较成熟[6]。笔者在前期的实验中比较了滴定法、双层平板法和分光光度计法3种测定方法,发现分光光度计测定磷脂酶A1用时短,精确度高,而且底物消耗量小[7],因此采用分光光度计法测定磷脂酶A1酶活具有很大的优势。但目前还没有关于分光光度计法测定磷脂酶A1酶活条件优化的相关报道。本文对影响分光光度计法测定磷脂酶A1酶活过程中的主要因素进行了单因素和正交实验,并找出测定条件的最佳组合,以期提供一种快速精确检测磷脂酶A1酶活的方法。
1 材料与方法
1.1 实验材料与仪器
Lecitase Ultra,购自Novozymes公司;卵磷脂,购自生工生物工程(上海)有限公司;棕榈酸,购自Sigma公司;其他化学试剂购自国药集团化学试剂有限公司。仪器包括FJ-200高速均质机、SK-1快速混匀器、723分光光度计、pH计等。
1.2 主要溶液的配制
1)底物的配制。根据所需配制的底物浓度,称取一定量的卵磷脂,溶于相应的缓冲液中,加入终浓度为25 mM的CaCl2和0.02%脱氧胆酸钠,高速均质机10 000 r/min处理15 min。
2)酶溶液的配制。取一定量原酶,用相应缓冲液稀释至所需倍数。
3)吡啶-铜盐显色剂的配制。5.0%醋酸铜水溶液,用吡啶调节pH值至6.1。
4)棕榈酸异辛烷溶液的配制。精确称取0.256 4 g棕榈酸溶于100 mL异辛烷中,配制10 μmol/mL的母液,用此母液分别配制 0.6、1.2、1.8、2.4、3.0、3.6、4.2、4.8 μmol/mL 的棕榈酸异辛烷溶液。
5)终止酶反应溶液配制。6 mol/L HCl:取12 MHCl 50mL加入50 mL蒸馏水即得。0.4M三氯乙酸(TCA):称取6.54 g TCA溶于100 mL蒸馏水中即得。
1.3 酶活测定
1)棕榈酸铜皂标准曲线。取5.00 mL棕榈酸异辛烷加入1.00 mL铜盐显色剂溶液,充分混匀90 s,常温静置5 min至上层清澈,取3 mL上层清液714 nm测定吸光度值,空白组为相同处理的异辛烷溶液。
2)酶活测定步骤。25 mL具塞试管中加入2.00 mL一定浓度的卵磷脂底物和2.5 mL的缓冲液,40℃预热5 min,加入0.5 mL酶液,混匀后40℃恒温振反应15 min,快速加入终止反应溶液终止反应,混匀后加入3 mL异辛烷,充分震荡混匀90 s,65℃ 静置分层,常温冷却5 min,取上层清液1.00 mL加4 mL异辛烷和1 mL吡啶-铜盐显色剂,振荡混匀90 s,静置澄清后,取上层有机相714 nm检测吸光度。空白组为先加入酶反应终止反应液再加入酶液,其他操作相同。在用0.4 M TCA和6 M的HCl终止反应时,将65℃ 静置分层步骤改为12 000 r/min离心5 min,其他操作相同。
3)磷脂酶A1酶活力单位定义及计算公式。在一定条件下,1 min内生成1 μmol棕榈酸所需的磷脂酶A1的量定义为1个酶活单位。计算公式为
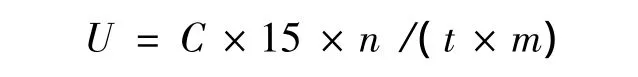
式中:U为磷脂酶A1酶活(U/mL);15为脂肪酸稀释倍数;C为棕榈酸浓度(μmol/mL);n为酶液稀释倍数;t为酶反应时间(min);m为酶用量(mL)。
2 实验结果与分析
2.1 标准曲线的绘制
脂肪酸会与铜盐形成铜皂,而且在pH值为6.0~6.2时,铜皂在710±10 nm处吸收峰最强,因此,需要用吡啶调节醋酸铜溶液的 pH值为6.1[6,8]。由于磷脂酶 A1水解磷脂的主要脂肪酸产物为棕榈酸[9],因此,选用棕榈酸异辛烷溶液制作标准曲线。如图1所示,标准曲线方程为y=0.096 5x-0.004 7,相关系数为0.999 2,线性关系良好,可以用于计算溶液中脂肪酸的含量。由图1可看出,在棕榈酸浓度增大过程中,数据的误差明显增大,而且在棕榈酸浓度超过3.6 μmol/mL时,测得的吸光度数值偏差很大,且不在线性范围内,因此在测定磷脂酶A1酶活时,酶反应液中的脂肪酸浓度不宜超过3.6 μmol/mL,可以推算该标准曲线适应的酶活范围为:稀释后酶活小于等于7.2 U/mL。

图1 棕榈酸铜皂标准曲线
2.2 底物浓度对酶活的影响
卵磷脂本身在水中的溶解度较小,常规方法只能配置5%浓度的乳液[3],但是在高速均质机的作用下,同时加入乳化剂脱氧胆酸钠,卵磷脂溶液的浓度可以达到10%。分别取2%、4%、6%、8%和10%的卵磷脂作为底物测定稀释至1 000倍的Lecitase Ultra的磷脂酶A1酶活力,缓冲液pH值为7.0,离子强度为0.05 M,酶失活方式为加入6 mL 95%乙醇。如图2所示,当底物浓度在2%~6%时,测得的酶活数据随着底物浓度的上升而上升,而当浓度高于6%时,酶活力值的增幅减小,应该是由于底物在此时已经达到饱和。综合考虑节约材料和酶活较高,后续单因素实验的最佳底物浓度选择8%。

图2 底物浓度对酶活的影响
2.3 酶液稀释倍数对酶活测定的影响
根据本文2.1节中的标准曲线预测标准曲线适用范围为:稀释后酶活小于等于7.2 U/mL,因此选择酶液的稀释倍数分别为为200倍、500倍、1 000倍、1 500倍和2 000倍,底物浓度为8%,缓冲液pH值为7.0,离子强度为0.05 M,酶失活方式为加入6 mL 95%乙醇。如图3所示,在稀释倍数为1 000倍时,测定的酶活力最高,在稀释200倍和500倍时,由于酶反应液中的棕榈酸浓度过高,测得的OD值较高偏差很大,而在稀释倍数上升时,尤其在达到2 000倍时,测得的OD值数值低于0.1,因此误差也较大。所以最终选择1 000倍作为最佳稀释倍数。
2.4 pH值对酶活的影响
为了考察pH值对酶活的影响,分别配制了一系列pH值的缓冲液,用于稀释酶液和进行酶反应。pH 值梯度设定为4、4.5、5、5.5、6、6.5、7、7.5和8。底物浓度为8%,酶液稀释1 000倍,缓冲液离子强度为0.05 M,加入6 mL 95%乙醇终止酶反应。如图4所示,pH值对酶活的影响比较大。在pH值较低时,酶活明显受抑制,在pH值为6.0时达到最高值,之后随着pH值的上升,酶活略有下降。因此,用于稀释酶液和进行酶反应的pH值设定为6.0。

图3 稀释倍数对酶活测定的影响
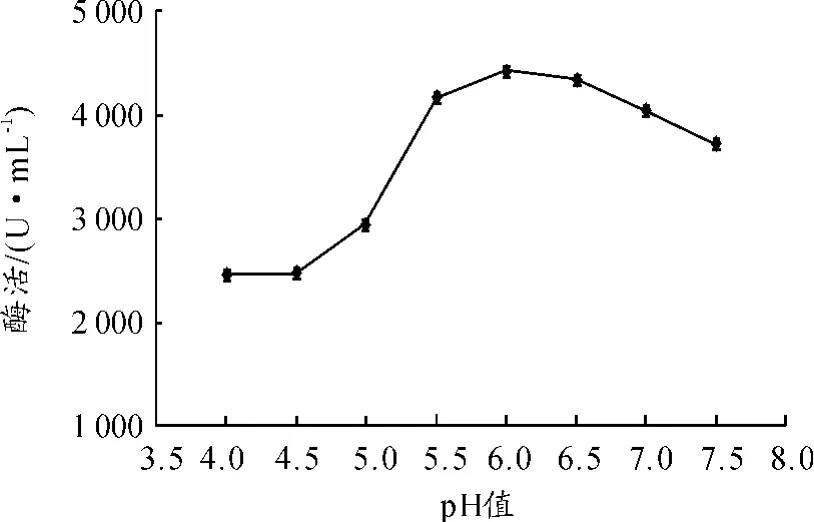
图4 pH值对酶活的影响
2.5 缓冲液离子强度对酶活的影响
由本文2.4节的实验结果可知,Lecitase Ultra磷脂酶A1对酸的耐受力较差,而磷脂酶A1水解卵磷脂会产生脂肪酸,使反应体系的pH值下降,因此反应体系系中的pH缓冲能力不能太弱,而缓冲能力太强势必会引入大量的离子,也可能会影响酶,因此需要考察缓冲液的离子强度对酶活力的影响。分别配制离子强度为100、50、10和5 mM的pH值为6.0的缓冲液稀释酶液和用于酶反应,底物浓度为8%,酶稀释倍数为1 000倍,终止反应采用加入6mL 95%乙醇的方法。如图5所示,离子强度为50 mM时酶活力最高,离子强度为100 mM时测得的酶活较低,可见较强的离子强度对酶存在一定的影响,而离子强度较低时酶活也会变低,可能与反应体系的pH值下降有关。
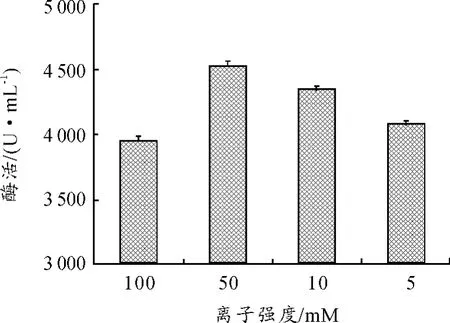
图5 离子强度对酶活的影响
2.6 酶失活方式对酶活的影响
实验过程中还发现反应终止时酶失活的方式对测得的OD值存在一定影响。在使用乙醇失活时,某些反应液会出现乳浊现象,OD异常,因此尝试了几种常用的酶失活的办法:加入6 mL 95%乙醇、1 mL 6M HCl、1 mL 0.4M TCA 以及 100 ℃ 加热20 min,分别评估最后的酶活,希望可以得到相对稳定的且较高的值。每组设置空白组,为先加失活剂再加入酶液,其他条件相同。在使用HCl和TCA使酶失活时,会产生大量絮状物,加入异辛烷,65℃静置需要1~2 h才能分层,因此实验过程中采用离心的办法使其快速分层。4组对照组酶活均为0,实验组结果如图6所示。几种失活方式对比表明,使用乙醇失活的相对误差较大,HCl其次,使用TCA失活各组测量值偏差较小,酶活稍微高一些,而使用加热的方式,虽然相对偏差最小,但是酶活出现大幅下降,可能是由于加热时自由脂肪酸有部分挥发造成的。因此,使用加入TCA失活的方法相对最佳。
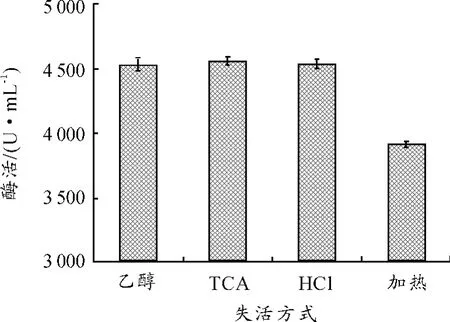
图6 酶失活方式对酶活的影响
2.7 酶反应条件的正交实验
在单因素实验的基础上,选择了对酶活影响较大的几个因素:pH值、酶液稀释倍数和底物浓度进行正交实验,如表1所示。表2为正交实验的结果。实验结果表明,对酶活影响最大的因素为底物的浓度,其次为pH值和酶液稀释倍数。表3的方差分析结果显示:3个因素对酶活的影响都显著,其中酶液稀释倍数的显著性稍差。预测的最佳酶反应组合为A4B4C2,此时酶活最高值为4 773.8 U/mL。由于在实验过程中,发现有其他组合的酶活也较高,因此一起做了验证实验,如表4所示。结果表明:验证组合为A4B4C2时酶活最高达到4876.9U/mL,即最佳的酶反应条件为:pH值为6.5,酶稀释倍数为1 000倍,底物浓度为6%。

表1 正交实验因素水平
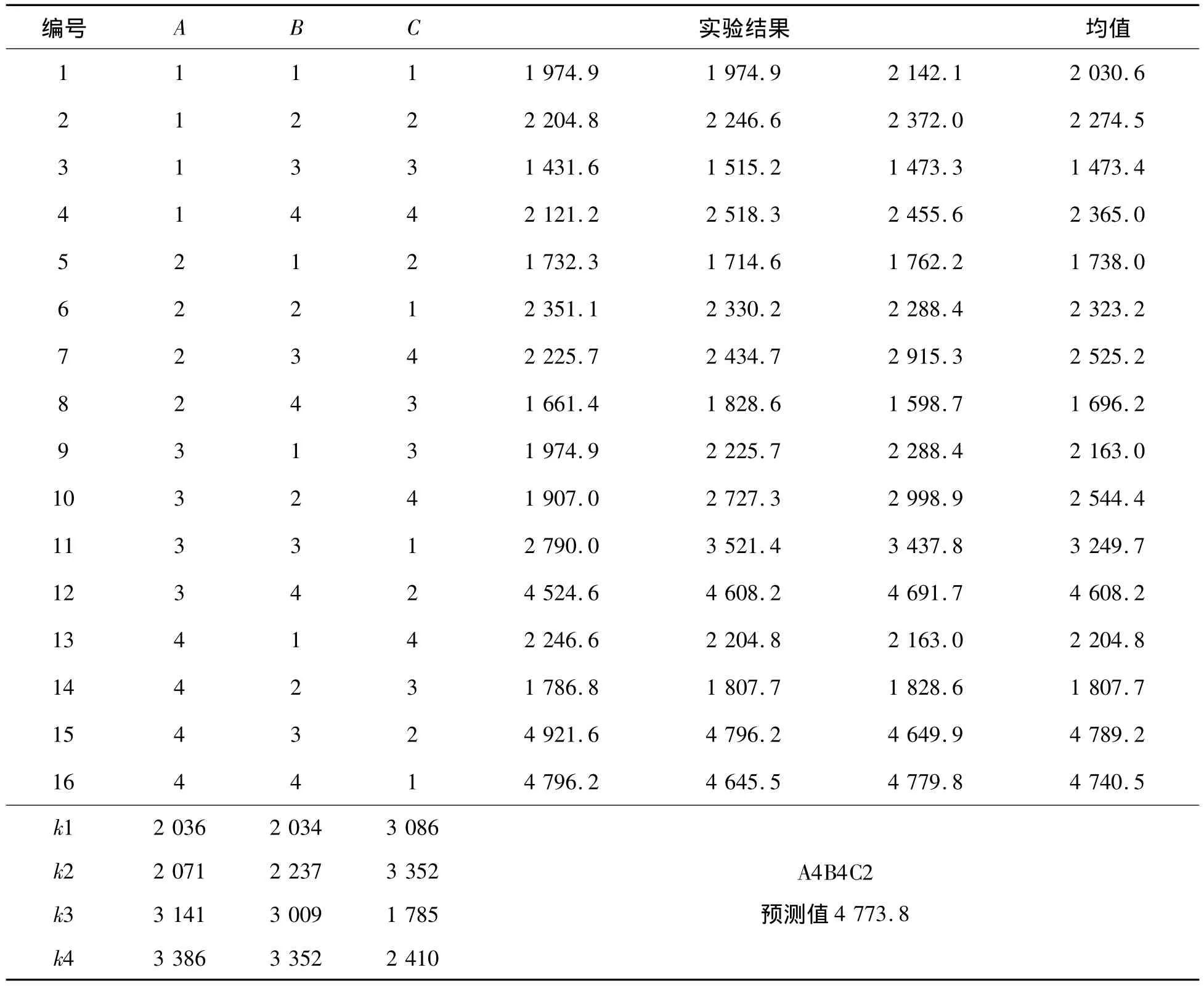
表2 正交实验数据及结果分析
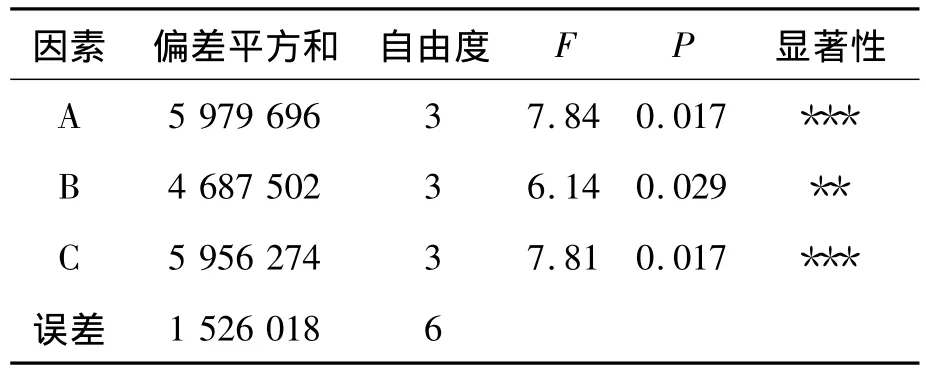
表3 正交实验方差分析
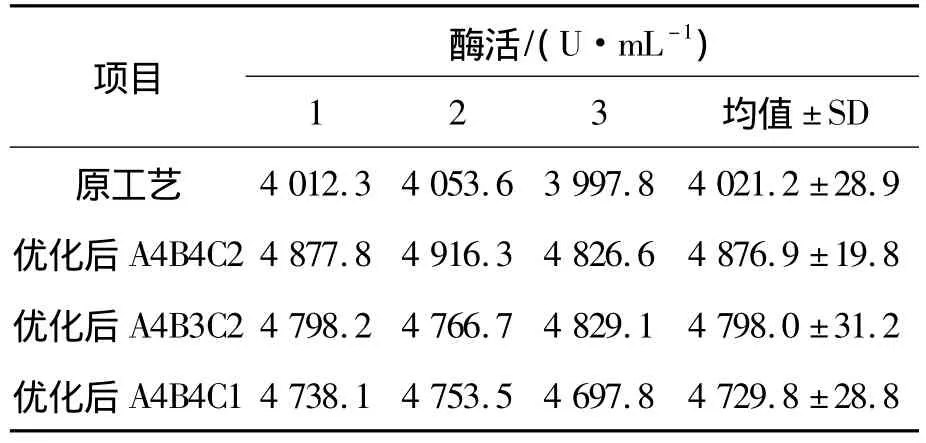
表4 实验结果验证
3 结束语
综合单因素和正交实验的结果,优化后Lecitase Ultra磷脂酶A1的酶活测定最佳条件为:酶稀释倍数为1 250倍,缓冲体系pH值为6.5,离子强度为50 mM,底物浓度为6%,终止酶反应时加入1 mL 0.4M TCA溶液。酶活达到最高值为4 876.9 U/mL,较原工艺得到的酶活(3 978.5 U/mL)提高了18.42%,且平行组得到的数值稳定,相对误差较小,为今后磷脂酶A1酶活的测定提供了一种高效稳定快速的方法。
[1]Gregory S,Richmond,Terry K.Smith.Phospholipases A1[J].Int J Mol Sci,2011,12:588-612.
[2]杨继国,杨博,孟炯,等.新型磷脂酶Lecitase Ultra用于大豆油脱胶的研究[J].中国油脂,2003,28(10):10-13.
[3]占剑峰,姜绍通,潘丽军.磷脂酶酶活力测定条件的优化[J].食品科学,2012,33(17):174-178.
[4]李脉,杨继国,杨博.磷脂酶A1酶活测定方法的研究[J].现代食品科技,2007,23(8):80-82.
[5]李谭瑶,邓克国,陈波,等.气相色谱法测定脂肪酶的活力[J].药学学报,2009,44(6):628-631.
[6]侯爱军,徐冰斌,梁亮,等.改进铜皂-分光光度法测定脂肪酶活力[J].皮革科学与工程,2011,21(1):22-27.
[7]赵梦梦,薛正莲,黄祖耀,等.三种磷脂酶A1活力测定方法的比较[J].食品与发酵科技,2012,48(3):75-77.
[8]纪建业.脂肪酶活力测定方法的改进[J].通化师范学院学报,2005,26(6):51-53.
[9]汪勇,谢林云,欧仕益.磷脂酶A1催化水解大豆油制备甘油二酯研究(Ⅲ)——产品分析与检测[J].中国油脂,2008,33(9):29-32.

