SIRT1在运动训练和白藜芦醇改善T2DM大鼠骨骼肌胰岛素信号通路中的作用
王军力, 肖国强, 曹 姣, 李俊华
(1.怀化学院 体育系,湖南 怀化418008;2.华南师范大学体育科学学院,广东 广州510006)
胰岛素信号(INS-IR-IRS-PI3K-AKT/PKB)通路障碍是Ⅱ型糖尿病(T2DM)发生和发展的重要诱因[1-2]。在胰岛素抵抗和T2DM大鼠中,胰岛素刺激的PI3K和AKT的活化都受到影响[3-4]。SIRT1是酵母染色质沉默因子sir2(silent information regulator 2)同源体,是一种NAD+依赖的组蛋白脱乙酰化酶[5]。在胰岛素抵抗状态下,细胞SIRT1表达降低,SIRT1表达增加能够改善胰岛素的敏感性[6];因此,SIRT1与糖代谢之间存在着密切联系。那么,T2DM骨骼肌SIRT1表达是否降低?运动训练能否诱导T2DM骨骼肌SIRT1表达增加?SIRT1表达增加与运动改善T2DM胰岛素信号通路障碍是否有关尚不明确。白藜芦醇(Resveratrol,Rv)是一种天然的多酚类化合物。在细胞培养的条件下,白藜芦醇能明显促进SIRT1表达和活性升高[7],在在体条件下,白藜芦醇通过激活SIRT1或诱导SIRT1表达明显改善胰岛素的敏感性,降低血糖[8]。白藜芦醇的降糖效果是否依赖于对胰岛素信号通路的影响?是否与SIRT1有关?运动训练和白藜芦醇共同干预是否对T2DM胰岛素信号通路影响有协同效应?这些问题的答案尚不明确。本研究通过观察7周游泳训练和白藜芦醇干预对T2DM大鼠骨骼肌SIRT1表达的影响,探讨SIRT1在运动训练和白藜芦醇单独或共同干预对影响T2DM大鼠骨骼肌胰岛素信号通路中的作用。
1 实验材料与方法
1.1 Ⅱ型糖尿病模型构建 将6周龄SPF级雄性SD大鼠[购自广州中医药大学实验动物中心,许可证号为SCXX(粤)2008-0002粤鉴证字2008D007]适应性喂养1周后[动物房温度为(25±1)℃,湿度为55% ±5%,光照周期12 h],随机分为对照组和高脂组。对照组喂养普通饲料,高脂组喂养高脂饲料,高脂饲料配方为20%(质量比)蔗糖,10%(质量比)猪油,5%(质量比)蛋黄粉,0.2%(质量比)胆酸钠,64.8%(质量比)基础饲料。2组大鼠自由饮食和饮水,饲养条件相同。5周后,对高脂组大鼠腹腔注射链脲佐菌素(35 mg/kg bw[9]),7 d后断尾取血测试随机血糖,血糖浓度≥16.7 mmol/L为建模成功。
1.2 实验分组 建模成功后,将T2DM大鼠随机分为对照组(D)、运动组(DE)、白藜芦醇给药组(DR)和白藜芦醇给药运动组(DER),另设一组正常对照组大鼠(C),每组8只,所有大鼠均以普通饲料喂养。
1.3 运动方案 大鼠的运动方式采用不负重游泳训练,游泳在白色大水桶中进行(无水流),每桶4只,水深60 cm,水温为(32±2)℃,1周的适应性训练(10 min/d)后进行7周正式训练,第1周30 min/d,第2周45 min/d,第3~7周60 min/d。每周训练6 d。
1.4 白藜芦醇灌胃处理 白藜芦醇(湖南洪江华光生物有限责任公司)溶于双蒸水中制成(6 mg/mL)悬浊液。每天11:00按照45 mg/kg对大鼠进行灌胃处理,每周灌胃7 d。对照组大鼠灌胃双蒸水。
1.5 实验取材 停止干预36 h后(避免急性运动效应)禁食12 h,检测空腹血糖和血胰岛素,之后按照2 g/kg bw灌胃葡萄糖进行葡萄糖耐量实验(OGTT),灌胃后30 min、60 min和120 min尾静脉取血检测血糖浓度和血胰岛素浓度。次日利用10%水合氯醛(3.5 mL/kg bw)对大鼠进行麻醉后腹腔注射结晶牛胰岛素(7 U/kg bw),5 min后宰杀大鼠,取比目鱼肌,置于液氮罐中备用。
1.6 主要实验仪器、试剂及材料 实验仪器:JPS-5怡成血糖仪及试纸条(北京怡成);ELX-808酶标仪(美国宝特);电泳仪(瑞典Amersham);凝胶图像分析仪(Alpha Inno tech)。
实验试剂及材料:结晶牛胰岛素(Sigma);PVDF膜(Milli pore);辣根过氧化物酶标记二抗(武汉博士德);胰岛素酶联免疫试剂盒(上海蓝基);兔抗大鼠SIRT1、PTP1B、AKT、IRS-1 、pIRS-1-Ser307多克隆抗体(北京博奥森)。
1.7 检测指标及方法 采用JPS-5怡成血糖仪测试(电化学法)血糖浓度;采用ELISA方法测试血胰岛素浓度;采用 Western-blot方法检测比目鱼肌 SIRT1、AKT、pAKT-Ser473、IRS-1、pIRS-1-Ser307、PTP1B 蛋白表达。Western-blot检测步骤为:SDS-PAGE电泳后,将蛋白转移至PVDF膜(350 mA,1 h),室温下PVDF膜用TBS/T封闭液(TBS含有0.1%Tween-20,5%脱脂奶粉)中孵育2 h,TBS/T缓冲液漂洗3次,每次5 min。用一抗稀释液(TBS/T含有5%BSA)稀释一抗(抗体均为1∶1 000配制),4℃下孵育PVDF膜过夜。TBS/T缓冲液漂洗膜3次,每次5 min,再将膜与二抗(1∶5 000,封闭液稀释)室温下孵育1 h,TBS/T缓冲液漂洗。将化学发光试剂A液与B液等量混合,孵育PVDF膜1 min,于凝胶成像仪中成像。
1.8 数据统计 应用SPSS13.0软件对各组数据进行分析,采用平均数±标准差表示,采用配对t检验和双因素方差分析对数据进行统计处理,P<0.05为显著性差异,P<0.01为非常显著性差异。
2 结果与分析
2.1 不同组别大鼠体重变化情况(表1)
2.2 空腹和OGTT后不同组别大鼠血糖和血胰岛素变化情况
2.2.1 不同组别大鼠血糖变化情况(表2)
2.2.2 不同组别大鼠血胰岛素变化情况(表3)
2.3 不同组别大鼠比目鱼肌 SIRT1、AKT、pAKTSer473、IRS-1、p IRS-1-Ser307和 PTP1B 蛋白表达的比较T2DM大鼠SIRT1表达非常显著性降低(P<0.01),运动训练和白藜芦醇单独或共同干预明显升高T2DM大鼠比目鱼肌SIRT1表达(P<0.01),两者共同干预较单独干预效果更明显(P<0.05)(图2)。不同组别大鼠比目鱼肌AKT表达量无显著性差异(P>0.05)(图3)。T2DM大鼠pAKT-Ser473的含量非常显著性降低(P<0.01),运动训练和白藜芦醇单独或共同干预明显升高T2DM大鼠比目鱼肌pAKT-Ser473的含量(P<0.01),两者共同干预较单独干预效果更明显(P<0.05)(图4)。
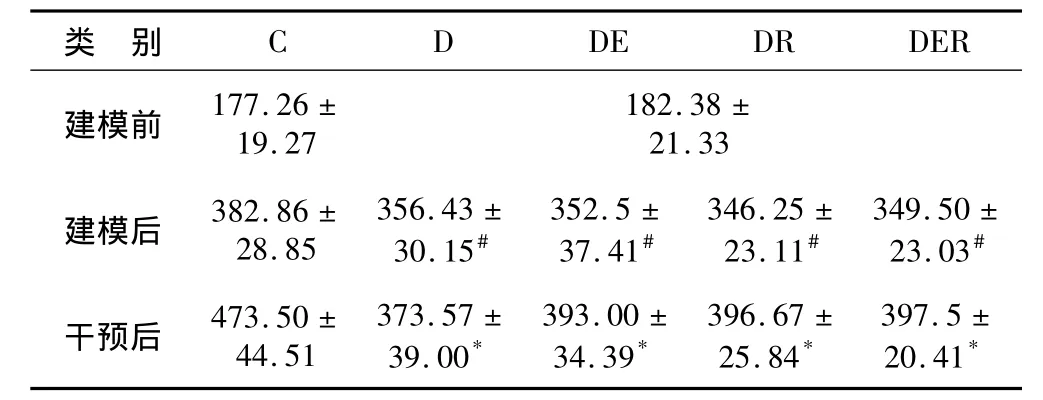
表1 不同组别大鼠体重变化情况 gTable 1 The Changes of Body Weight after 7-Week Exercise and/or Resveratrol

表2 不同组别大鼠OGTT后血糖浓度情况 mmol/LTable 2 The Changes of Plasma Glucosecontent after 7-Week Exercise and/or Resveratrol
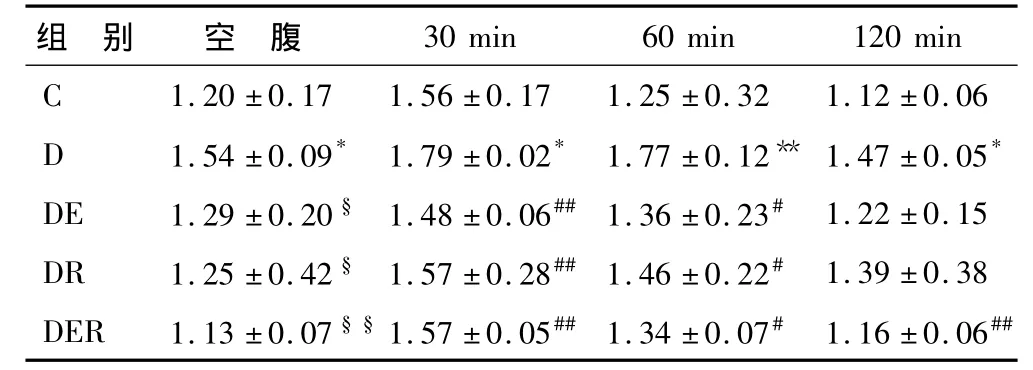
表3 不同组别大鼠OGTT后血浆胰岛素变化情况 ng/mLTable 3 The Changes of Plasma Insulin Content after 7-Week Exercise and/or Resveratrol

图1 不同组别大鼠蛋白表达图谱Figure 1.Protein Expression Profile in Different Groups
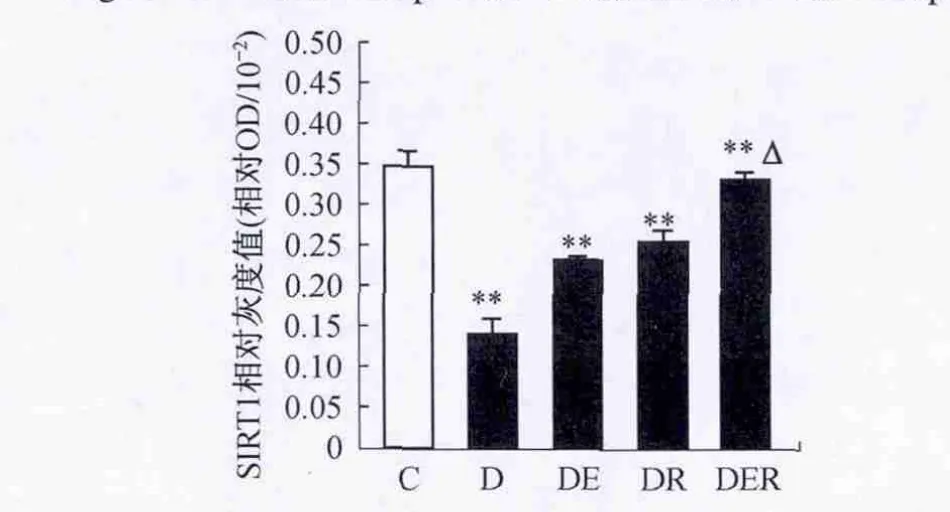
图2 不同组别大鼠SIRT1表达变化情况Figure 2.The Changes of the Expressions of SIRT1 after 7-Week Intervention
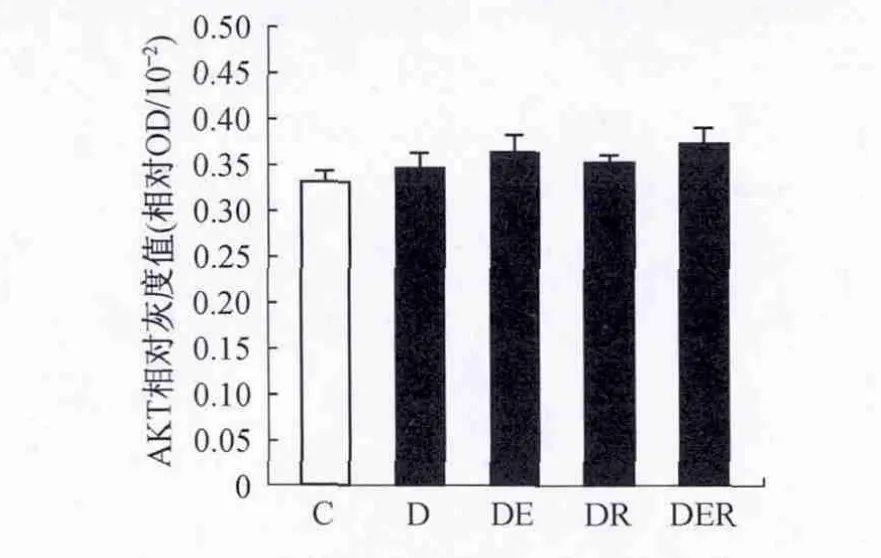
图3 不同组别大鼠AKT表达变化情况Figure 3.The Changes of the Expressions of AKT after 7-Week Intervention
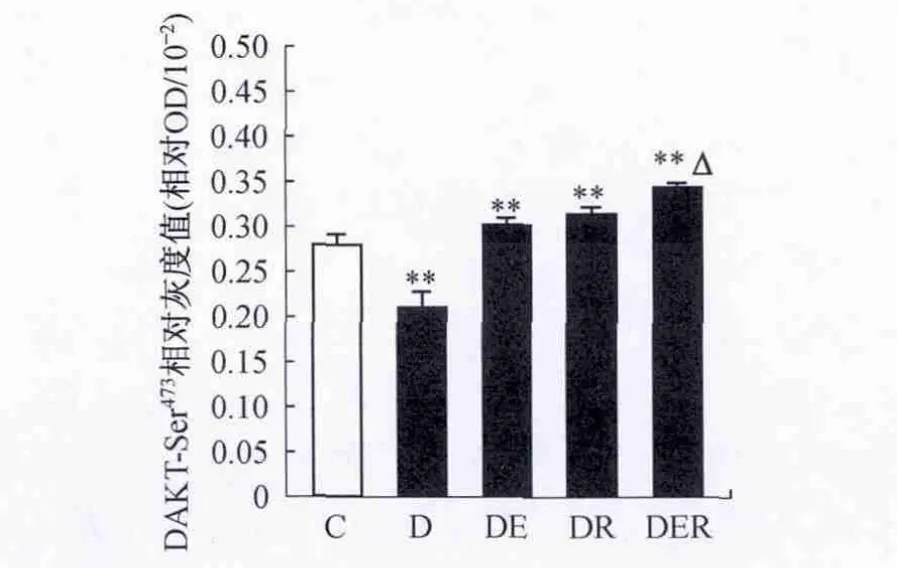
图4 不同组别大鼠pAKT-Ser473表达变化情况Figure 4.The Changes of the Expressions of AKT after 7-Week Intervention
不同组别大鼠比目鱼肌IRS-1表达量无显著性差异(P>0.05)(图5)。T2DM大鼠pIRS-1-Ser307含量显著性升高(P<0.01),运动训练和白藜芦醇单独或共同干预明显降低比目鱼肌 pIRS-1-Ser307含量(P<0.01),两者共同干预较单独干预降低效果更明显(P<0.05)(图6)。T2DM大鼠PTP1B表达明显升高(P<0.01),运动训练和白藜芦醇单独或共同干预明显降低比目鱼肌PTP1B表达(P<0.01),两者共同干预较单独干预降低效果更明显(P<0.05)(图7)。
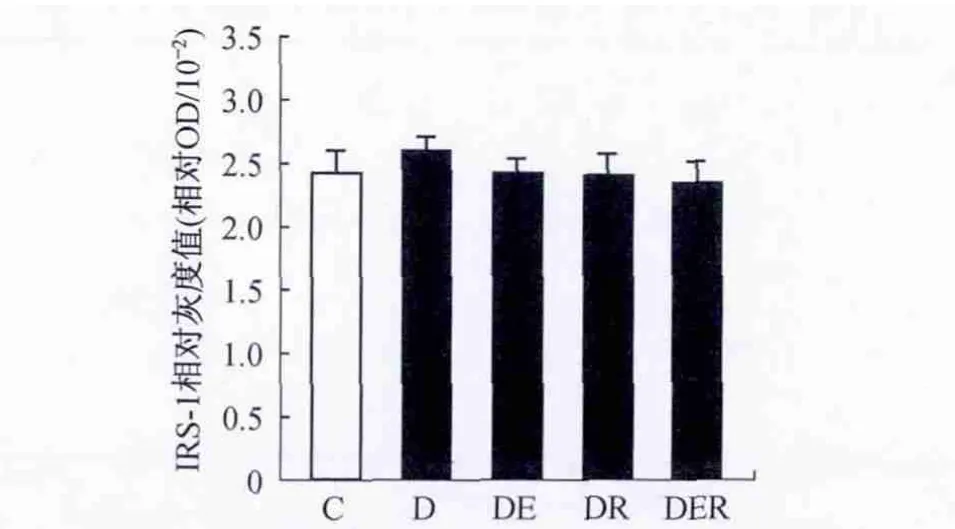
图5 不同组别大鼠IRS-1表达变化情况Figure 5.The Changes of the Expressions of IRS-1 after 7-Week Intervention

图6 不同组别大鼠pIRS-1-Ser307变化情况Figure 6.The Changes of the Expressions of pIRS-1-Ser307 after 7-Week Intervention
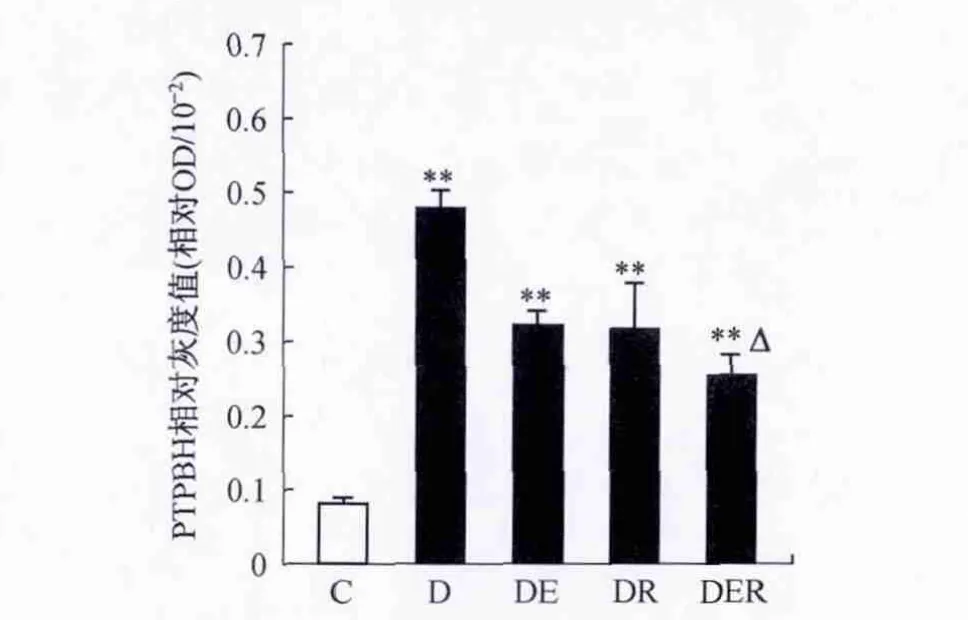
图7 不同组别大鼠比目鱼肌PTP1B表达变化情况Figure 7.The Changes of the Expressions of PTP1B after 7-Week Intervention
3 讨论
3.1 Ⅱ型糖尿病大鼠骨骼肌胰岛素信号通路障碍本文构建的T2DM大鼠空腹血糖和血胰岛素浓度显著高于正常大鼠,OGTT后30 min、60 min和120 min,T2DM大鼠血糖和血胰岛素浓度均显著高于正常大鼠对应时间点血糖和血胰岛素浓度,存在明显的糖耐量受损,提示本研究构建的T2DM大鼠可能存在胰岛素信号通路障碍。
Ser473磷酸化程度反映胰岛素刺激的AKT活化的程度[10],在胰岛素抵抗的肥胖个体中,胰岛素刺激的AKTSer473磷酸化程度降低[11]。本文发现T2DM大鼠比目鱼肌AKT未发生明显变化,而胰岛素刺激的比目鱼肌 pAKTSer473水平降低。为观察胰岛素刺激的pAKTSer473的水平降低是否受到胰岛素信号通路上游蛋白和信号通路负性调节因子的影响,本实验检测了PTP1B、IRS-1和pIRS-1-Ser307的水平。PTP1B是体内广泛表达的胰岛素作用的负性调节因子[12]。其在骨骼肌中含量丰富[13],通过逆转IR和IRS酪氨酸磷酸化,抑制IR和 IRS的激活[14-15]。本文发现 T2DM 大鼠比目鱼肌PTP1B表达显著升高,PTP1B表达增加可能是造成T2DM胰岛素信号通路障碍的原因之一。IRS-1是胰岛素信号通路上游蛋白,pIRS-1-Ser307磷酸化程度增加会导致IRS-1酪氨酸磷酸化和AKT磷酸化水平降低[16]。本文T2DM大鼠比目鱼肌IRS-1表达与正常组大鼠比较无明显变化,但pIRS-1-Ser307水平明显提高。本文构建T2DM大鼠胰岛素信号通路障碍可能部分是由PTP1B表达增加和pIRS-1-Ser307水平升高所致。
3.2 运动训练对Ⅱ型糖尿病大鼠骨骼肌胰岛素信号通路及SIRT1表达的影响 研究表明,7周游泳训练没有改变T2DM大鼠比目鱼肌AKT和IRS-1表达,这与E.Luciano等[17]的研究结果一致。诱导胰岛素刺激的pAKT-Ser473的水平升高,说明运动训练明显提升比目鱼肌AKT的活性,改善胰岛素信号通路障碍。检测血糖和血胰岛素发现,7周游泳训练明显减轻了T2DM大鼠OGTT受损程度,OGTT后30 min、60 min和120 min,血糖浓度均明显低于T2DM对照组大鼠对应时间点的浓度,空腹和OGTT后30 min、60 min血胰岛素浓度明显低于对照组对应时间点浓度,提示骨骼肌对胰岛素敏感性明显提高。同时,尽管与T2DM对照组比较无统计学意义,通过7周游泳干预在一定程度上改善了T2DM大鼠体重。PTP1B作为胰岛素信号通路的负性调节因子被广泛引起注意。G.D.Wadley等[18]发现,急性运动没有改变不经常训练人群骨骼肌PTP1B表达,而 R.Jose'等[19]研究表明急性运动诱导老年鼠骨骼肌PTP1B表达降低。本文发现7周游泳训练导致T2DM大鼠比目鱼肌PTP1B表达显著降低。有研究结果[19]显示,老年鼠进行急性运动能明显降低骨骼肌pIRS-1-Ser307的水平。本文研究表明7周游泳训练显著降低pIRS-1-Ser307水平,因此,运动训练可能通过降低骨骼肌PTP1B和pIRS-1-Ser307的水平改善骨骼肌胰岛素信号通路障碍。
在胰岛素抵抗状态下,细胞 SIRT1表达降低,SIRT1表达增加能够改善胰岛素的敏感性[6]。本文发现T2DM大鼠比目鱼肌SIRT1表达显著降低,这可能是T2DM胰岛素信号通路障碍原因之一。先前研究结果[20]显示急性运动和14 d低强度耐力训练导致正常大鼠比目鱼肌SIRT1表达明显增加,本文首次发现7周游泳训练提高了T2DM大鼠比目鱼肌SIRT1表达。那么7周游泳训练提高T2DM大鼠骨骼肌SIRT1表达是否与运动训练改善胰岛素的敏感性有关,尚不明确。研究结果显示,SIRT1能够抑制PTP1BmRNA的转录,导致 PTP1B 表达下降[6]。
本文发现运动训练诱导T2DM大鼠比目鱼肌SIRT1表达增加的同时,T2DM大鼠比目鱼肌PTP1B表达显著降低;因此,运动训练改善T2DM胰岛素信号通路障碍,可能部分是通过运动训练诱导SIRT1表达抑制PTP1B表达实现的。T.Takeshi等[21]研究发现,利用SIRT1激活剂处理3T3-L1细胞会降低pIRS-1-Ser307的水平,改善了胰岛素的敏感性。本研究发现7周游泳训练后,pIRS-1-Ser307水平降低,这可能与运动训练诱导比目鱼肌SIRT1表达增加有关;因此,运动训练改善T2DM大鼠胰岛素抵抗可能是通过SIRT1-PTP1B和SIRT1-pIRS-1-Ser307途径,即运动训练诱导SIRT1表达抑制PTP1B表达和降低pIRS-1-Ser307水平,改善胰岛素信号通路障碍。
3.3 白藜芦醇对Ⅱ型糖尿病大鼠骨骼肌胰岛素信号通路及SIRT1表达的影响 白藜芦醇对糖尿病大鼠具有降血糖作用,其降血糖作用是否与其改善胰岛素信号通路有关尚不明确。本文发现白藜芦醇干预T2DM大鼠7周后,OGTT表明T2DM大鼠糖耐量明显改善,白藜芦醇给药组在OGTT后30 min、60 min和120 min血糖和血胰岛素浓度明显低于T2DM对照组大鼠对应时间点的浓度,这与 C.Sun等[6]的研究类似。通过7周白藜芦醇补充,T2DM大鼠体重在一定程度得到了改善,但与T2DM对照组比较无统计学意义。Liu Kang等发现白藜芦醇明显增加RAW264.7细胞IRS-1的含量,降低了pIRS-1-Ser307的水平。本文发现,7周白藜芦醇给药对T2DM大鼠比目鱼肌IRS-1和AKT含量无明显影响,但导致T2DM大鼠比目鱼pIRS-1-Ser307的含量降低,胰岛素刺激的pAKT-Ser473水平增加。C.Sun等[6]发现白藜芦醇明显降低正常和胰岛素抵抗状态下PTP1B的水平。本文研究结果显示白藜芦醇显著降低T2DM大鼠比目鱼肌PTP1B的表达。
研究已证实白藜芦醇能够激活SIRT1或增加SIRT1表达。本文首次发现白藜芦醇能够诱导T2DM大鼠比目鱼肌SIRT1表达明显升高。7周白藜芦醇给药改善T2DM大鼠胰岛素信号通路障碍是否与SIRT1表达有关呢?C.Sun等[6]的研究和本文均发现白藜芦醇诱导SIRT1表达增加抑制了PTP1B表达是改善胰岛素敏感性可能机制之一,但是本文首次发现白藜芦醇诱导SIRT1表达抑制了pIRS-1-Ser307的水平可能也参与T2DM胰岛素信号通路的改善。
3.4 运动训练和白藜芦醇共同干预对Ⅱ型糖尿病大鼠骨骼肌胰岛素信号通路及SIRT1表达的影响 本文首次探讨运动训练和白藜芦醇共同干预对骨骼肌胰岛素信号通路蛋白及PTP1B表达的影响。研究发现,7周单独游泳训练和白藜芦醇共同干预对T2DM大鼠比目鱼肌AKT和IRS-1的表达无显著性影响,但显著增加了胰岛素刺激的pAKT-Ser473水平,且呈现出协同效应。两者共同干预明显抑制了PTP1B和pIRS-1-Ser307的表达,且抑制程度明显高于两者单独干预对T2DM大鼠比目鱼肌PTP1B和pIRS-1-Ser307的抑制作用,表明运动训练和白藜芦醇共同干预比单独干预更明显改善了T2DM大鼠胰岛素信号通路障碍。
本研究结果显示,运动训练和白藜芦醇共同干预诱导T2DM大鼠比目鱼肌SIRT1表达显著高于单独干预诱导SIRT1的表达,具有协同效应。两者单独干预明显改善T2DM大鼠糖耐量受损,那么两者共同干预对糖耐量的改善是否具有协同效应?OGTT结果表明,两者共同干预在葡萄糖灌胃后30 min、60 min和120 min血糖浓度明显低于游泳训练或白藜芦醇单独干预对应时间点血糖的浓度,提示两者共同干预对糖耐量的改善具有协同效应。这种协同效应可能是由于两者共同干预诱导SIRT1表达的协同效应,从而对PTP1B和pIRS-1-Ser307的水平抑制程度的协同效应造成的。
4 结论
7周游泳训练和白藜芦醇单独或共同干预均改善Ⅱ型糖尿病大鼠糖耐量受损,可能是通过抑制PTP1B表达和减少pIRS-1-Ser 含量,改善了胰岛素信号通路障碍,从而增加骨骼肌对胰岛素敏感性而实现的;而SIRT1作为PTP1B和pIRS-1-Ser307重要调节因子,游泳训练和白藜芦醇单独或共同干预诱导其表达增加可能起着关键调节作用。
7周游泳训练和白藜芦醇共同干预对SIRT1表达具有协同效应,对PTP1B和pIRS-1-Ser307的抑制程度也具有协同效应,较单独干预更明显地改善糖耐量受损,更好地改善了胰岛素信号通路障碍。
[1] Florez J C.Newly Identified Loci Highlight Betacell Dysfunction as a Key Cause of Type 2 Diabetes:Where are the Insulin Resistance Genes?[J].Diabetologia,2008,51(7):1100-1110
[2] Iozzo P,Beck-Nielsen H,Laakso M,et al.Independent Influence of Age on Basal Insulin Secretion in Nondiabetic Humans[J].J Clin Endocrinol Metab,1999,84(3):863-868
[3] Brozinick JT Jr,Roberts B R,Dohm G L.Defective Signaling Through Akt-2 and-3 but not Akt-1 in Insulin-Resistant Human Skeletal Muscle:Potential Role in Insulin Resistance[J].Diabetes,2003,52(4):935 - 941
[4] Karlsson H K,Ahlsen M,Zierath J R,et al.Insulin Signaling and Glucose Transport in Skeletal Muscle from First-Degree Relatives of Type 2 Diabetic pa Tients[J].Diabetes,2006,55(5):1283 -1288
[5] Chakrabarty SP,Ramapanicker R,Mishra R,et al.Development and Characterization of Lysine Based Tripeptide Analogues as Inhibitors of Sir2 Activity[J].Bioorg Med Chem,2009,17(23):8060 -8072
[6] Sun C,Zhang F,Ge X,et al.SIRT1 Improves Insulin Sensitivity under Insulin Resistant Conditions by Repressing PTP1B[J].Cell,2007,6(4):307 -319
[7] Milne JC,Lambert P D,Schenk S,et al.Small Molecule Activators of SIRT1 as Therapeutics for the Treatment of Type 2 Diabetes[J].Nature,2007,450(7170):712 - 716
[8] Breen D M,Sanli T,Giacca A,et al.Stimulation of Muscle Cell Glucose Uptake by Resveratrol Through Sirtuins and AMPK[J].Biochem Biophys Res Commun,2008,374(1):117-122
[9] 邓向群.SIRT1表达对大鼠胰岛β细胞凋亡及非酒精性脂肪肝形成的影响[D].武汉:华中科技大学,2007:31-43
[10] Hill M M,Clark SF,Tucker D F,et al.A Role for Protein Kinase Bbeta/Akt2 in Insulin-Stimulated GLUT4 Translocation in Adipocytes[J].Mol Cell Biol,1999,19(11):7771-7781
[11] Katome T,Obata T,Matsushima R,et al.Use of RNA Interference-Mediated Gene Silencing and Adenoviral Overexpression to Elucidate the Roles of AKT/Protein Kinase B Isoforms in Insulin Actions[J].J Biol Chem,2003,278(30):28312 -28323
[12] Kitamura T,Ogawa W,Sakaue H,et al.Requirement for Activation of the Serine-Threonine Kinase Akt(protein Kinase B)in Insulin Stimulation of Protein Synthesis But Not of Glucose Transport[J].Mol Cell Biol,1998,18(7):3708-3717
[13] Ahmad F,Goldstein B J.Purification Identification and Subcellular Distribution of Three Predominant Protein-Tyrosine Phosphatase Enzymes in Skeletal Muscle Tissue[J].Biochim Biophys Acta,1995,1248(1):57 -69
[14] Ahmad F,Li P M,Meyerovitch J,et al.Osmotic Loading of Neutralizing Antibo d I es Demonstrates a Role for Protein-Tyrosine Phosphatase1B in Negative Regul Ation of the Insulin Action Pathway[J].J Biol Chem,1995,270(35):20503-20508
[15] Calera M,Vallega G,Pilch P.Dynamics of Protein-Tyrosine Phosphatases in Rat Adipocytes[J].JBiol Chem,2000,275(9):6308-6312
[16] Ueki K,Yamamoto-Honda R,Kaburagi Y,et al.Potential Role of Protein Kin Ase B in Insulin-in Duced Glucose Transport,Glycogen Synthesis,and Protein Synthesis[J].J Biol Chem,1998,273(9):5315 -5322
[17] Luciano E,Carneiro E M,Carvalho,C R,et al.Endurance Training Improves Responsiveness to Insulin and Modu Lates Insulin Signal Transduction Through the Phosphatidylinositol 3-Kinase/Akt-1 Pathway[J].Eur J Endocrinol,2002,147(1):149 -157
[18] Wadley G D,Konstantopoulos N,Macaulay L,et al.Increased Insulin-Stimulated Akt pSer473 and Cytosolic SHP2 Protein Abundance in Human Skeletal Muscle Following Acute Exercise and Short-Term Training[J].J Appl Physiol,2007,102(4):1624 -1631
[19] Pauli J R,Ropelle E R,Cintra D E,et al.Acute Exercise Reverses Aged Induced Impairments in in Sulin Signaling in Rodent Skeletal Muscle[J].Mechanisms of Ageing and Development,2010,131(5):323 -329
[20] Suwa M,Nakano H,Radak Z,et al.Endurance Exercise Increases the SIRT1 and Peroxisome Proliferator-Activated Receptorγ Coactivator-1α Protein Expressions in Rat Skeletal Muscle[J].Clinical and Experiment,2008,57(7):986-998
[21] Yoshizaki T,Milne J C,Imamura T,et al.SIRT1 Exerts Anti-Inflammatory Effects and Improves Insulin Sensitivity in Adipocytes[J].Molecular and Cellular Biology,2009,29(5):1363-1374

