一株高产油脂微生物菌种的筛选与鉴定
陈士华 ,孙 强 ,孙莉云 ,吴兴泉 *
(1.河南工业大学 生物工程学院,河南 郑州 450001;2.黑龙江北大荒农业股份有限公司 八五四分公司,黑龙江 虎林 158403)
0 引言
产油微生物可利用碳源及其他必需营养物质在细胞内合成并大量储存油脂,其油脂积累量可超过细胞总量的20%[1].研究表明,细菌、酵母、霉菌、藻类等多种微生物均可生产油脂,产生的油脂多为C16和C18的不饱和脂肪酸,其中一些还能生产功能性多不饱和脂肪酸,而且证明微生物油脂含有更多的功能性不饱和脂肪酸,比动、植物油脂更符合人们需要.在筛选高产油脂微生物菌种的同时,利用微生物发酵法生产某些功能性油脂的相关研究也随之展开.现已获得了一系列的油脂含量高并富含亚麻酸的菌株,并建立了高密度发酵法生产亚麻酸的技术体系[2].微生物油脂的发酵生产过程具有可人工操作、便于控制、生产周期短、不受季节限制、便于大规模连续生产等优点.微生物油脂在医药、食品、饲料、化工、能源等多个行业具有非常广阔的应用前景[3].
近年来,人们致力于高产油脂微生物菌种的选育研究,已经获得多种高产油脂的微生物菌种[4].在众多产油微生物中,霉菌受到的关注最为广泛,研究也较为深入,因为霉菌油脂含量高,富含γ-亚麻酸(GLA)和花生四烯酸(ARA)等功能性多不饱和脂肪酸[5].目前研究较多的有高山被孢霉、深黄被孢霉、长被孢霉、小克银汉霉、樟疫霉、水霉、轮枝霉、鲁氏毛霉、卷枝毛霉、畸雌腐霉、终极腐霉、破囊壶菌、头孢霉等[6].霉菌的油脂含量多在20%~25%之间,超过25%的霉菌种类较少.本研究分离、鉴定了一株可高产油脂的深黄伞形霉,其油脂含量可达48.77%,为微生物油脂的开发和利用奠定了基础.
1 材料与方法
1.1 带菌土样的采集
在河南工业大学及周边地区采集富含油脂的土壤样本6份.取富含油脂及糖类的土壤,用取样铲除去表层5 cm左右的浮土,取5~15 cm处的土样50~100 g,装进准备好的塑料袋内扎好,编号并记录采样地点、土壤质地、时间和其他的环境条件,取回样品后马上进行霉菌分离[7].
1.2 培养基配方
PDA培养基:马铃薯200 g,水1 000 mL,琼脂20 g.种子培养基:酵母粉10 g,蛋白胨10 g,葡萄糖20 g,水1 000 mL.发酵培养基:葡萄糖40 g,(NH4)2SO42 g,KH2PO47 g,NaH2PO42 g,酵母粉 1 g,MgSO4·7H2O 1.5 g,水 1 000 mL.
1.3 菌株筛选
1.3.1 平板初筛
取10 g土样放入装有玻璃珠和90 mL无菌生理盐水的三角瓶中,在振荡器上振荡 20 min左右,静置,制成稀释10倍的土壤悬液;在无菌条件下,连续稀释,制成 10-2、10-3、10-4、10-5、10-6的稀释土壤悬液.无菌条件下,取上述各梯度的稀释液0.1 mL涂布PDA平板培养基,每个稀释度涂布3个平板,28℃恒温倒置培养4~6 d,然后分离纯化霉菌.
1.3.2 油脂粒的染色观察
苏丹黑B染色液的配制:称取0.3 g苏丹黑B(厦门绿茵试剂公司),溶于100 mL 70%(V/V,下同)乙醇中,室温放置5 d,期间经常摇动使其充分溶解,过滤后于4℃下保存备用.Giemsa染液的配制:称取吉姆萨粉(Giemsa stain)l.0 g,甘油 66 mL,甲醇 66 mL,将吉姆萨粉放入研钵中,先加入少量甘油,研磨至无颗粒为止,然后再将全部甘油倒入,置于56℃温箱中2 h后,加入甲醇,将配制好的染液密封在棕色瓶内4℃保存.
油脂粒的染色观察:从平板培养基上选取单菌落,挑取少许菌丝涂片,热固定,加入一滴苏丹黑B染色液染色l5 min,倾去染料,用二甲苯冲洗至洗脱液无色,再用Giemsa染液复染2 min,水洗、吸干后镜检.根据油滴颗粒大小及密集程度作出产油脂量的评价,并做好观察记录.根据油滴颗粒大小和密集程度作出产油脂量的评价,以“+”来评价产油脂量,如果染色后胞内蓝黑色颗粒非常少,有很少油滴记为“+”;蓝黑色颗粒稍多,有小油滴记为“++”;蓝黑色颗粒稍多,小油滴较多记为“+++”;孢子分散,染色很深,油脂很多记为“++++”;镜检脂肪粒大且多的霉菌接种于PDA斜面培养基培养和后续的摇瓶复筛.
1.3.3 摇瓶复筛
挑取保存于斜面培养基上的少量菌丝或孢子,接种于另一PDA斜面培养基上,于28℃培养3~5 d,直至长出大量孢子.用无菌水冲洗斜面上的孢子并用移液器分别吸取50μL接入50 mL的液体种子培养基中,于28℃,180 r/min振荡培养24 h.然后将种子液按10%的比例接入装有发酵培养基的三角瓶中(250 mL三角瓶的装液量为40 mL),放在28℃,180 r/min的恒温振荡培养箱中振荡培养5~7 d[9].用布氏漏斗过滤发酵液并将所得到的菌体收集起来,干燥后称质量,然后计算干菌体得率.再称取一定量的干菌体,用酸热法将干菌体中所含油脂抽提出来,并测定其质量,从而计算出油脂含量和油脂得率.从中选出油脂含量高且稳定的菌株,并对该菌株进行分子鉴定,以确定其种属.
1.4 生物量测定
摇瓶发酵6 d后,测定发酵液的总体积,并用布氏漏斗抽滤得到菌丝体.称取菌丝体的质量,并置于鼓风干燥箱中50℃烘干至质量不再变化,准确称菌体的质量.
干菌体得率的计算:

1.5 油脂提取
酸热法提取微生物油脂[10-11]:用研钵将干菌体研磨碎,精确称取一定量干菌体放入100 mL的三角瓶中,每克干菌体添加40 mL盐酸(4 mol/L),室温下放置30 min,沸水浴10 min,然后置于-20℃下速冷,沸水浴和速冷可重复操作3~4次.然后加入2倍体积的氯仿-甲醇,充分振荡后在4 000 r/min下离心12 min,用已知质量的离心管收集氯仿层,在60℃水浴中蒸干氯仿,80℃烘干1.5 h,冷却称质量即得油脂质量.

1.6 高产油脂微生物菌种的鉴定
1.6.1 菌种的形态学观察
观察菌株在平板培养基上的颜色、厚薄、质地、形状等菌落形态特征,并记录.在显微镜下观察菌株的分生孢子、分生孢子梗及产孢器等各种性状,并记录.
1.6.2 菌种的分子鉴定
从保存的斜面上挑取菌丝体接种到40 mL的PDA液体培养基中,28℃,150 r/min振荡培养24 h.采用EE101-01 50型的DNA提取试剂盒(北京全式金生物技术有限公司)进行DNA的提取.采用真菌ITS序列通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3') 和 ITS4 (5'-TCCTCCGCTTATTGATATGC-3'),PCR 扩增出包括 ITS1、5.8 S rDNA和ITS2的全长DNA片段.PCR反应程序为:94℃预变性3 min;94℃变性 30 s,60℃退火 30 s,72 ℃延伸 1 min,32个循环;72 ℃延伸 10 min.PCR扩增产物经1.5%琼脂糖凝胶电泳检测后,在上海生工生物工程有限公司进行序列测定.采用BLAST工具进行序列比对分析,确定待测菌株的属种.
2 结果与分析
2.1 霉菌分离纯化与平板初筛
从6份土壤样品中共分离、纯化出11种霉菌.用接种针分别从平板上挑取一定量的孢子,用苏丹黑B染液染色,镜检观察,部分镜检结果见图1.根据油滴颗粒大小和密集程度作出产油脂量的评价,最终分离出7株产生油脂的霉菌(见表1).将评价为“++”及以上的霉菌作为实验目标菌株,共得到7株,进行摇瓶复筛试验.
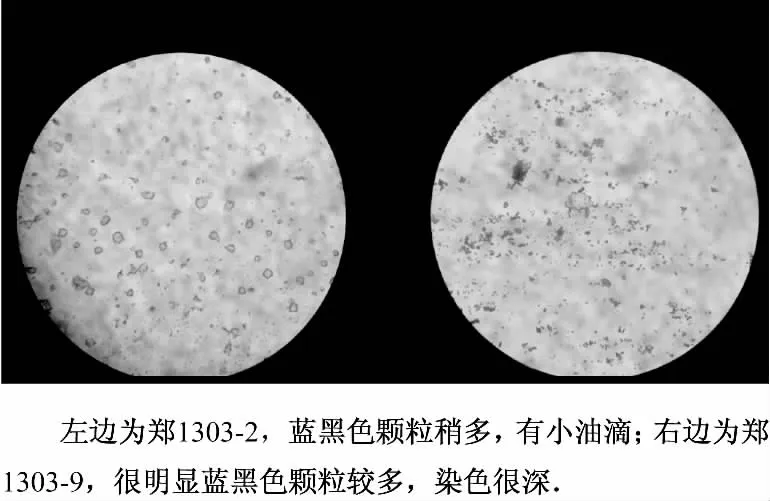
图1 苏丹黑B染色结果
2.2 摇瓶复筛结果
对以上7株菌株经摇瓶培养后,酸热法抽提油脂,测定生物量、油脂含量和油脂得率,结果见表2.

表1 苏丹黑B染色法观察菌株的结果
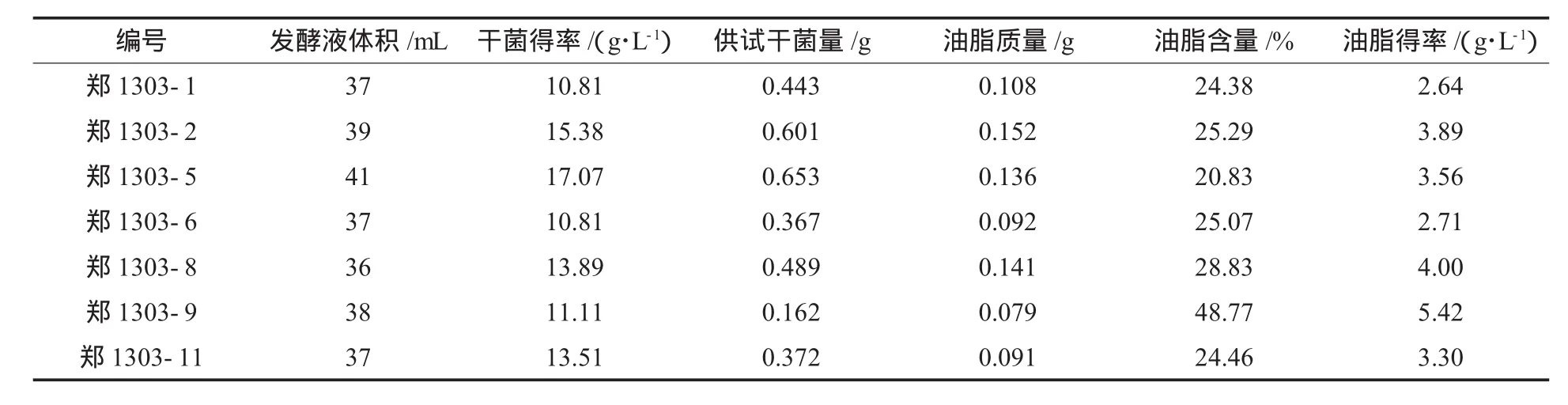
表2 摇瓶复筛结果
以油脂含量(%)和油脂得率(g/L)为指标,油脂含量高于25%的霉菌为郑1303-2、郑1303-6、郑1303-8、郑1303-9,其中菌株郑1303-9油脂含量最高(48.77%),油脂得率最高(5.42 g/L),郑1303-8油脂含量其次(28.83%),油脂得率为4.00 g/L,选择油脂含量最高的菌株郑1303-9进行分子鉴定.
研究表明,进行产油脂微生物菌种筛选时,采用苏丹黑B染色法进行初筛具有可批量处理、操作简单等优点.采用酸热法进行粗油脂含量的测定可以满足在菌种筛选阶段对油脂抽提的基本要求,而且较索氏抽提法操作简便、可批量处理,从而使产油脂真菌筛选的整个过程得以大大简化.
2.3 菌株郑1303-9的鉴定
2.3.1 菌株郑1303-9的形态学鉴定
菌株郑1303-9生长速度比较慢,4 d后菌落直径为2.1 cm,正反面颜色相近,正面为灰黄色,反面为浅黄色,菌丝长的比较集中,相对致密,并且从菌落中心向菌落边缘出现很多像树的年轮一样的圈,一周后菌落直径也只有很小的变化.
2.3.2 菌株郑1303-9的分子生物学鉴定
用北京全式金生物技术有限公司生产的EE101-01 50型的DNA提取试剂盒提取出霉菌的DNA,以ITS1和ITS4为引物,利用PCR技术扩增出5.8 S rDNA/ITS区段,并将扩增片段用1.5%的琼脂糖凝胶进行电泳,电泳结果见图2.
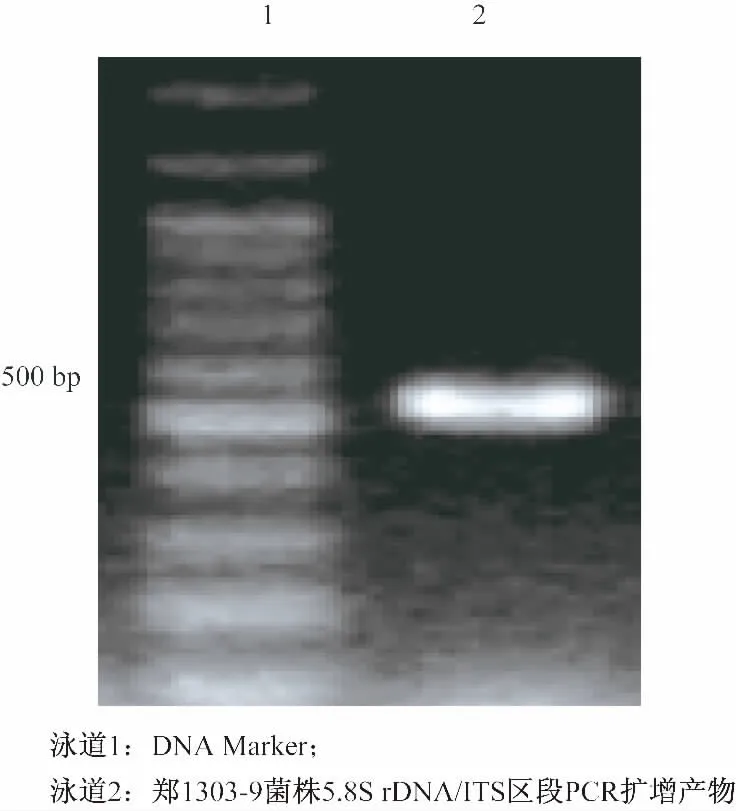
图2 菌株郑1303-9 5.8S rDNA/ITS区段的PCR扩增
由图2可以看出,成功扩增出郑1303-9菌株的5.8S rDNA/ITS片段,纯化PCR产物在上海生工生物工程有限公司测序,获得郑1303-9菌株的5.8 S rDNA/ITS区段序列为5′-ctttcactcgaaagatcttttc ctttgtgctggctttgaccgtatgtaattttgggacttaaacatggtaaagccttatgg tttggccggtcccaaaaacaatatatcatccttatgaaaaacttactgaacaacta aacaatgattttaataatctgtttaaaacaactttcaacaacggatctcgtggttctc gcatcgatgaaaaacgcagcgaaatgcgatacgtagtgtgaattgcaaaattcag tgaatcatcaaatctttgaacgcacattgcactccttggtattccgaggagtatgcc tgtttcaatatcatgagcactctcacacctaacctttgggttatgctgtggaattgag atgcgcctatttttactactcggcactcctaaaatgtagctcttggctgtttcctacta cagcattttggcctaatagttttgacttttgtcaaatctttggctacttttgcttctggaa atcactcttgataatacagaaaactcatttcaaactttgatctgaaatcaggtaggg ctacccgctgaacttacgcatatcaataagcggagga-3′. 经 BLAST分析证明郑1303-9 5.8 S rDNA/ITS区段序列与深黄伞形霉(Umbelopsis isabellina)相应序列(Genbank序列号EU816388.1)相似度可达96%,确定郑C1303-9菌株为深黄伞形霉.这与前人的研究成果相同[12-13].
3 结论
筛选得到1株产油脂含量高达48.77%的真菌菌株郑1303-9,综合菌株的菌落形态和分子鉴定结果,证明该菌株为深黄伞形霉.深黄伞形霉郑1303-9菌株具有油脂产量高、生物量较大等特点,具有极高的研究价值和应用潜力.
[1] 何东平,陈涛.微生物油脂学[M].北京:化学工业出版社,2006:2-24.
[2] 陆步诗,李新社,范平.二步发酵丢糟生产微生物油脂的研究[J].生物技术,2012(5):79-82.
[3] 薛飞燕,张栩,谭天伟.微生物油脂的研究进展及展望[J].生物加工过程,2005,3(1):23-27.
[4] 颜治,陈晶.微生物油脂及其开发利用研究进展[J].粮食与油脂,2003(7):13-15.
[5] 孙志芳,高荫榆,郑渊月.功能性油脂的研究进展[J].中国食品添加剂,2005(3):4-7.
[6] Papanikolaous,M Komaitis,G Aggelis.Single cell oil(SCO)production by Mortierella isabe nin grown on high-sugar content media[J].Bioresour Technol,2004,95:287-291.
[7] 史海粟,王际辉,叶淑红,等.产功能性油脂微生物的筛选及鉴定[J].中国油脂,2010(4):24-27.
[8] 刘吉华,袁生,戴传超.一种新的丝状真菌油脂含量快速鉴定方法[J].生物技术,1998,8(1):43-44.
[9] 叶思特,郭丽琼,刘晓蓉,等.产油微生物的筛选[J].华南农业大学学报,2012,33(3):384-387,397.
[10]曹健,汪晨辉,曾实.卷枝毛霉Mucor circinelloides 3.2208油脂几种提取方法的比较[J].中国油脂,2004,29(4):38-40.
[11]孔几敏,赵祥颖,田延军,等.酸热法提取酵母油脂条件的研究[J].中国酿造,2010(5):143-146.
[12]郑红波,刘光华,李昕然,等.产油脂微生物菌种的筛选、鉴定及其油脂组成分析[J].四川大学学报:自然科学版,2010,47(6):1397-140.
[13]何容,赵环,杨云喜,等.深黄伞形霉(Umbelopsis isabellina)华2-1产油发酵培养条件优化[J].应用与环境生物学报,2012,18(1):80-85.

