scBsAb1/17双特异性抗体对小鼠类风湿性关节炎模型的治疗效果
齐剑英,郭 茉,叶贤龙,阚方明,张 宇,郝智超,徐黎明,任桂萍,王文飞,李德山
类风湿性关节炎(rheumatoid arthritis,RA)是一种以关节的慢性、反复发作性炎症为主要特征的自身免疫性疾病[1]。IL-1和TNF-α是目前公认的RA病中的重要炎症介质[2]。近年来,TNF-α、IL-1β 等以单一细胞因子作为靶标的生物抑制剂在治疗RA的临床实践中,尽管取得了一定的效果,但是在某些病人中并不能起到预期的疗效[3]。造成这一结果的原因可能是由于以单一细胞因子作为靶标的生物制剂并不能够充分的抑制多种炎症因子在炎症反应中所起的作用[4]。
IL-17A是近年发现的新的细胞因子,它主要表达于激活的CD4+的T淋巴细胞中[5]。IL-17位于炎症网络的中心,与其他炎症细胞因子有协同作用,同时抑制IL-17、IL-1β可能会取得比抑制单一细胞因子更好的治疗效果。本研究构建了双特异性抗体scBsAb1/17,该抗体可以同时中和IL-1β和IL-17A,结果表明该抗体对Ⅱ型胶原诱导的关节炎模型(CIA)的治疗效果明显优于单价抗体。
1 材料及方法
1.1 试剂 鸡Ⅱ型胶原(typeⅡ collagen,CII),弗氏完全佐剂,PHA为美国Sigma公司产品。
1.2 实验动物 昆明小鼠,♂,6~8周龄,体质量(20±1)g,由哈尔滨兽医研究所提供。
1.3 蛋白表达纯化 原核表达载体pET27b-scB-sAb1/17由本实验室构建。scBsAb1/17由anti-IL-1β scFv和anti-IL-17 scFv组成,中间由一段32个氨基酸的连接肽连接。pET27b-scBsAb1/17转化到Rossetta表达菌中,37℃培养至细菌生长对数期,加入IPTG(终浓度0.25 mmol·L-1)37℃诱导表达4 h,离心收集菌体,超声裂解,高速离心回收包涵体,经反复洗涤后用含8 mol·L-1尿素的变性液溶解,将其逐渐稀释于复性液中,进行复性,复性后的蛋白经离子交换层析纯化,纯化后的产物进行12%SDSPAGE电泳鉴定。
1.4 scBsAb1/17蛋白中和hIL-17A生物活性的细胞水平检测 HeLa细胞在10%小牛血清(Invitrogen Corporation),青霉素1 ×105U·L-1,链霉素1 ×105U·L-1,37℃、5%CO2,饱和湿度条件下于 24 孔板培养。当细胞培养铺满单层时,将50 ng·L-1的hIL-17蛋白与20 mg·L-1scBsAb1/17蛋白混合于室温孵育0.5 h。加入混合蛋白至细胞培养液(只加hIL-17蛋白的细胞作为阳性对照,未经处理的细胞作为阴性对照),继续培养24 h,提取RNA,反转录成cDNA,Real-time PCR检测IL-6、IL-8表达水平变化。
1.5 scBsAb1/17蛋白中和hIL-1β生物活性的细胞水平检测 L929细胞稀释成3.5×108cell·L-1的细胞悬液,接种到96孔板,每孔100 μl。取另一块细胞培养板,每孔加入50 μl含有2%胎牛血清的RPMI 1640液体培养基,于每排的3~6孔加入梯度稀释的scBsAb1/17抗体(第1孔不加抗原和抗体,第2孔只加抗原),每排2至6孔加50 μl hIL-1β(10 μg·L-1),将细胞培养板置37℃温箱中孵育2 h。将抗原抗体混合物相对应地加到有L929细胞的培养板中,并将细胞板置5%CO2,37℃温箱中继续培养48 h。每孔中加入10 μl浓度为5 g·L-1的 MTT溶液,置37℃温箱培养4 h。弃去每孔中的液体,用PBS洗板1次,于每孔中加入100 μl DMSO,置板于37℃温箱中使MTT充分溶解。用酶标仪在570 nm读取每孔的吸收值。
1.6 造模及给药 小鼠关节炎模型建立:将 CII溶于0.1 mol·L-1的醋酸中,在4℃下搅拌使之充分溶解,浓度为2 g·L-1,置于4℃过夜;再将 CII与弗氏完全佐剂(CFA)等体积混合、乳化,制成 CII乳剂(即 CII浓度为 1 g·L-1)[6]。选取 6 ~8 周龄♂昆明小鼠60只,将制备后的乳剂于每只小鼠的右后足注射0.1 ml致炎。将造模成功的小鼠随机分为7组,每组8只,分别为A:scBsAb1/17治疗组(1 mg·kg-1),B:scBsAb1/17 治疗组(5 mg·kg-1),C:scBsAb1/17 治疗组(10 mg·kg-1),D:anti-IL-1β scFv治疗组(10 mg·kg-1),E:anti-IL-17A scFv治疗组(10 mg·kg-1),F:DEX阳性药对照组(1 mg·kg-1),G:模型对照组(注射生理盐水),另选取8只昆明小鼠作为H:正常对照组。实验组每2 d腹腔注射相应受试剂1次进行治疗,对照组给予相同体积的生理盐水,至d 49将小鼠处死取样。
1.7 小鼠关节炎评分 小鼠造模后20 d全部发病,同时观察关节肿胀情况,4 d评分一次 (0分:无红肿;1分:小趾关节红肿;2分:趾关节和足趾肿胀;3分:踝关节以下的足爪肿;4分:包括踝关节在内的全部足爪肿胀),最高为16分。
1.8 血清抗Ⅱ型胶原抗体测定 给药29 d后,小鼠摘眼球取血,室温放置后离心取血清 (5 000 r·min-1,5 min),进行 CII特异性抗体检测。将100 μl样品(封闭液稀释)加入包被有抗原的96孔酶标板中,每个样品做3个复孔,密封平板,37℃孵育1 h。清洗后加入HRP连接的抗小鼠IgG,在室温放置1 h。底物(TMB)显色0.5 h后,加入终止液,于450 nm测定OD值。
1.9 CII胶原特异性增殖实验 常规分离脾细胞,用含10%小牛血清的RPMI 1640培养液将细胞浓度调成4×109cell·L-1。于 96 孔板中加入100 μl的细胞悬液,加PHA(20 mg·L-1)和CII(100 mg·L-1)刺激,未刺激组作为对照组,每实验组设4个复孔。将细胞放置于37℃培养箱中培养72 h,MTT法测570 nm下的OD值。计算细胞增殖指数SI=(OD实验组-OD对照)/OD对照
1.10 Real-time PCR检测细胞因子变化 给药29 d后,取小鼠脾脏,提取脾脏RNA并反转为 cDNA。Real-time PCR 检测 TNF-α、IFN-γ、IL-6、IL-2、IL-1 等细胞因子mRNA变化水平。TNF-α:(F:GGA AAC CCA GAG GCA TTG AC;R:TCA GGA TCT GGC CCT TGA AC);IFN-γ:(F:TGC TGA TGG GAG GAG ATG TCT;R:TGC TGT CTG GCC TGC TGT TA);IL-6:(F:GAT GCC CCA GGC AGA GAA;R:CAC CCA GGG AAT TCA AAT GC);IL-1β:(F:CCA TGG CAC ATT CTG TTC AAA;R:GCC CAT CAG AGG CAA GGA);IL-2:(F:GCA CCC ACT TCA AGC TCC A;R:AAA TTT GAA GGT GAG CAT CCT G);β-actin:(F:ACA TCT GCT GGA AGG TGG AC;R:GGT ACC ACC ATG TAC CCA GG)。1.11 统计学处理 采用单因素方差分析(ANOVA),及双尾t检验进行统计学分析。
2 结果
2.1 scBsAb1/17的纯化 蛋白经变性、复性及离子交换纯化后,进行12%SDS-PAGE分析。如Fig 1所示,纯化后的scBsAb1/17在45~66.2 ku之间呈现单一条带,大小与理论相符,纯度达到95%以上。
2.2 scBsAb1/17蛋白中和hIL-17A生物活性 见Fig 2所示,与抗原刺激的细胞相比,scBsAb1/17抗体与抗原混合处理组刺激后,HeLa细胞的IL-6和IL-8表达水平差异具有统计学意义(P<0.01),接近于阴性对照组的数值,具有统计学意义。该结果说明特异性抗体都能很好地阻断hIL-17A的生物学活性。
2.3 scBsAb1/17蛋白中和hIL-1β生物活性 见Fig 3所示,与hIL-1β刺激的细胞相比,scBsAb1/17能阻断hIL-1β刺激的L929细胞增殖(P<0.01),并呈剂量依赖性,说明该特异性抗体具有中和hIL-1β的中和活性。
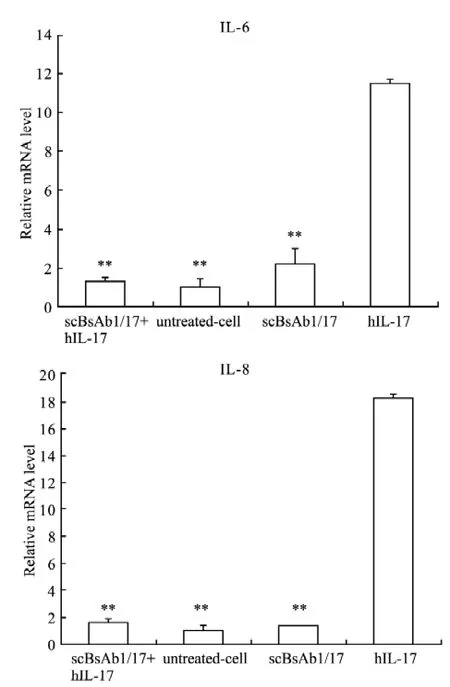
Fig 2 Neutralizing effect of scBsAb1/17 on hIL-17was determined by Real time-PCR
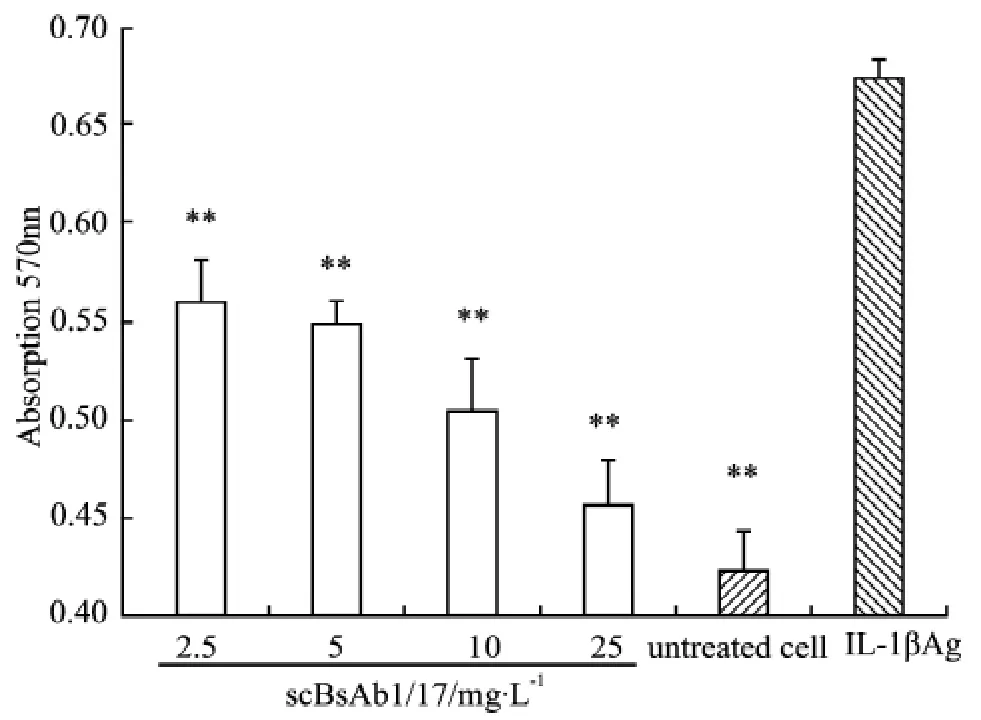
Fig 3 Anti-proliferative effect of scBsAb1/17 onL929 cells stimulated with hIL-1β
2.4 scBsAb1/17对小鼠关节炎发病的影响 小鼠成模后开始给药,每2 d给予各实验组小鼠1次相应的受试剂,治疗29 d后,对各实验组小鼠进行关节炎临床评分。结果表明 scBsAb1/17(10 mg·kg-1)能够明显地抑制CIA小鼠多发性关节炎的发生,并且治疗效果要优于scBsAb1/17(1 mg·kg-1、5 mg·kg-1)组及单价抗体治疗组,与CIA模型组比较差异有显著性(P<0.05,如Fig 4所示。
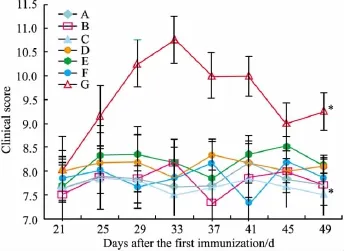
Fig 4 Effects of scBsAb1/17 on clinical scores of CIA mice(n=8,¯±s)
2.5 scBsAb1/17体内给药对关节炎小鼠血清中特异性抗体产生的影响 小鼠成模后开始治疗,每2 d给予各实验组小鼠1次相应的受试剂,给药29 d后,取血,采用ELISA方法检测小鼠血清中CII抗体。结果显示,未治疗的CIA小鼠血清中的CII抗体水平明显高于正常组,而经抗体治疗的小鼠血清中的CII抗体水平明显降低(Fig 5)。
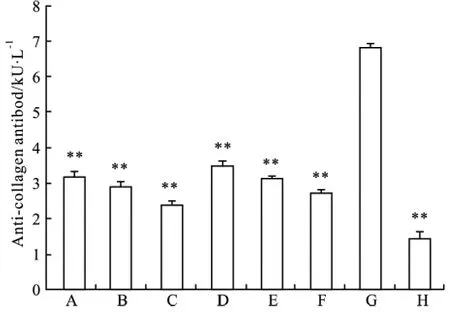
Fig 5 Effects of scBsAb1/17 on serum levels ofanti-CII antibodies in CIA mice(¯±s)
2.6 scBsAb1/17对胶原诱导的关节炎小鼠脾细胞体外增殖实验 小鼠成模后开始给药,每2 d给予各实验组小鼠1次相应的受试剂,29 d后,取小鼠脾脏,分离脾细胞进行体外培养,经CII刺激后检测脾细胞增殖指数。结果表明,与模型对照组相比,各治疗组脾细胞增殖指数都明显降低,表现了对脾细胞增殖的抑制作用。同时,scBsAb1/17(10 mg·kg-1)治疗组脾细胞增殖指数低于anti-IL-1β scFv(10 mg·kg-1)治疗组,且差异有显著性(P<0.05),如Fig 6所示。

Fig 6 Administration of scBsAb1/17 lowers the proliferation potential of splenocytes
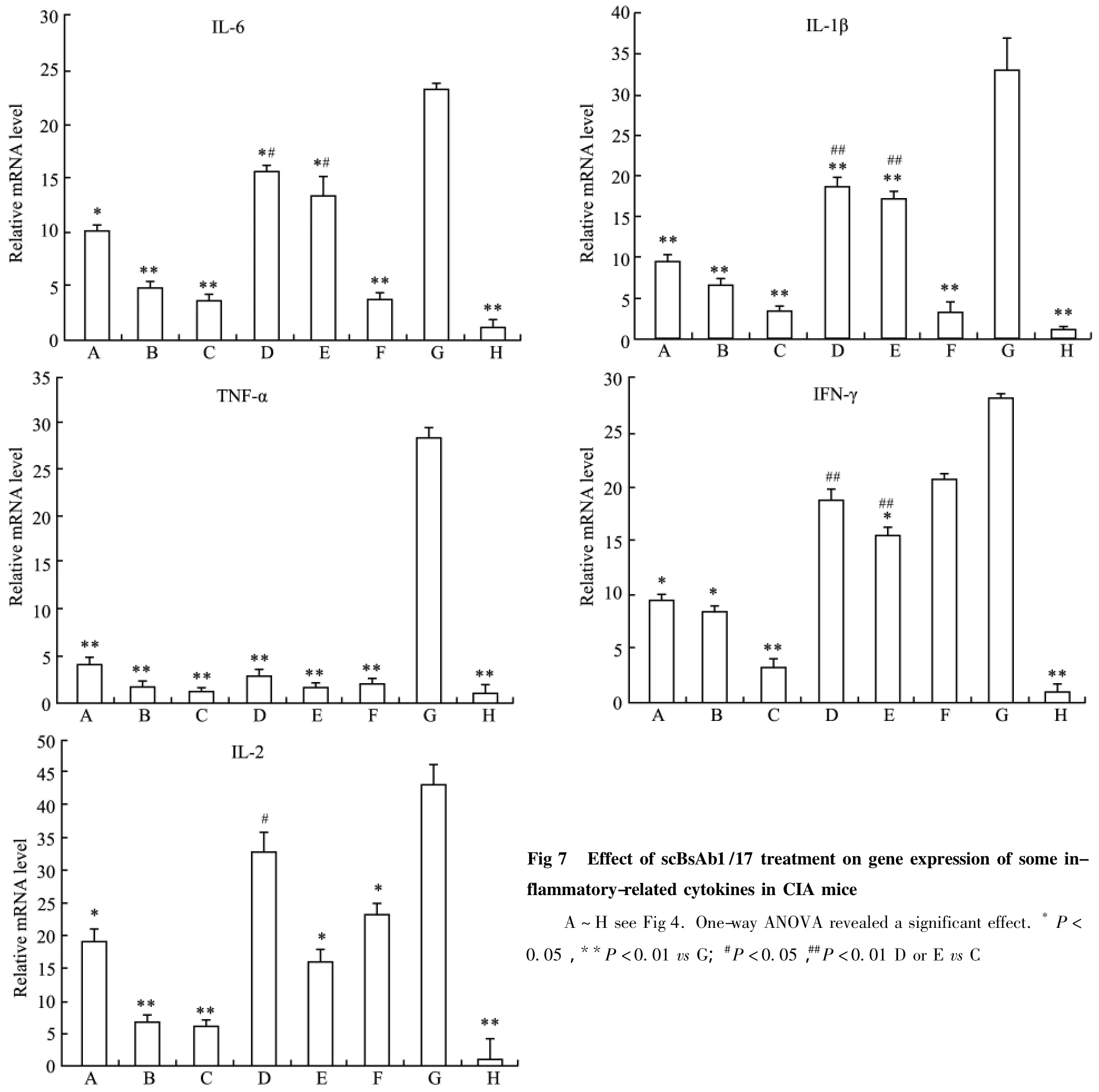
2.7 scBsAb1/17体内给药对关节炎小鼠细胞因子产生的影响 小鼠成模后开始治疗,每2 d给予各实验组小鼠1次相应的受试剂,29 d后,取各实验组小鼠脾脏,检测脾脏中一些细胞因子的水平变化。结果表明,相对于模型组,不同剂量scBsAb1/17都能抑制实验组小鼠脾脏中 IL-2、IL-1、IFN-γ、IL-6和TNF-α细胞因子的表达,且差异有显著性。相同剂量条件下,scBsAb1/17治疗组的抑制效果优于anti-IL-1β scFv治疗组和anti-IL-17A scFv治疗组,见Fig 7。
3 讨论
近年来靶向TNF-α、IL-6和IL-1的药物已经用于类风湿性关节炎的治疗,但是其对一些病人的治疗效果并不理想[7-8]。有研究表明,靶向两种细胞因子进行联合治疗取得了比靶向单一细胞因子更好的治疗效果。由于IL-1是RA中重要的炎症介质[9],同时 IL-17 位于炎症网络的中心[10-11],与 IL-1等炎症细胞因子有协同作用,因此本实验构建了同时靶向IL-1和IL-17的scBsAb1/17双特异性抗体,预期达到比单价抗体更好的治疗效果。将两个抗体的可变区通过连接肽连接,并在大肠杆菌中进行该基因的功能性表达。传统的抗体基因通常在真核细胞如CHO细胞中表达,在原核系统中的表达产物通常没有活性,而小分子抗体则不存在这一问题,该抗体没有糖基化位点,可直接在大肠杆菌中进行原核表达,成本低,周期短。
本研究比较了不同剂量scBsAb1/17对CIA小鼠的治疗效果,同时比较了相同剂量条件下scB-sAb1/17与相对应的单价抗体(anti-IL-1β scFv和anti-IL-17A scFv)在CIA小鼠的治疗效果。通过检测小鼠脾细胞增殖、血清中CII胶原抗体、小鼠脾脏mRNA 中 IL-1β、TNF-α、IL-6、IL-2 和 IFN-γ 表达水平变化,得到以下结论:3种抗体和DEX治疗组都能抑制脾细胞增殖及以上细胞因子的表达,对CIA模型小鼠都有治疗效果;不同剂量scBsAb1/17对CIA模型鼠的治疗效果呈剂量依赖性;相同剂量条件下,scBsAb1/17的治疗效果要优于单价抗体(anti-IL-1β scFv和 anti-IL-17A scFv)。
目前治疗RA的生物制剂中针对IL-1β的药物只有重组人白细胞介素-1受体拮抗剂(rhIL-1ra)一种,为非抗体类竞争性拮抗剂,且有许多不尽人意的地方急需改进,如用药量大且用药频繁等[12]。因此,scBsAb1/17作为一种新型的、同时拮抗IL-1β和IL-17A的抗体药物将会有很大的市场空间,有望成为治疗类风湿性关节炎的新型候选药物。
[1] Feldmann M,Maini R N.Anti-TNF-α therapy of rheumatoid arthritis:What have we learned?[J].Annu Rev Immunol,2001,19:163-96.
[2] Jeong J G,Kim J M,Cho H,et al.Effects of IL-1beta on gene expression in human rheumatoid synovial broblasts[J].Biochem Biophys Res Commun,2004,324(1):3-7.
[3] Cohen S,Hurol E,Cush J,et al.Treatment of rheumatoid arthritis with anakinra,a recombinant human interleukin-1 receptor antagonist,in combination with methotrexate:results of a twenty-fourweek,multicenter,randomized,double-blind,placebocontrolled trial[J].Arthritis Rheum,2002,46(3):614 -24.
[4] Chabaud M,Miossec P.The combination of tumor necrosis factor alpha blockade with interleukin-1 and interleukin-17 blockade is more effective for controlling synovial in ammation and bone resorption in an ex vivo model[J].Arthritis Rheum,2001,44(6):1293-303.
[5] Yao Z,Femslow W C,Seldin M F,et al.Herpesvirus saimiri encodes a new cytokine,IL-17,which binds to a novel cytokine receptor[J].Immunity,1995,3(6):811 -21.
[6] 周 茹,杨以阜,左建平.Ⅱ型胶原诱导的小鼠关节炎动物模型的建立及影响因素[J].中国药理学通报,2006,22(12):1532-5.
[6] Zhou R,Yang Y F,Zuo J P.Establishment and influencing factors of typeⅡ collagen induced murine arthritis model[J].Chin Pharmacol Bull,2006,22(12):1532 -5.
[7] Lipsky P E,Van der Heijde D M,St Clair E W,et al.Infliximab and methotrexate in the treatment of rheumatoid arthritis.Antitumor necrosis factor trial in heumatoid arthritis with concomitant therapy study group[J].N Engl J Med,2000,343(22):1594 -602.
[8] Cohen S,Hurd E,Cush J,et al.Treatment of rheumatoid arthritis with anakinra,a recombinant human interleukin-1 receptor antagonist,in combination with methotrexate:results of a twenty-fourweek,multicenter,randomized,double-blind,placebocontrolled trial[J].Arthritis Rheum,2002,46(3):614 -24.
[9] Ruddy M J,Shen F,Smith J B,et al.Interleukin-17 regulates expression of the CXC chemokine LIX/CXCL5 in osteoblasts:implications for inflammation and neutrophil recruitment[J].J Leukoc Biol,2004,76(1):135 -44.
[10] Ruddy M J,Wong G C,Liu X K,et al.Functional cooperation between interleukin-17 and tumor necrosis factor-alpha is mediated by CCAAT/enhancer-binding protein family members[J].J Biol Chem ,2004,279(4):2559-67.
[11] Witowski J,Ksiazek K,Jorres A.Interleukin-17:a mediator of in?ammatory responses[J].Cell Mol Life Sci,2004,61:567 -79.
[12]王秋颖,徐黎明,任桂萍,等.新型抗IL-1β和IL-17A双特异抗体的构建及特性鉴定[J].中华微生物学和免疫学杂志,2011,31(7):623-9.
[12] Wang Q Y,Xu L M,Ren G P,et al.Construction and characterization of a novel bispecific antibody against both IL-1βand IL-17A[J].Chin J Microbiol Immunol,2011,31(7):623 -9.