回医烙灸法对大鼠实验性腰椎间盘退变MMP-3表达的影响
许建峰,林瑞珠,牛子瞻,张跃全,武永利,王英絮
(宁夏医科大学总医院,宁夏 银川 750004)
椎间盘退变(intervertebral disc degeneration,IDD)是椎间盘突出、椎管狭窄、慢性下腰痛等疾病的主要原因之一,其发生、发展有多种炎性细胞和基质金属蛋白酶的参与。寻找有效的治疗方法和途径干预炎性细胞和金属蛋白酶,延缓或抑制椎间盘退变的发生、发展是研究的难点[1]。目前现代医学尚无有效方法防治椎间盘退变,基质金属蛋白酶-3(MMP-3)在退变过程中起着重要的作用已经成为研究的热点。回医烙灸疗法具有补肾强督、强筋健骨的作用,在治疗椎间盘退变方面已取得良好的疗效[2]。本实验采用回医烙灸疗法治疗大鼠椎间盘退变,观察大鼠的椎间盘组织Miyamoto分级变化,并通过免疫组织化学方法检测MMP-3变化,为回医烙灸疗法治疗腰椎间盘退变提供理论和实验根据。
1 材料与方法
1.1 实验动物及分组 健康2个月龄清洁级SD大鼠 45 只,雄性,体重(450±20)g,宁夏医科大学总医院动物中心提供,动物合格证号:SCKX(宁)2011-0013。将大鼠随机分为模型组、假手术组和回医烙灸组3组,每组各15只。
1.2 药品及试剂 一抗为MMP-3多克隆抗体,二抗羊多克隆抗体(Santa Cruz公司),一抗按1∶75稀释;免疫组化SABC试剂盒、PBS缓冲液、枸椽酸盐缓冲液购于北京博奥生物工程有限公司;DAB显色剂购于Gibco公司;6.5%的水合氯醛购于宁夏医科大学总医院制剂中心;灸法所用艾绒购于宁夏医药公司[豫郑食药监械(准)字2012第1270003号];荧光显微镜(型号Nikon,日本Nikon公司)。
1.3 实验方法
1.3.1 动物造模 大鼠称重,术前X线片定位,以6.5%的水合氯醛0.055 mL/kg腹腔注射麻醉。麻醉成功后腹部剪毛,清洁,仰卧位,固定四肢,碘伏消毒铺巾。取右侧旁正中切口,长约1.5~2.0 cm,远端略过髂嵴2~3 mm。将肠管及大网膜用湿纱布向头侧、对侧推移,暴露腹后壁,剪开腹后膜,保护好下腔静脉,将腰大肌从脊柱附着点上节段性剥离(髂嵴平对L6椎体或5~6椎间盘),暴露5~6椎间盘,利用21G微量穿刺针对以上椎间盘行穿刺,针刺角度与椎间盘矢状面呈0°~60°,平行于软骨终板进针,穿刺深度为2.3 mm,针刺贯穿整个纤维环全层。针刺成功后,缝合腹膜层、肌层,关闭皮肤。假手术组SD大鼠仅切开皮肤后即缝合。
1.3.2 治疗方法 ①回医烙灸组:造模1个月后开始,将大鼠固定在用300 mL塑料饮料瓶自制的固定器上,特制的铁器灸具放置在大鼠命门到腰俞的督脉及双肾俞穴处,然后放上艾绒10 g在灸槽点燃,发热铁器灸具可使局部皮肤发红发泡,5 d 1次,每次20 min,治疗2个月后取材。② 模型组、假手术组:造模1个月后开始,不予任何干预手段,每5 d在固定器上固定20 min,治疗2个月后取材。
1.3.3 取材 在大鼠治疗2个月后将各组大鼠腹腔麻醉处死,取出完整的L5~6椎间盘组织,将标本置入10%甲醛液固定48 h,持续流水冲洗1 h,梯度乙醇依次脱水,二甲苯透明,浸蜡,石蜡包埋,待用。
1.4 形态学观察 3组大鼠椎间盘组织石蜡包埋块切片,组织切片平均厚度约4 μm,二甲苯脱蜡,梯度乙醇入水,流水冲洗片刻,苏木精液及伊红液染色,进行光镜观察。按Miyamoto分级标准将椎间盘分为1~5 级,分别计为 1、2、3、4、5 分。
1.5 免疫组织化学染色 石蜡切片脱蜡至水,加入3%H2O2消除内源性过氧化物酶活性,PBS冲洗 3次,浸入0.01 mol/L枸椽酸盐缓冲液并置于高压锅内,15 min行抗原修复,室温冷却后PBS漂洗3次;5%BSA室温封闭20 min,阻断内源性生物素,滴加一抗(1∶50 稀释 MMP-3),4℃过夜。PBS漂洗 3次,滴加生物素标记的二抗,室温、湿盒内孵育30 min,再次PBS漂洗3次;滴加DAB显色剂,显色适度后终止反应;苏木素复染、脱水、透明,封片。
1.6 图像分析及处理 以荧光纤维镜观察阳性部位,细胞中成棕黄或棕褐色为MMP-3染色。每个组织标本随机选取不重叠的10个观察视野,用LeicaQ500MC图像系统进行MMP-3表达的阳性细胞进行定量测试。根据不同染色部位的灰度值,自动计算出阳性细胞的平均灰度。
1.7 统计学处理 所得数据采用SPSS 11.0统计软件包进行分析。计量资料呈正态分布的用表示,组间治疗后呈正态分布的计量资料采用两样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 3组形态分级评分观察 见表1。
表1 3组对大鼠实验性退变腰椎间盘Miyamoto 分级标准() 分
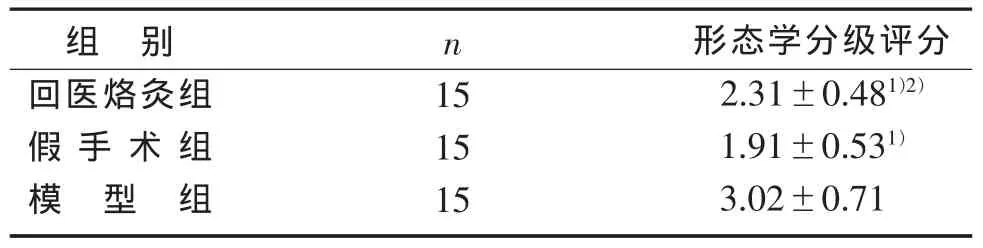
表1 3组对大鼠实验性退变腰椎间盘Miyamoto 分级标准() 分
注:与模型组比较,1) P<0.01;与假手术组比较,2) P<0.05。
组 别回医烙灸组假手术组模型组形态学分级评分2.31±0.481)2)1.91±0.531)3.02±0.71 n 15 15 15
2.2 3组免疫组织化学检测 见表2。
表2 3组对大鼠实验性退变腰椎间盘中 MMP-3 表达的影响()

表2 3组对大鼠实验性退变腰椎间盘中 MMP-3 表达的影响()
注:与模型组比较,1) P<0.05。
平均光密度值(MOD)0.19±0.011)0.16±0.021)0.36±0.03组 别回医烙灸组假手术组模型组n 15 15 15
3 讨 论
随着社会人口老龄化进程的加快,IDD将成为前所未有的公共卫生问题,轻者引起慢性颈臂痛或腰腿痛,重者引起神经功能障碍甚至截瘫[3]。所以,目前对椎间盘退变内源性机制和防治措施等方面进行纵深研究具有迫切性和重要性[4]。
椎间盘退变引发多种复杂的生物学效应:①促进椎间盘细胞凋亡;② 影响椎间盘基质合成;③ 促进基质金属蛋白合成及基质破坏;④通过诱导IL-1、IL-6等致炎因子的产生而使椎间盘的内环境产生恶性循环[5]。然而在这些的变化中,椎间盘细胞外基质的变化是椎间盘退变及生物力学改变的至关重要的因素。研究表明:MMPs是分解细胞外基质的蛋白酶中最重要的一类,其中MMP-3在细胞外基质的降解中起关键的作用[6]。MMP-3不仅能降解蛋白多糖和糖蛋白,还能分解多种类型的胶原纤维,从而加剧椎间盘的退变和椎间盘组织水分的丢失。椎间盘的退变是遗传、机械、物理、生物学和炎症刺激等诸多因素综合作用的结果,这些因素组成了一个极其庞大复杂的网络,而MMP-3是这个网络中的比较重要一环,在椎间盘退变过程中起到举足轻重的作用,同时MMP-3也受到诸多因素的调控和影响。因此,抑制MMP-3的活性,从而调控其对细胞外基质蛋白多糖和胶原纤维的降解作用以减缓椎间盘退变,这是研究减缓和治疗椎间盘退变的一个关键点和重要作用靶点[7]。
腰椎间盘退变属中医和回医的 “痹病”、“腰痛”范畴。病机为肝肾不足,筋骨失养。回医认为本病主要由肝肾不足导致的腰部四液、四性失衡所致。回医烙灸疗法是用烙药或铁器烧灼直接烙烫于病痛或患处的体表部位,使得局部皮肤发红发泡,促使机体康复的一种治疗方法,治疗需达到“灸时须使皮破”的效果。这种独具特色的灸法,是祖国医学“化脓灸”的发展与深化。回医烙灸疗法排出患处异常体液及代谢衰败过程中的四液病理产物,从而促进四性、四液平衡,最终达到人体所需要的体液平衡和阴阳平衡。回医烙灸疗法风格独特,对疾病的治疗可达到“病根尽去”的目的[2]。回医烙灸疗法较中医化脓灸刺激面大,治疗温度可以根据铁制灸具灸槽中艾绒的多少来调节,铁制灸具有传热快、操作简单等优点,临床上深受患者的喜爱。
烙灸疗法有补肾强督、强筋健骨作用,同时通过起泡化脓可以排出腰椎局部寒、湿、瘀血等病理产物,从而达到扶正驱邪的目的。通过本实验研究表明:回医烙灸法可明显减少大鼠退变腰椎间盘组织中MMP-3的阳性表达的强度。我们通过前期研究发现化脓灸可以显著降低椎间盘退变的IL-6,有部分学者认为它与椎间盘退变程度呈正相关,下调基质蛋白的表达,上调 MMPs和 ADAMTs的转录[8]。回医烙灸法通过对炎症因子的介导,达到降低MMP-3的表达,进一步减少了软骨细胞的凋亡,减少细胞外基质中的蛋白多糖及II型胶原纤维等的降解,促使椎间盘退变延缓,形态学评分下降。因此有必要对回医烙灸治疗椎间盘退变进行更加深入的机制探讨,为其治疗椎间盘退变提供理论和实验根据。
[1]肖学军,赵卫东.椎间盘退变与椎间盘软骨终板退变[J].中国医药指南,2011,9(11):34-35.
[2]乔建荣,粱颖,靳萱,等.《回回药方》烙灸疗法探析[J].宁夏医科大学学报,2011,33(2):101-102.
[3]PING CHUNG LEUNG.Importance of the relationship between BMD and disc degeneration in the lumbar spine in the elderly[J].Aging health,2010,6(4):465-467.
[4]杨勇,姜建元,吕飞舟,等.骨髓间充质干细胞治疗椎间盘退变研究进展[J].国际骨科学杂志,2012,33(3):181-183.
[5]文天用,李放,叶超群.p38 MAPK信号转导通路与椎间盘退变[J].中国康复理论与实践,2010,16(9):841-842.
[6]陈德胜,李燕,郭凤英,等.枸杞多糖对实验性退变腰椎间盘中基质金属蛋白酶-3表达的影响[J].宁夏医学杂志,2012,34(4):303-304.
[7]ELLMAN M B,KIM J S,AN H S,et al.Toll-like receptor adaptor signaling molecule MyD88 on intervertebral disk homeostasis:in vitro,ex vivo studies[J].Gene,2012,505(2):283-290.
[8]SUZUKI M,HASHIZUME M,YOSHIDA H,et al.IL-6 and IL-1 synergistically enhanced the production of MMPs from synovial cells by up-regulating IL-6 production and IL-1 receptor I expression[J].Cytokine ,2010,51(2):178-183.

