糖皮质激素对哮喘大鼠肺组织IL-8表达的抑制作用
范晓云,汪 浩,徐 轲,唐 伟,陆兆双
(1.安徽医科大学第一附属医院老年呼吸内科,安徽合肥 230022;2.安徽医科大学老年病研究所,安徽合肥 230022)
哮喘是一种由嗜酸性粒细胞、肥大细胞、T细胞、中性粒细胞、气道上皮细胞等多种细胞和细胞组分参与的气道慢性炎症性疾病[1-3]。嗜酸性粒细胞(EOS)是气道慢性炎症的主要效应细胞,IL-8则是来源于多种细胞且对炎性细胞具有趋化作用的细胞因子,可诱导中性粒细胞、EOS迁徙和活化[4],参与哮喘炎症和变态反应的发生。糖皮质激素仍是目前治疗哮喘最有效的药物,可抑制趋化因子对中性粒细胞、嗜酸粒细胞等炎性细胞的趋化作用和炎症因子本身来减轻气道炎症,降低气道高反应。本研究通过建立哮喘大鼠动物模型,探讨IL-8在哮喘炎症中作用和抗炎药物DXM对其影响,为将来把趋化因子作为设计哮喘药物的新靶点提供依据。
1 材料和方法
1.1 材料
1.1.1 实验动物健康♂SD大鼠30只,体质量180~220 g,由安徽医科大学实验动物中心提供。
1.1.2 试剂及试剂盒 卵白蛋白(OVA):Sigma公司;IL-8免疫组化试剂盒:美国ZYMED公司;Trizol试剂:美国Invitrogen公司;反转录聚合酶链反应试剂盒:日本Takara公司。DXM:山东鲁抗辰欣药业有限公司。
1.2 方法
1.2.1 实验分组 30只健康♂SD大鼠随机分为正常组、哮喘组、DXM干预组。
1.2.2 哮喘大鼠模型建立(致敏和激发) 参照文献复制哮喘大鼠模型[5],哮喘组:d 1和d 8分别给予大鼠腹腔注射 OVA 1 mg和Al(OH)3100 mg无菌混悬液致敏。2周后将已致敏大鼠置于雾化箱中,用1%OVA雾化吸入激发,1次/天×30 min,连续7 d。哮喘大鼠表现为易激怒、呼吸急促、鼻翼煽动、进食差、大小便失禁等症状。DXM干预组:致敏与激发同哮喘组,不同的是每日激发前半小时予DXM 1 mg·kg-1腹腔注射。正常组:致敏与激发阶段OVA和DXM均用生理盐水代替。
1.2.3 标本采集和处理 各组大鼠均于末次激发24 h内,以7%水合氯醛进行腹腔注射麻醉,统一切取左肺肺组织10%甲醛固定、酒精脱水、石蜡包埋制作病理切片,肺组织病理切片染色证实有大量嗜酸性粒细胞、淋巴细胞等炎症细胞浸润等表示大鼠哮喘模型制备成功。检测肺组织中IL-8蛋白表达。取右肺组织立即存放于 -80℃冰箱保存,供RTPCR使用。
1.2.4 肺组织病理观察 石蜡切片常规脱蜡至水,行肺组织苏木精-伊红(HE)染色,光学显微镜下观察大鼠肺组织病理学变化。
1.2.5 大鼠肺组织IL-8蛋白表达检测 SP法参照二抗试剂盒说明书进行:切片常规脱蜡至水,枸橼酸盐缓冲液微波修复,IL-8一抗稀释度为1∶350,DAB显色,苏木精复染。阴性对照以PBS替代一抗。选择切片中结构较完整的支气管,判断标准:阳性结果细胞质着色呈棕黄色。每张切片随机选择5个高倍镜下支气管切面(×400),应用捷达801D形态学图像分析系统测定阳性部位的平均光密度值(AOD),代表阳性部位的蛋白表达水平。
1.2.6 大鼠肺组织IL-8基因表达检测 TRIzol提取总RNA并以260/280比值鉴定纯度,一步法进行逆转录扩增。根据GenBank查找IL-8核苷酸序列设计引物,由上海生物工程技术服务有限公司合成。IL-8:(323 bp)上游:5'TGG TCT CAG CCA CCC GC3',下游:5'CCC TGT GGC TTG GCG G 3';β-actin:(191 bp)上游:5'AAC GAC CCC TTC ATT GAC 3',下游:5'TCC ACG ACA TAC TCA GCA 3'。扩增条件:94℃变性5 min,然后按以下条件进行:94℃预变性5 min,94℃变性45 s,55℃退火40 s(IL-8)和55℃ 40s(β-actin),72℃延伸30 s,共35 个循环,72℃延伸10 min。产物经琼脂糖凝胶电泳,溴化乙锭染色后于凝胶成像仪上拍照,图像分析系统测定电泳条带的以目的基因IL-8和内参β-actin的积分光密度值(IOD)的比值表示目的基因的相对量。
1.3 统计学分析 实验数据采用SPSS17.0统计分析软件分析,数据以±s表示。多组间均数比较采用单因素方差分析,两两比较,方差齐者用LSD检验,方差不齐者用Dunnett's T3检验。
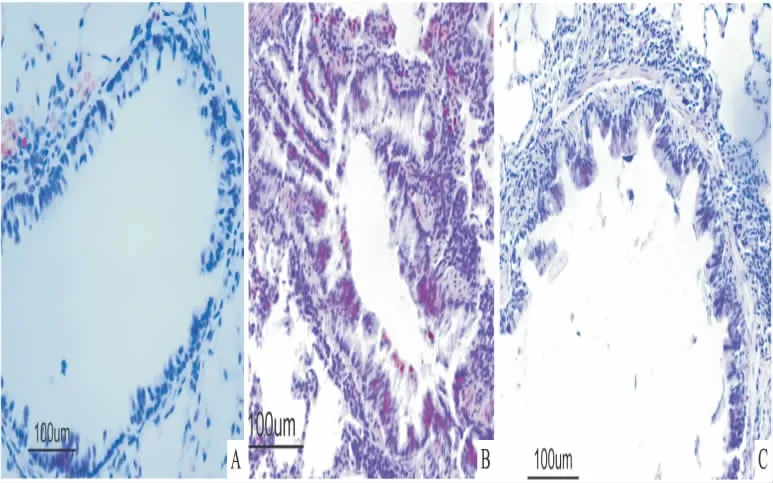
Fig 1 HE-stained lung tissue from rat of each group
2 结果
2.1 肺组织病理改变 正常对照组(Fig 1A)肺组织结构正常,肺泡腔内有个别炎症细胞渗出,支气管壁及周围可见极少量炎症细胞。哮喘组(Fig 1B)肺组织结构轻度破坏,支气管上皮中度变性、坏死、脱落,支气管壁明显增厚,支气管壁及周围、血管周围可见大量炎症细胞浸润,肺泡腔内有较多的炎症细胞浸润,肺泡间隔增厚,组织黏膜充血水肿。地塞米松组(Fig C)肺组织结构正常,肺泡腔及支气管周围的炎症改变较哮喘组明显减轻。
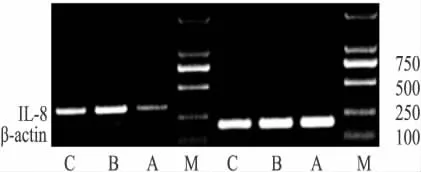
Fig 2 RT-PCR electrophoretic analysis of IL-8 gene expression
2.2 糖皮质激素对大鼠肺组织IL-8基因表达的影响 3组间肺组织IL-8 mRNA表达水平有明显差异性(P<0.01);正常组中大鼠肺组织IL-8 mRNA少量表达,在323 bp处可见阳性条带,与设计片段大小符合(Fig 2)。与正常组相比,哮喘组大鼠肺组织IL-8 mRNA表达明显增高,差异具有显著性(P<0.01),与哮喘组比较,DXM治疗后其表达均有所下降(P<0.01)(Fig 3)。
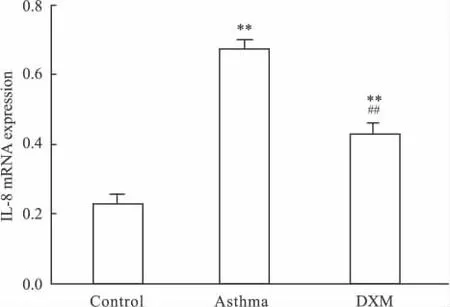
Fig 3 Comparison of IL-8 mRNA(IOD)levels of lung tissue in three groups
2.3 糖皮质激素对大鼠肺组织IL-8蛋白表达的影响 IL-8主要表达于支气管上皮细胞、支气管周围的淋巴滤泡炎性细胞及肺组织的单核巨噬细胞胞质中和肺泡间质细胞中,呈棕黄色颗粒或肺间质黄染,哮喘组表达最强,其次DXM组,正常组表达最弱(见Fig 4)。正常组的IL-8的表达与其他两组比较差异有统计学意义(P<0.01),与哮喘组比较,DXM组的IL-8的表达减少,有统计学意义(P<0.01)。
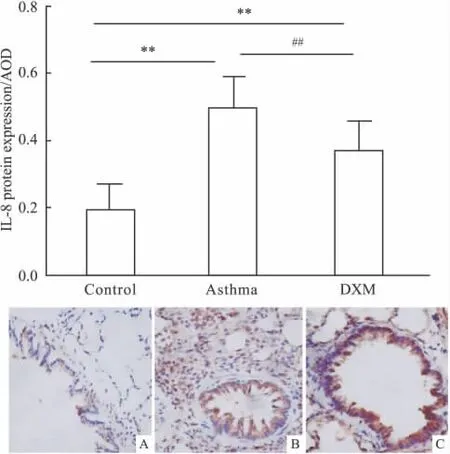
Fig 4 Expression of IL-8 in the lung section of rat of each group
3 讨论
支气管哮喘是当今世界最常见的慢性疾病之一。特别是近20年来,哮喘的发病率增加,已将其列入二十一世纪急需防治的重大疾病之一。目前对哮喘的发生普遍认为是气道内存在广泛炎症,主要包括气道黏膜充血水肿明显、气道上皮损伤脱落、气道内黏液分泌增多及黏液栓的形成、上皮下可见嗜酸粒细胞、肥大细胞、中性粒细胞、淋巴细胞等多种炎症细胞浸润[6-7]。其发病机制复杂,至今尚未完全阐明。通过对气道炎症的研究,发现哮喘是一种主要由嗜酸性粒细胞、肥大细胞、T淋巴细胞、中性粒细胞和多种细胞因子共同参与的非特异性慢性气道炎症[8]。
其中,趋化因子引起中性粒细胞、嗜酸性粒细胞在气道中的迁移和功能活化在哮喘的发生中具有极其重要的作用[9-10]。趋化因子的本质是一类结构、功能相似,分子量在8~10 ku的小分子蛋白[11]。IL-8作为哮喘发病相关细胞因子网络的重要成员,是趋向性细胞因子超家族中的一员,具有趋化中性粒细胞、嗜酸性粒细胞、T淋巴细胞、单核细胞的作用,诱导中性粒细胞变形、激活,使其定向游走,促进细胞内游离钙离子浓度一过性升高,诱导其脱颗粒、释放蛋白水解酶和氧自由基、花生四烯酸等一系列炎性介质,诱导黏附分子的表达,引起呼吸爆发[12],从而促进炎症反应[13]。同时,IL-8趋化并激活嗜酸性粒细胞合成与释放阳离子蛋白,并能引起气道黏膜下微血管通透性增加、腺体分泌亢进、平滑肌收缩及气道上皮细胞脱落,参与哮喘急性发作期和非急性发作期的炎症反应,属调节哮喘气道炎症的上调因子;我们前期利用阳离子蛋白类似物多聚左旋精氨酸作用于气道上皮细胞发现细胞上清液中IL-8分泌增加[14],说明IL-8和阳离子蛋白相互作用,进一步加重气道炎症。IL-8可促使嗜碱性粒细胞趋化,并在IL-3存在情况下引起嗜碱性粒细胞脱颗粒,释放组胺及白三烯,介导不依赖于IgE的变态反应,从而在迟发性哮喘中也起一定的作用。
本课题组前期研究发现哮喘大鼠模型血清、肺泡灌洗液中IL-8水平明显高于正常组[15],我们通过RT-PCR和免疫组化半定量法对大鼠肺组织IL-8基因和蛋白进行检测,又发现哮喘组IL-8基因和蛋白表达显著高于对照组,动物实验进一步证实IL-8参与了支气管哮喘的发作,这一结果与有关哮喘患者的报道结果相符[13],因此可以看出IL-8参与哮喘的炎症过程,故IL-8水平的监测可作为反映支气管哮喘气道炎症和观察病情变化的重要指标。Xatzipsalti等[16]在哮喘患者支气管上皮细胞中发现IL-8基因表达及其分泌的IL-8增加。IL-8可以通过诱导中性粒细胞、嗜酸性粒细胞迁徙和活化,引起中性粒细胞向炎症部位聚集而产生炎症介质,同时,聚集至气道的中性粒细胞及嗜酸性粒细胞又能分泌IL-8,形成循环通路,导致和加重哮喘的发作[17],由此可见,IL-8在哮喘的发病过程中起着十分重要的作用。
目前,糖皮质激素仍是指南推荐治疗哮喘的首选药物,实验证实了经DXM干预后肺组织中IL-8基因和蛋白表达水平明显低于哮喘组,而高于正常组水平,与国内外研究结果相符[18-20]。DXM 抑制IL-8介导的炎症反应,使嗜酸性粒细胞、中性粒细胞趋化、聚集过程受阻而起到很好的抗炎作用。由此可以推测糖皮质激素DXM可能是通过下调趋化因子IL-8表达,从而减弱对嗜酸性粒细胞、中性粒细胞等炎症细胞的趋化、激活、聚集作用从而减轻气道炎症反应,最终达到治疗哮喘的目的。
[1]Kulkarni NS,Hollins F,Sutcliffe A,et al.Eosinophil protein in airway macrophages:a novel biomarker of eosinophilic inflammation in patients with asthma[J].J Allergy Clin Immunol,2010,126(1):61-9.
[2]夏晓东,吴立琴,徐 慧,等.罗红霉素通过诱导型一氧化氮合酶/一氧化氮途径抑制哮喘大鼠气道炎症[J].中国药理学通报,2009,25(9):1223-7.
[2]Xia X D,Wu L Q,Xu H,et al.Roxithromycin inhibited airway inflammation through pathway of inducible nitric oxide synthase and nitric oxide in rat asthmatic model[J].Chin Pharmacol Bull,2009,25(9):1223-7.
[3]van Rensen E L,Evertse C E,van Schadewijk W A,et al.Eosinophils in bronchial mucosa of asthmatics after allergen challenge:effect of anti-IgE treatment[J].Allergy,2009,64(1):72-80.
[4]Halwani R,Al-Abri J,Beland M,et al.CC and CXC chemokines induce airway smooth muscle proliferation and survival[J].J Immunol,2011,186(7):4156-63.
[5]李昌崇,童夏生,阮正英,等.中性粒细胞弹性蛋白酶和IL-8在大鼠哮喘中的作用及地塞米松调控[J].中华微生物学和免疫学杂志,2005,25(9):737-41.
[5]Li C C,Tong X S,Ruan Z Y,et al.The function of neutrophil elastase,IL-8 and regulation of dexamethasone in rat asthma[J].Chin J Microbiol Immuol,2005,25(9):737-41.
[6]曹 娟,陈建辉,朱述阳.瘦素对支气管哮喘大鼠气道炎症及Th1/Th2细胞因子表达作用的影响[J].中华结核和呼吸杂志,2009,32(3):171-6.
[6]Cao J,Chen J H,Zhu S Y.Effects of leptin on airway inflammation and the expression of Th1/Th2 cytokines in asthmatic rats[J].Chin J Tuberc Respir Dis,2009,32(3):171-6.
[7]Jang H Y,Ahn K S,Park M J,et al.SkullcapflavoneⅡ inhibits ovalbumin-induced airway inflammation in a mouse model of asthma[J].Int Immunopharmacol,2012,12(4):666- 74.
[8]Nakagome K,Nagata M.Pathogenesis of airway inflammation in bronchial asthma[J].Auris Nasus Larynx,2011,38(5):555-63.
[9]Wang H Y,Shen H H,Lee J J,Lee N A.CD69 expression on airway eosinophils and airway inflammation in a murine model[J].Chin Med J(Engl),2006,119(23):1983-90.
[10]闫明华,朱述阳,段存玲,等.PolyI:C介导气道平滑肌细胞TLR3和IL-8、Eotaxin的表达[J].细胞与分子免疫学杂志,2010,26(10):966-8.
[10]Yan M H,Zhu S Y,Duan C L,et al.Expression of TLR3 and IL-8,Eotaxin in the airway smooth muscle cells induced by PolyI:C[J].Chin J Cell Mol Immunol,2010,26(10):966- 8.
[11]Afshar K,Vucinic V,Sharma OP.Eosinophil cell:pray tell us what you do[J].Curr Opin Pulm Med,2007,13(5):414- 21.
[12]Ryan J J,McReynolds L J,Keegan A,et al.Growth and gene expression are predominantly controlled by distinct regions of the human IL-4 receptor[J].Immunity,1996,4(2):123-32.
[13]赵学琴,陈 晔,袁雅冬.C反应蛋白、白细胞介素8对哮喘病情评估价值研究[J].临床荟萃,2009,24(14):1217-20.
[13]Zhao X Q,Chen Y,Yuan Y D.Evaluation on value of C-reactive protein,interleukin-8 in acute exacerbation of asthma[J].Clinical Focus,2009,24(14):1217-20.
[14]Fan XY,van den Berg A,Snoek M,et al.Arginine deficiency augments inflammatory mediator production by airway epithelial cells in vitro[J].Respir Res,2009,3;10:62.
[15]汪 浩,武晓兰,谭红霞,范晓云.IL-8和Eotaxin在哮喘大鼠中的表达及地塞米松的作用[J].安徽医科大学学报,2012,47(3):270-3.
[15]Wang H,Wu X L,Tan H X,Fan X Y.Expression of IL-8 and Eotaxin in rat asthma model and role of dexmethasone[J].J Anhui Med Univ,2012,47(3):270-3.
[16]Xatzipsalti M,Psarros F,Konstantinou G,et al.Modulation of the epithelial inflammatory response to rhinovirus in an atopic environment[J].Clin Exp Allergy,2008,38(3):466- 72.
[17]Uddin M,Nong G,Ward J,et al.Prosurvival activity for airway neutrophils in severe asthma[J].Thorax,2010,65(8):684-9.
[18]Mercado N,To Y,Kobayashi Y,et al.p38 mitogen-activated protein kinase-γ inhibition by long- acting β2 adrenergic agonists reversed steroid insensitivity in severe asthma[J].Mol Pharmacol,2011,80(6):1128-35.
[19]Qiao J,Li A,Jin X,et al.Mastic alleviates allergic Inflammation in asthmatic model mice by inhibiting Recruitment of Eosinophils[J].Am J Respir Cell Mol Biol,2011,45(1):95-100.
[20]陈 娟,罗健东,李 冰,等.生理浓度的糖皮质激素对大鼠肺泡上皮细胞炎症因子生成的抑制作用[J].中国药理学通报,2007,23(8):1073-6.
[20]Chen J,Luo J D,Li B,et al.Inhibition of physiological concentration of glucocorticoids on LPS-induced inflammation in rat alveolar epithelial cells[J].Chin Pharmacol Bull,2007,23(8):1073-6.

