PI3K/Akt信号通路在硫化氢保护PC12细胞对抗化学性缺氧损伤的作用
孟金兰,陈雅嘉,陈 红,董艳芬,邢德刚,梁燕玲,兰爱平,冯鉴强
(1.广东药学院生理学系,广东广州 510006;2.广州医学院荔湾医院体检科,广东 广州 510170;3.广州市
越秀区六榕街社区卫生服务中心药剂科,广东广州 510180;4.中山大学中山医学院生理教研室,广东广州 510080)
磷脂酰肌醇-3-激酶(Phosphatidylinositol-3-kinase,PI3K)可以磷酸化肌醇磷脂肌醇环上的3’-OH,其家族包括许多脂质激酶。Akt是原癌基因cakt的表达产物,它参与生长因子激活的经PI3K介导的信号过程,是神经元存活、神经和血管新生、轴突以及树突形成、突触结构形成和突触间信息传递所必需[1-2]。
PI3K/Akt信号转导通路具有调控物质代谢、基因表达、细胞迁移、增殖和存活等多种生物学功能,也是神经元存活的主要途径之一。当PI3K/Akt通路激活后不仅可以保护在体鼠脑缺氧缺血损伤[3],而且也可抑制氧和糖剥夺诱导的皮层神经元凋亡[4]。由此看来,PI3K/Akt信号通路的激活对于保护神经元抗缺氧-缺血损伤尤为重要。
近年,本课题组[5-6]及其他学者[7]证实 H2S 具有神经保护作用,此作用机制可能与H2S的抗氧化作用,上调热休克蛋白90(Hsp90)及抑制p38MAPK(丝裂原蛋白激酶)等有关[5-7]。然而,H2S能否激活神经细胞PI3K/Akt信号通路?若可以,激活的PI3K/Akt途径是否介导H2S的神经保护作用?以上问题均未明了。
为此,本文应用化学性低氧模拟剂CoCl2损伤来源于大鼠嗜铬细胞瘤细胞株PC12细胞(其形态结构和功能特性与神经元相似),给予 H2S供体NaHS预处理建立抗化学性缺氧损伤的神经细胞保护模型[6]。拟着重探讨:(1)H2S预处理能否激活PC12细胞PI3K/Akt信号通路;(2)PI3K/Akt信号通路是否介导NaHS预处理的神经保护作用,为进一步揭示新型气体分子H2S的神经保护作用的信号转导机制及防治缺氧缺血性脑病拓展新思路。
1 材料和方法
1.1 材料 NaHS、CoCl2、Ly294002购自美国 Sigma-Aldrich公司;CCK-8试剂盒购自日本 Dojindo Lab;DMEM培养基购自 Gibico公司;Akt、p-Akt抗体购自CST公司。PC12细胞由中山大学实验动物中心提供。
1.2 细胞培养 PC12细胞培养于含10%胎牛血清的DMEM培养基中。在37℃、5%CO2条件下培养,选取对数生长期细胞进行实验。
1.3 实验分组
1.3.1 探讨 NaHS干预 PC12细胞对 Akt磷酸化(P-Akt)水平的影响 实验分组:根据NaHS干预浓度将 PC12 细胞分为 0、50、100、200、400、800 μmol·L-16组,每组均干预30 min,分别检测NaHS对PC12细胞P-Akt水平的影响。
1.3.2 探讨 PI3K/Akt通路抑制剂 Ly294002对H2S神经细胞保护作用的影响 实验分组:(1)空白对照组(Control);(2)单独NaHS组(NaHS):单独应用 400 μmol·L-1NaHS处理 PC12 细胞 30 min。(3)CoCl2损伤组(CoCl2):应用 600 μmol·L-1CoCl2处理 PC12细胞;(4)NaHS+CoCl2组:在CoCl2处理前30 min 加入400 μmol·L-1NaHS;(5)Ly294002+NaHS+CoCl2:在应用 NaHS前用15 μmol·L-1Ly294002 处理细胞 30 min,其余的实验步骤与(4)组相同;(6)单独 Ly294002组(Ly294002):应用 15μmol· L-1Ly294002 处理PC12细胞30 min。检测各组细胞p-Akt的表达及存活率的改变。
1.4 细胞存活率的检测 取对数生长期细胞,以1×104/孔接种于96孔板,在37℃、5%CO2条件下培养过夜后,更换为含有不同处理因素的培养基,每组设5个复孔。处理结束后各组细胞分别加入CCK-8(每孔100 μl加10 μl CCK-8)37℃孵育4 h,随后在酶联免疫检测仪测定每孔的吸收值(λ=450 nm),按公式:存活率(%)=(实验组OD-空白对照组OD)/(正常对照组OD-空白对照组OD)×100%,求出实验组的存活率,重复3次。
1.5 PI染色流式细胞仪(FCM)检测细胞凋亡
细胞按实验要求给以不同的因素处理后,离心收集细胞,PBS洗2次,加入预冷的70%乙醇4℃固定过夜。用PBS洗2遍,PI染色后,用流式细胞仪检测细胞内DNA的含量(激发波长:488 nm;发射波长:610 nm)。每样本计数12 000个细胞,以DNA组方图中低于G1期DNA含量的亚G1峰的大小代表凋亡细胞数的多少。
1.6 Western blot法检测p-Akt的水平 离心收集细胞。预冷的PBS洗涤2次,加入裂解缓冲液,4℃静置30 min。12 000×g离心10 min,取上清,采用BCA法进行蛋白定量。总蛋白经SDS-PAGE分离后,转移至PVDF膜上。用5%脱脂奶粉封闭1.5 h。随后加入p-Akt抗体(1∶1 000),4℃孵育过夜,TBST洗3次,加入相应的二抗(羊抗兔IgG),孵育1 h,漂洗3次。将PVDF膜用发光试剂ECL显色后,用ImageJ 1.410进行灰度分析。
1.7 统计学处理 实验数据经SPSS 11.0统计软件进行统计分析,数据用±s表示,统计方法采用One-way ANOVA。
2 结果
2.1 NaHS对PC12细胞p-Akt水平的影响 应用不同浓度(50、100、200、400、800 μmol·L-1)NaHS干预 PC12细胞 30 min,观察 p-Akt表达情况。Western blot结果显示,在 50 ~ 400 μmol·L-1浓度范围内,呈浓度依赖性地上调p-Akt的水平,尤以400 μmol·L-1NaHS 干预时表达最高,为正常表达的2.7倍(Fig 1 A,B)(P<0.01),但当NaHS浓度为 800 μmol·L-1时,p-Akt水平尽管明显多于正常对照组(P<0.01),但比400 μmol·L-1组的明显减少(P<0.01)。上述浓度的NaHS对总Akt水平无明显影响。
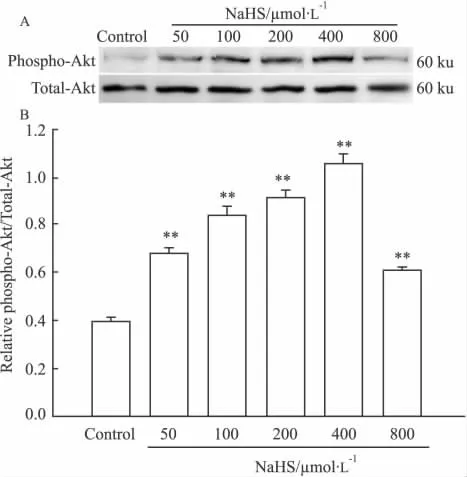
Fig 1 Effect of NaHS at different concentrations on the expression of Akt(±s,n=3)
2.2 PI3K介导了NaHS预处理诱导的Akt活化除受 PI3K激活外,Akt也受其它第二信使如Ca2+、cAMP的调节[8]。为了揭示 NaHS诱导的 Akt活化是否通过PI3K途径介导?我们在NaHS预处理前使用PI3K抑制剂Ly294002,检测其对p-Akt水平的影响。结果显示Ly294002抑制了NaHS预处理对p-Akt的上调作用(Fig 2),提示PI3K通路参与NaHS预处理对PC12细胞Akt的活化。
2.3 PI3K/Akt信号通路介导H2S抗CoCl2诱导的细胞毒性作用 为了探讨PI3K/Akt途径在NaHS预处理抗CoCl2诱导的细胞毒性作用,在NaHS预处理前 30 min,给予 PI3K抑制剂 Ly294002(15 μmol·L-1)作用于 PC12细胞,观察 Ly294002能否拮抗NaHS预处理对细胞毒性的抑制作用。结果显示,NaHS预处理可以保护PC12细胞对抗600 μmol·L-1CoCl2引起的细胞毒性,能使细胞存活率从(55.90±3.5)%升高至(77.78±3.4)%(P<0.01)。而在预处理前使用15μmol·L-1Ly294002,使 PC12细胞的存活率从(77.78±3.4)%降低至(56.20±3.6)%(P<0.01)。400 μmol·L-1NaHS 及15 μmol·L-1Ly294002 本身并不影响PC12细胞的存活率。结果提示PI3K/Akt信号通路介导了H2S抗CoCl2诱导的细胞毒性作用。

Fig 2 PI3K mediates activation of、Akt induced by NaHS preconditioning(n=3)
2.4 PI3K/Akt信号通路介导H2S抑制CoCl2诱导的细胞凋亡作用 细胞凋亡时,由于DNA断裂,在细胞DNA分布图上的G1峰前可出现亚二倍体峰,即凋亡细胞所形成的凋亡峰。用流式细胞仪检测PC12细胞的凋亡率,结果如Fig 4所示:PC12细胞经400 μmol/L NaHS 预处理后,可使 600 μmol/L CoCl2引起的细胞凋亡率由(35.7±1.1)%下降至(18.3±2.5)%(P<0.01),而预处理前使用Ly294002,细胞的凋亡率从由(18.3±2.5)%上升为(34.0±2.5)%(P<0.01),NaHS和 Ly294002本身没有诱导凋亡的作用(Fig 4)。
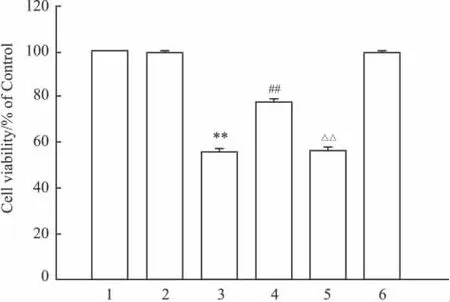
Fig 3 Effect of Ly294002 on increasing of cell viability induced by NaHS preconditioning(±s,n=5)

Fig 4 Influence of Ly294002 on anti-apoptosis induced by NaHS preconditioning(±s,n=3)
3 讨论
最近,本课题组证实,H2S预处理能保护神经细胞对抗化学性缺氧诱导的损伤作用[5-6],其保护机制可能涉及多条信号通路。在多种实验模型,PI3K/Akt通路被证实是神经保护的。例如,在鼠脑局灶性缺血/再灌注(I/R)损伤模型,PI3K/Akt通路的激活可以显著减小脑损伤面积和神经元的凋亡数目[9]。激活的 Akt还可保护鼠海马神经元[10-11]及皮层神经元[4]对抗缺氧/复氧诱导的凋亡。
为了探讨PI3K/Akt通路是否参与H2S保护PC12细胞对抗化学性缺氧诱导的损伤作用,本实验首先观察H2S能否激活PI3K/Akt信号通路。研究结果表明,H2S供体NaHS呈浓度依赖性地引起PC12细胞Akt的活化。但是随着NaHS浓度的增加,对p-Akt水平的促进作用逐渐减弱,表明NaHS可以引起PC12细胞Akt的活化,但Akt的活化程度与其作用浓度有关。
为了证实Akt的活化是否由PI3K途径介导,本实验在NaHS预处理前给予PI3K的抑制剂Ly294002。Ly294002是PI3K特异的拮抗剂,在许多研究中被用来抑制 PI3K的活性[12]。Akt位于PI3K的下游,PI3K可使Akt发生磷酸化具有活性,当加入 PI3K抑制剂 Ly294002后,Ly294002裂解PI3K催化亚基 p110γ,并随后抑制激活的 p-Akt。本研究发现,Ly294002能抑制NaHS预处理对Akt的活化。表明在PC12细胞中,NaHS是通过PI3K途径引起Akt活化。新近研究结果也表明,NaHS可以促进离体鼠心脏[13]及内皮[14]等不同类型细胞PI3K途径依赖的Akt活化,支持本实验结果。
在上述研究基础上,本文进一步探讨PI3K/Akt通路是否介导NaHS预处理诱导的神经细胞保护作用。为了阐明这一问题,在 NaHS预处理前给予PI3K抑制剂Ly294002,细胞损伤检测结果表明,CoCl2明显降低了细胞存活率,增加了细胞的凋亡;NaHS预处理使PC12细胞提高对CoCl2的抵抗能力,增加了细胞的存活率同时减少了凋亡。但是在NaHS预处理前使用Ly294002,则拮抗了NaHS预处理的细胞保护作用,使细胞的存活率下降及凋亡率增加。提示PI3K/Akt通路介导了NaHS预处理抗化学性缺氧的细胞保护作用。本实验为深入阐明H2S的神经细胞保护作用机制提供了新颖的实验依据。
[1]Akama K T,McEwen B S.Estrogen stimulates postsynaptic density-95 rapid protein synthesis via the Akt/protein kinase B pathway[J].J Neurosci,2003,23(6):2333 -9.
[2]Markus A,Zhong J,Snider W D.Raf and akt mediate distinct aspects of sensory axon growth[J].Neuron,2002,35(1):65 -76.
[3]Li L,Qu Y,Mao M,et al.Phosphoinositide 3-kinase/Akt pathway involved in regulation of hypoxia inducible factor lalpha in hypoxia ischemia brain damage of neonatal rats[J].Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2008,22(9):1102 -7.
[4]Chung H,Seo S,Moon M,et al.Phosphatidylinositol-3-kinase/Akt/glycogen synthase kinase-3 beta and ERK1/2 pathways mediate protective effects of acylated and unacylated ghrelin against oxygen-glucose deprivation-induced apoptosis in primary rat cortical neuronal cells[J].J Endocrinol,2008,198(3):511 -21.
[5]Lan A P,Xiao L C,Yang Z L,et al.Interaction between ROS and p38MAPK contributes to chemical hypoxia-induced injuries in PC12 cells[J].Mol Med Report,2012,5(1):250 -5.
[6]孟金兰,兰爱平,杨春涛,等.热休克蛋白90在硫化氢保护PC12细胞对抗化学性缺氧损伤中的作用[J].中国药理学通报,2010,26(1):103-7.
[6]Meng J L,Mei W Y,Dong Y F,et al.Heat shock protein 90 mediates cytoprotection by H(2)S against chemical hypoxia-induced injury in PC12 cells[J].Clin Exp Pharmacol Physiol,2011,38(1):42-9.
[7]Kimura Y,Kimura H.Hydrogen sulfide protects neurons from oxidative stress[J].FASEB J,2004,18(10):1165 -7.
[8]Yuan J,Yankner B A.Apoptosis in the nervous system[J].Nature,2000,407(6805):802 -9.
[9]Wang H Y,Wang G L,Yu Y H,et al.The role of phosphoinositide-3-kinase/Akt pathway in propofol-induced postconditioning against focal cerebral ischemia - reperfusion injury in rats[J].Brain Res,2009,1297:177-84.
[10] Guo S Y,Yang G P,Jiang D J,et al.Protection of capsaicin against hypoxia-reoxygenation induced apoptosis of rat hippocampal neurons[J].Can J Physiol Pharmacol,2008,86(11):785 -92.
[11] Dai Z,Xiao J,Liu S Y,et al.Rutaecarpine inhibits hypoxia/reoxygenation-induced apoptosis in rat hippocampal neurons[J].Neuropharmacology,2008,55(8):1307-12.
[12] Wu J,Ding W G,Matsuura H,et al.Inhibitory actions of the phosphatidylinositol 3-kinase inhibitor LY294002 on the human Kv1.5 channel[J].Br J Pharmacol,2009,156(2):377 - 87.
[13]于 水,杨海扣,米 琰,等.PI3K/Akt信号通路在外源性硫化氢后处理大鼠离体心肌中的作用[J].中国药理学通报,2010,26(6):759-64.
[13] Yu S,Yang H K,Mi Y,et al.Function of PI3k/Akt signaling pathway in exogenous hydrogen sulfide postconditioning on isolated rat hearts[J].Chin Pharmacol Bull,2010,26(6):759 - 64.
[14] Cai W J,Wang M J,Moore P K,et al.The novel proangiogenic effect of hydrogen sulfide is dependent on Akt phosphorylation[J].Cardiovasc Res,2007,76(1):29 -40.

