川续断皂苷Ⅵ对3T3-L1细胞的增殖和分化影响
陈小宇,祝爱珍,刘成成,朱锦灿,刘革修
(暨南大学血液病研究所,广东广州 510632)
川续断属于川续断科川续断属,是一种多年生草本植物,主要生长于潮湿的山地。续断是川续断的干燥根提取物,在传统中医学中有滋补、抗骨质疏松、抗衰老等的功效,能够治疗腰背痛、外伤血肿、先兆流产和骨折等疾病[1]。Li等[2]研究表明川续断皂苷Ⅵ能够通过激活PI3K/Akt通路抑制缺氧条件下心肌细胞的凋亡,Niu等[3]也通过研究证实了川续断皂苷Ⅵ能够激活p38和ERK1/2活性促进成骨细胞增殖和分化,并且川续断皂苷Ⅵ具有促进大鼠体外间充质干细胞(mesenchymal stem cell,MSC)向成骨细胞增殖和分化的作用[4]。成骨细胞、软骨细胞由MSCs分化而来,MSC在适宜条件下还可以诱导分化为脂肪细胞。机体内成脂分化和成骨分化是相互制约、相互平衡的过程,目前实验已证实多种促进成骨的药物同时具有抑制成脂的作用,如维生素D3
[5]、利赛膦酸[6]、姜黄素[7]等,本研究就川续断皂苷Ⅵ对3T3-L1前脂肪细胞增殖和成脂分化影响进行探讨。
1 材料与方法
1.1 主要试剂 3T3-L1前脂肪细胞株由本研究所冻存,川续断皂苷Ⅵ购于四川维克奇生物公司,DMEM高糖培养液、胰酶购自Hyclone公司,胎牛血清、地塞米松、IBMX、胰岛素、油红O染液购自GIBCO公司,噻唑蓝购自科昊公司,葡萄糖及游离脂肪酸检测试剂盒购于南京建成生物工程研究所,RNAiso Reagent、cDNA合成试剂盒、RT-PCR试剂盒购自TOYOBO。
1.2 主要方法
1.2.1 3T3-L1前脂肪细胞培养 3T3-L1前脂肪细胞用DMEM高糖培养液培养,置于37℃、5%CO2的培养箱,每隔2 d换液1次,倒置相差显微镜下观察细胞生长状况。
1.2.2 3T3-L1前脂肪细胞的诱导分化 3T3-L1前脂肪细胞生长至完全融合后2 d开始诱导分化。即将DMEM完全培养液弃掉,换上含5 mg·L-1胰岛素、0.5 mmol·L-1IBMX、1 μmol·L-1地塞米松的DMEM完全培养液培养,2 d后再换用含5 mg·L-1胰岛素的 DMEM完全培养液培养2 d。随后用DMEM完全培养液继续培养2 d。
1.2.3 川续断皂苷Ⅵ对3T3-L1前脂肪细胞增殖的影响 将3T3-L1前脂肪细胞以3×103/孔的密度接种于96孔板,培养24h后换以含不同浓度(0、0.1、1、10、50、100 μmol·L-1)川续断皂苷Ⅵ的培养液,每组设5个复孔,分别在24、48和72 h检测其增殖活性。加入20 μl 5 g·L-1MTT 工作液,置于37℃培养箱继续孵育,4 h后吸净孔中液体,每孔加150 μl二甲基亚砜,震荡10 min后在酶标仪上读取490 nm处的吸光度值。
1.2.4 川续断皂苷Ⅵ对3T3-L1前脂肪细胞分化的影响 将3T3-L1前脂肪细胞接种至48孔板,待细胞完全融合2 d后开始诱导,分化过程中加入不同浓度川续断皂苷Ⅵ(0、10、25、50 μmol·L-1),观察其对3T3-L1前脂肪细胞成脂分化的影响。
1.2.5 油红O染色 诱导分化6 d后细胞经4%多聚甲醛固定30 min后,用平衡盐溶液(PBS)洗涤3次,加入油红O染液孵育60 min,吸弃液体用PBS漂洗3次,倒置显微镜下观察脂滴形成情况并摄像。加入异丙醇(每孔200 μl),5 min后通过酶标仪测量A520nm处的吸光度值。
1.2.6 葡萄糖及游离脂肪酸含量测定 收集各组诱导分化第6天培养液,参照试剂盒操作手册说明,检测各组葡萄糖及游离脂肪酸含量。
1.2.7 Q-PCR检测成脂分化基因的表达 收集各组成脂诱导分化第6天细胞,用TRIzol试剂提取总RNA,分光光度计测定总 RNA浓度,A260/A280均在1.8~2.0之间。应用随机引物和反转录酶试剂盒反转录合成cDNA,使用SYBR PremixEx TaqTM Real-time PCR试剂盒配制20 μl PCR反应体系,采用实时荧光定量PCR法检测成脂相关基因mRNA表达,荧光定量PCR引物见Tab 1。PCR扩增条件为:93℃ 3 min,然后 93℃ 1 min,60℃ 1 min,72℃ 1 min,共45个循环。以目的基因扩增量/内参照(GAPDH)基因扩增量表示所要检测基因的表达量。重复检测3次,每次做3个复孔,分别计算同一样品3个复孔的Ct值,以同一样品中GAPDH Ct作为内参照,分别计算各组2-ΔΔCt,用以±s表示PPARγ和C/EBP α mRNA相对表达量。

Tab 1 Primer sequences of the detected genes in Q-PCR analysis
2 结果
2.1 川续断皂苷Ⅵ对3T3-L1前脂肪细胞增殖的影响 与空白组相比,川续断皂苷Ⅵ处理后对3T3-L1前脂肪细胞有促进增殖效应(P<0.05),结果如Tab 2。作用24 h后,从川续断皂苷Ⅵ浓度为1 μmol·L-1开始,OD值随药物浓度增加而升高。随着处理时间延长到72 h,只有100 μmol·L-1川续断皂苷Ⅵ组OD值高于空白组,其余组促增殖效应不明显(P>0.05)。
Tab 2 Effects of asperosaponinⅥon the proliferation of 3T3-L1 preadipocyte(±s,n=5)

Tab 2 Effects of asperosaponinⅥon the proliferation of 3T3-L1 preadipocyte(±s,n=5)
*P<0.05 vs control
ASA/μmol·L -124 h 48 h 72 h 0 0.336 ±0.01 0.614 ±0.02 0.824 ±0.03 0.1 0.345 ±0.02 0.574 ±0.09 0.815 ±0.06 1 0.372 ±0.03* 0.634 ±0.06* 0.827 ±0.04 10 0.391 ±0.01* 0.665 ±0.03* 0.829 ±0.08 50 0.377 ±0.01* 0.665 ±0.05* 0.849 ±0.05 100 0.363 ±0.03* 0.601 ±0.04 0.896 ±0.04*
2.2 川续断皂苷Ⅵ对3T3-L1前脂肪细胞分化的影响 于诱导分化过程中加入不同浓度川续断皂苷Ⅵ(0、10、25、50 μmol·L-1)处理 6 d,采用油红 O染色,显微镜下观察并摄像,如Fig 1所示,川续断皂苷Ⅵ抑制成脂,随着药物浓度增加3T3-L1细胞中被染色的脂滴含量明显下降。用异丙醇萃取油红O后,不同浓度组OD值与对照组比较均明显下降(P<0.05),见 Fig 2。
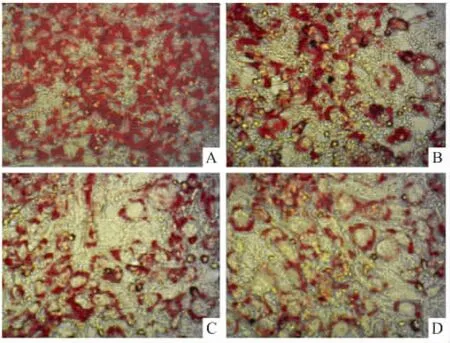
Fig 1 Oil red O staining after adipogenic induction of differentiation for 6 days
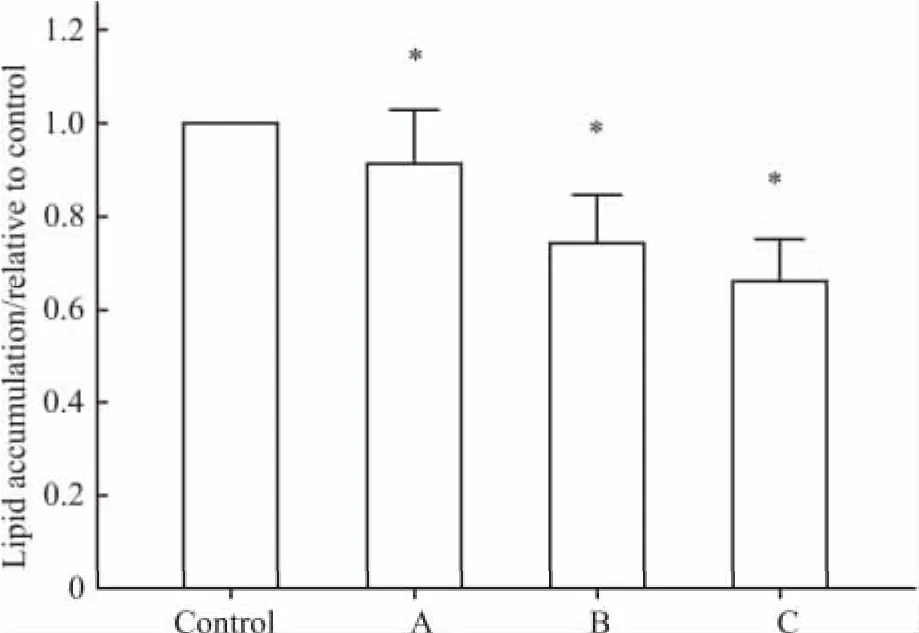
Fig 2 Effects of asperosaponinⅥon lipid accumulation after adipogenic induction of differentiation for 6 days
2.3 川续断皂苷Ⅵ对3T3-L1前脂肪细胞糖脂代谢的影响 诱导分化后第6天每组上清液中的葡萄糖及游离脂肪酸的浓度,结果显示加入25、50 μmol·L-1川续断皂苷Ⅵ组培养上清中葡萄糖高于对照(P<0.05),10 μmol·L-1川续断皂苷Ⅵ抑制葡萄糖效应作用不明显(P>0.05);而各组游离脂肪酸浓度则均低于对照组(P<0.05),且呈剂量依赖性,见Fig 3。
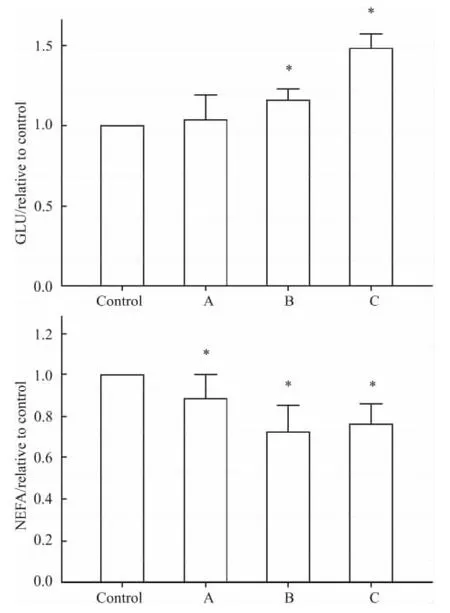
Fig 3 Effects of asperosaponinⅥon the concentration of glucose(up)and non-esterified fatty acid(down)in culture supernatant after adipogenic induction of differentiation for 6 days
2.4 川续断皂苷Ⅵ对3T3-L1前脂肪细胞成脂相关基因mRNA表达的影响 3T3-L1前脂肪细胞成脂诱导分化过程中,加入 10、25、50 μmol·L-1浓度组的川续断皂苷Ⅵ处理6 d后均能明显抑制PPARγ和C/EBP α mRNA表达(P<0.05),如Fig 4。各组PPARγ mRNA抑制率分别为 68.8%、42.2%、34.7%;C/EBP α mRNA表达量与对照组相比亦下降,各组分别为80.0%、32.3%、6.3%。为了研究川续断皂苷Ⅵ对3T3-L1前脂肪细胞成脂作用的时间点,本实验在成脂的不同时间(d 0~6,d 1~2,d 3 ~4,d 5 ~6)加入川续断皂苷Ⅵ(50 μmol·L-1),发现川续断皂苷Ⅵ在成脂不同时间点加入均有抑制作用,成脂分化d 3-4加入川续断皂苷Ⅵ抑制效应最明显(PPARγ和C/EBP α mRNA抑制率分别为19.6%、26.4%,P<0.05),见 Fig 5。
3 讨论
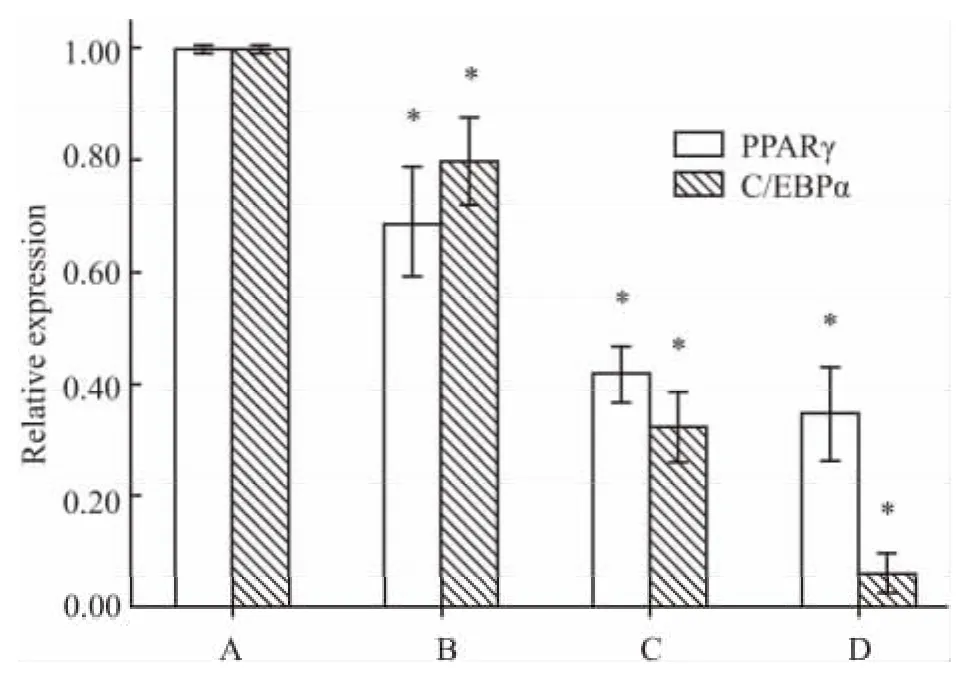
Fig 4 Effects of asperosaponinⅥat different concentrations on the transcriptional level of PPAR γ and C/EBP α mRNA after adipogenic induction of differentiation for 6 days

Fig 5 Effects of ASA VI(50 μmol·L -1)at various intervals on the transcriptional level of PPAR γ and C/EBP α mRNA after adipogenic induction of differentiation for 6 days
机体脂肪细胞分化过程包括定向分化和终末分化两个阶段[8]。由MSC向前体脂肪细胞分化的过程属于定向分化,终末分化则是指前脂肪细胞形成成熟脂肪细胞的过程。前体脂肪细胞虽然具有成脂分化能力,但如果没有外源性的成脂刺激,不会自发的进入终末分化阶段。研究显示多种转录因子和细胞周期蛋白参与了调节成熟脂肪细胞形成[9],其中过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)、CCAAT 增强子结合蛋白(CCAAT/enhancer-binding proteins,C/EBPs)是终末分化过程中不可或缺的转录因子[10]。PPARs是一类能被过氧化物酶体增殖物激活的核内受体家族,包括 PPARα、PPARβ 和 PPARγ,其中 PPARγ 与脂肪细胞分化最为密切。PPARγ与配体结合后被激活,与视黄酸X受体形成PPARγ-RXR异二聚体,进一步同反应元件结合激活靶基因最终导致终末分化的脂肪细胞形成[11]。C/EBP家族与脂肪细胞分化相关的 3个成员为:C/EBPα、C/EBPβ和 C/EBPδ。细胞接受成脂刺激后 C/EBPβ和 C/EBPδ的表达增加,促进成脂分化。在成脂分化后期C/EBPβ和C/EBPδ降低。C/EBPα可结合和激活特异性基因的启动子,促进脂肪细胞进入终末分化阶段[12]。本研究探讨了川续断皂苷Ⅵ对3T3-L1前脂肪细胞的增殖、成熟分化的影响及其机制。结果不仅发现,在处理 24 ~72 h 期间,1 ~100 μmol·L-1浓度川续断皂苷Ⅵ均显示有促进3T3-L1前脂肪细胞增殖作用,其中10 μmol·L-1浓度组作用24 h后细胞增殖最明显,随着川续断皂苷Ⅵ浓度增加,促增殖效应不明显;在处理72 h时,只有100 μmol·L-1川续断皂苷Ⅵ组细胞增殖明显高于空白组,其余组促增殖效应不明显。该结果说明川续断皂苷Ⅵ对3T3-L1前脂肪细胞有一定的促其增殖作用。这也可能提示存在川续断皂苷Ⅵ在培养基中不稳定或者被细胞代谢等因素。其具体机制有待进一步研究。同时更主要发现有,10、25、50 μmol·L-1浓度川续断皂苷Ⅵ能剂量依赖性抑制3T3-L1前脂肪细胞向成熟脂肪细胞分化,降低脂肪细胞中脂滴聚集,减少成脂诱导培养液中葡萄糖的吸收利用,并减少培养液中游离脂肪酸的形成。Q-PCR检测结果则显示川续断皂苷Ⅵ能下调成脂过程中关键转录因子PPARγ和C/EBPα基因表达,也呈剂量依赖性。进一步研究还发现当在成脂分化的不同时间点加入50 μmol·L-1川续断皂苷Ⅵ均能下调 PPARγ 和 C/EBPαmRNA表达,说明川续断皂苷Ⅵ能作用成脂终末分化的整个环节,抑制脂肪细胞形成。但川续断皂苷Ⅵ是否也能抑制成脂定向分化以及怎样调节PPARγ和C/EBPα表达的信号机制还有待研究。
机体MSC是成脂分化和成骨分化的共同前体细胞,具有双向性,但是相互制约。骨髓中MSC是造血干细胞微环境重要组成部分,也具有成骨和成脂双向分化特性,向成骨细胞分化则对造血具有促进作用[13],而向脂肪细胞分化则对造血具有负性作用[14]。在传统中医中川续断皂苷Ⅵ已经显示具有治疗骨质疏松的作用,即促进成骨作用,但在抑制成脂分化方面的研究较少。本研究结果则不仅可进一步了解其药理作用,同时可为研究临床上骨髓脂肪化提供新的思路。
[1]Hung T M,Jin W,Thuong P T,et al.Cytotoxic saponins from the root of Dipsacus asper Wall[J].Arch Pharm Res,2005,28(9):1053-6.
[2]Li C,Tian J,Li G,et al.AsperosaponinⅥ protects cardiac myocytes from hypoxia-induced apoptosis viaactivation of the PI3K/Akt and CREB pathways[J].Eur J Pharmacol,2010,649(1 - 3):100-7.
[3]Niu Y,Li Y,Huang H,et al.AsperosaponinⅥ,a saponin component from Dipsacus asper wall,induces osteoblast differentiation through bone morphogenetic protein-2/p38 andextracellular signalregulated kinase 1/2 pathway[J].Phytother Res,2011,25(11):1700-6.
[4]武密山,赵素芝,任立中,等.川续断皂苷Ⅵ诱导大鼠骨髓间充质干细胞向成骨细胞方向分化的研究[J].中国药理学通报,2012,28(2):222 -6.
[4]Wu M S,Zhao S Z,Ren L Z,et al.Experimental study of akebia saponin D on the differentiation of rat bone marrow derived mesenchymal stem cells to osteoblastsin vitrovia induction[J].Chin Pharmacol Bull,2012,28(2):222 -6.
[5]Duque G,Macoritto M,Kremer R.1,25(OH)2D3inhibits bone marrow adipogenesis in senescence accelerated mice(SAM-P/6)by decreasing the expression of peroxisome proliferator-activated receptor gamma 2(PPARgamma2)[J].Exp Gerontol,2004,39(3):333-8.
[6]Jin J,Wang L,Wang X K,et al.Risedronate inhibits bone marrow mesenchymal stem cell adipogenesis and switches RANKL/OPG ratio to impair osteoclast differentiation[J].J Surg Res,2013,180(1):e21 -9.
[7]Zhao J,Sun X B,Ye F,et al.Suppression of fatty acid synthase,differentiation and lipid accumulation in adipocytes by curcumin[J].Mol Cell Biochem,2011,351(1-2):19-28.
[8]Otto T C,Lane M D.Adipose development:from stem cell to adipocyte[J].Crit Rev Biochem Mol Biol,2005,40(4):229 -42.
[9]Gregoire F M,Smas C M,Sul H S.Understanding adipocyte differentiation[J].Physiol Rev,1998,78(3):783 -809.
[10]Cristancho A G,Lazar M A.Forming functional fat:a growing understanding of adipocyte differentiation[J].Nat Rev Mol Cell Biol,2011,12(11):722 -34.
[11]Kawai M,Rosen C J.PPARγ:a circadian transcription factor in adipogenesis and Osteogenesis[J].Nat Rev Endocrinol,2010,6(11):629-36.
[12]Yeh W C,Cao Z,Classon M,et al.Cascade regulation of terminal adipocyte differentiation by three members of the C/EBP family of leucine zipper Proteins[J].Genes Dev,1995,9(2):168 -81.
[13]Calvi L M,Adams G B,Weibrecht K W,et al.Osteoblastic cells regulate the haematopoietic stem cell niche[J].Nature,2003,425(6960):841-6.
[14]Naveiras O,Nardi V,Wenzel P L,et al.Bone-marrow adipocytes as negative regulators of the haematopoietic microenvironment[J].Nature,2009,460(7252):259 -63.