五味子多糖不同提取工艺的研究
王秀娟,马艳梅,商雪娇,陈晓平,*
(1.吉林农业大学食品科学与工程学院,吉林长春130118;2.黑龙江职业学院,黑龙江双城150111;3.长春迪瑞医疗科技股份有限公司,吉林长春130012)
北五味子主要产于我国的东北部地区,属木兰科植物,具有很高的药用价值和营养价值[1-2]。五味子多糖是从五味子干燥成熟果实中提取出来的含有五味子总多糖的混合物[3]。其味酸、甘、温,具有补肾宁心、收敛固涩、益气生津等多种功效。研究表明,五味子粗多糖能够提高机体的免疫能力,具有良好的抗衰老及抗肿瘤作用,以及较强的清除自由基能力,能够提高荷瘤小鼠超氧化物歧化酶的活力,在体外能够有效的抑制脂质的过氧化,抑制红细胞溶血和丙二醇(MDA)生成[4-12]。因此,研究北五味子多糖提取的有效方法和最佳工艺条件,对于新药和功能性食品的开发具有重要意义。
1 材料与方法
1.1 材料与仪器
乙醚、无水乙醇、丙酮、硫酸、苯酚 均为分析纯,北京市化工厂;北五味子 长白山北亚药业有限公司;纤维素酶(活力为1.5万U/g) 淮安市百麦绿色生物能源有限公司。
CWF-2501超微粉碎机 鑫业仪器有限公司;PHG-9146A电热鼓风干燥箱 上海精宏实验设备有限公司;T6紫外可见分光光度计 安普;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;GL-21M高速冷冻离心机 湖南星科科学仪器有限公司;JY92-2超声波细胞粉碎机 长春安普科技有限公司;PHS-25酸度计 上海日岛科学仪器有限公司;AUY220电子天平 岛津制作所;电热恒温水浴锅 天津市豪斯特分析仪器公司。
1.2 实验方法
1.2.1 葡萄糖标准曲线的制备 0.1mg/mL标准液:取1.00mg/mL贮备液10mL置于100mL容量瓶中,稀释至刻度。
精密量取0.1mg/mL标准液0.0、0.05、0.l、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0mL放入试管中,加蒸馏水补至1mL,分别加入1mL 5%的苯酚溶液,5mL浓硫酸,置沸水浴中加热15min,取出冷却至室温,在490nm处测定吸光度。以葡萄糖浓度为横坐标,吸光度为纵坐标绘制标准曲线[13]。
1.2.2 水法提取北五味子多糖工艺条件研究 在单因素实验基础上,选择L9(34)正交表,对提取时间(h)、提取温度(℃)、料液比(g∶mL)三因素进行正交实验,因素水平见表1。
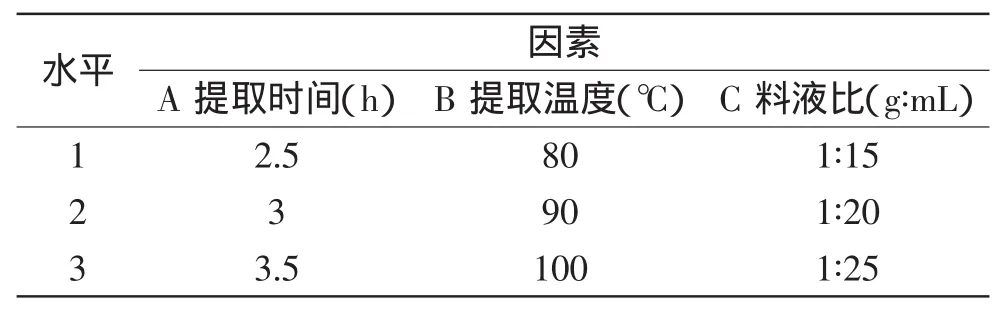
表1 L9(34)因素水平表Table 1Factors and levels of L9(34)orthogonal design
1.2.3 酶法提取北五味子多糖工艺条件研究 在单因素实验基础上,选择L9(34)正交表,对酶浓度(mg/mL)、pH、酶解时间(h)和酶解温度(℃)四因素进行正交实验,因素水平见表2。

表2 L9(34)因素水平表Table 2Factors and levels of L9(34)orthogonal design
1.2.4 超声波辅助法提取北五味子多糖工艺条件研究在单因素实验基础上,选择L9(34)正交表,对料液比(g∶mL)、超声时间(min)、超声功率(W)、提取温度(℃)四因素进行正交实验,因素水平见表3。
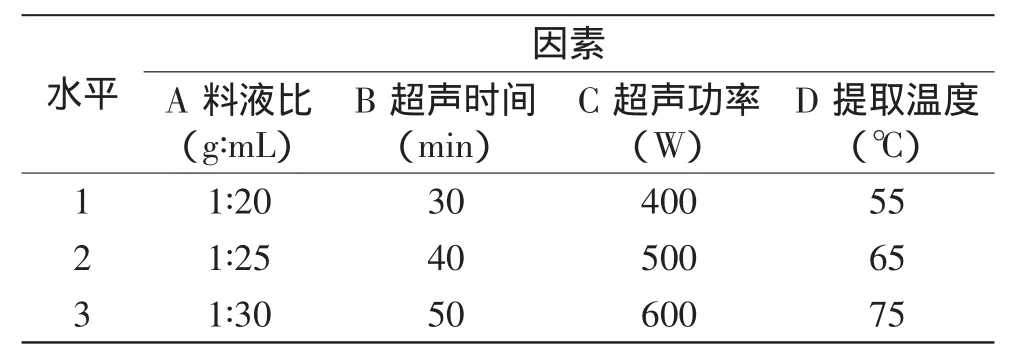
表3 L9(34)因素水平表Table 3Factors and levels of L9(34)orthogonal design
1.2.5 多糖得率的计算 计算公式如下:

2 结果与分析
2.1 葡萄糖标准曲线绘制
在波长490nm处测不同葡萄糖标准液的吸光度,绘制标准曲线,结果如图1所示。经分析得回归方程:y=13.017x+0.0194,R2=0.9989。
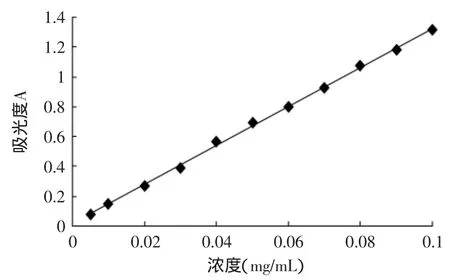
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2 水法提取北五味子多糖
水法提取五味子多糖正交实验结果见表4。

表4 L9(33)正交实验结果Table 4Results of L9(33)orthogonal experiment
由表4可知,在水法提取北五味子多糖工艺条件研究中,影响多糖得率的各因素主次顺序为:A>B>C,即提取时间>提取温度>料液比,最优水平组合为A2B1C3,该组合不在设计的9组实验中,因此对A2B1C3和A2B2C3两个组合进行验证实验,结果A2B1C3组合多糖得率三次平均值为2.84%,A2B2C3组合多糖得率三次平均值为2.97%,因此确定最佳提取工艺为A2B2C3,即提取时间3h、提取温度90℃、料液比1∶25(g∶mL)。
2.3 酶法提取北五味子多糖
酶法提取北五味子多糖正交实验结果见表5。由表5可知,在酶法提取北五味子多糖工艺条件研究中,影响多糖得率的各因素主次顺序为:B>C>A>D,即pH>酶解时间>酶浓度>酶解温度,故本实验选取的最优水平组合为A2B2C3D1,即最佳条件为:酶浓度0.5mg/mL、pH4.8、酶解时间2.5h、酶解温度45℃,此条件下北五味子多糖得率为3.44%。
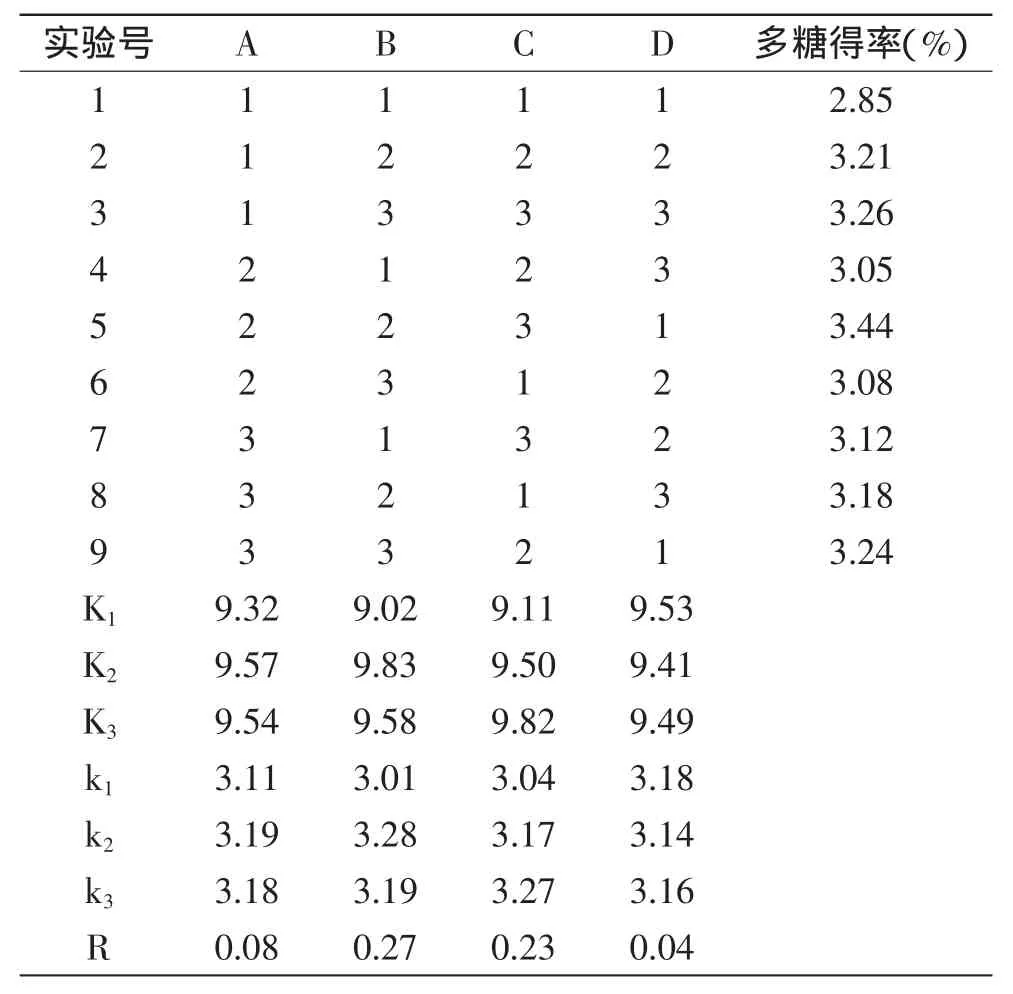
表5 L9(34)正交实验结果Table 5Results of L9(34)orthogonal experiment
2.4 超声波辅助法提取北五味子多糖
超声波辅助法提取北五味子多糖正交实验结果见表6。由表6可知,在超声波辅助法提取北五味子多糖工艺条件研究中,影响多糖得率的各因素主次顺序为:C>B>A>D,即,超声功率>超声时间>料液比>提取温度,故本实验选取的最优水平组合为A2B2C3D1,即最佳条件为:料液比1∶25(g∶mL),超声时间40min,超声功率600W,提取温度55℃,此条件下北五味子多糖得率为4.67%。

表6 L9(34)正交实验结果Table 6Results of L9(34)orthogonal experiment
2.5 不同提取方法比较
不同提取方法在各自最优条件下北五味子多糖的得率的结果见表7。由表7可知,超声波辅助北五味子多糖的得率高于酶法和水提法。
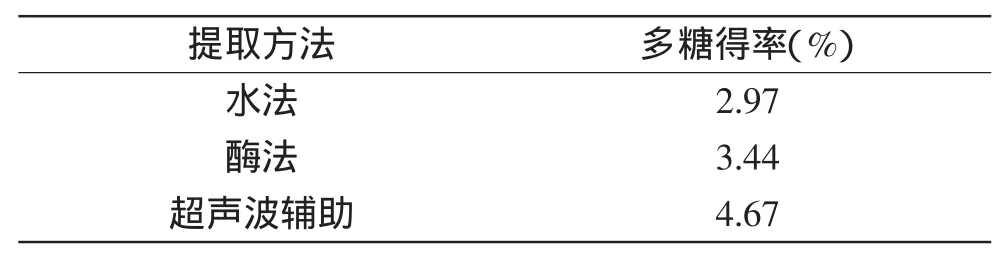
表7 不同提取方法比较Table 7 The comparisons of different extraction methods
3 结论
本研究采用水提法、酶法、超声波辅助法三种方法提取五味子多糖,通过正交实验确定最佳提取方法为超声波辅助法,多糖得率最高。超声波辅助法提取五味子多糖最佳条件为:料液比1∶25(g∶mL),超声时间40min,超声功率600W,提取温度55℃。多糖得率为4.67%
[1]李文科.北五味子的医疗保健作用[J].民营科技,2010(1):20-21.
[2]应国清,俞志明,单剑峰,等.北无味子有效组分的研究进展[J].河南中医,2005,25(6):84-87.
[3]李晓光,高勤,翁文,等.五味子多糖的研究概况[J].时珍国医国药,2006,27(6):931-932.
[4]葛斌,许爱霞,杨社华.黄芪多糖抗衰老作用机制的研究[J].中国医院药学杂志,2004,24(10):610-612.
[5]孙文娟.北五味子多糖抗衰老作用的实验研究[J].中国老年学杂志,2001,21(6):454-455.
[6]苗明三,方晓艳.五味子多糖对正常小鼠免疫功能的影响[J].中国中医药科技,2003,10(2):100-101.
[7]Yip AY,Loo W T,Chow LW.Fructus Schisandrae(Wuweizi)containing compound in modulating human lymphatic systemaphase I minimization clinical trial[J].Biomed Pharmacother,2007,61(9):588-590.
[8]陈荣华,吴向阳,仰榴青,等.五味子醇提残渣中粗多糖的体外抗氧化活性研究[J].时珍国医国药,2009,20(6):1512-1513.
[9]苗明三.五味子多糖对衰老型小鼠的影响[J].中国医药学报,2002,17(3):187-188.
[10]黄玲,陈华.五味子多糖对荷瘤小鼠SOD和MDA的影响[J].福建中医学院学报,2005,15(1):28-29.
[11]谢大泽,湛学军,章涛,等.枸杞等5种多糖清除自由基的实验研究[J].江西医学检验,2002,20(4):195-197.
[12]王艳杰,吴勃岩,孙阳,等.五味子粗多糖对H22,S180荷瘤小鼠抑制作用的实验研究[J].中药信息,2007,24(5):64-65.
[13]胡芳,陈虞苏.减法提取红枣多糖的工艺研究[J].临床医学,2011,24(5):2909-2910.

