产脂肪酶海洋酵母Bohaisea-9 1 4 5批式发酵动力学研究
郝建华,盛 军,孙 谧
(中国水产科学研究院黄海水产研究所,山东青岛266071)
脂肪酶作为一个具有上百年历史的古老酶种,近年来随着细胞工程、基因工程、蛋白质工程等技术的兴起,其在生物能源、精细化工及医学工程等领域的应用范围不断扩大,重新焕发出新的活力[1-2]。目前国内已经开发的脂肪酶尤其是低温脂肪酶的酶学性质并不能适应新的使用需求,如何寻找性能更加稳定、功能更加完善的新型替代酶是目前酶制剂行业关注的焦点。本课题组筛选到一株能高产海洋低温脂肪酶的海洋酵母Bohaisea-9145,该酵母所产脂肪酶具有低温活性高、温度与pH稳定性好、与复杂试剂配伍性优良等特点,可广泛应用于化工、食品与医疗领域[3-4]。发酵动力学模型可以在很多具体代谢途径未知的情况下根据少数可以检测的关键参数来预测发酵产量、控制微生物反应过程以及分析反应过程特征等,使人们对发酵过程具有更全面、深刻的认识,以解决工业生产过程中出现的问题[5-7]。课题组通过前期单因子优化研究获得了海洋微生物Bohaisea-9145产脂肪酶的最佳发酵条件:豆饼粉4%,米糠4%,花生粕4%,粗制花生油0.5%,MgSO40.05%,KH2PO40.2%,最适培养温度为(26±1)℃[3]。以此为基础,本文对酵母菌Bohaisea-9145分批培养的细胞生长动力学和产酶动力学进行研究,建立相关动力学数学模型,并解出模型参数,为产脂肪酶酵母菌Bohaisea-9145发酵规模放大和优化调控提供依据。
1 材料与方法
1.1 材料与仪器
菌株Bohaisea-9145 由中国水产科学院黄海水产研究所海洋酶与酶工程实验室分离保存;产酶初始培养基 蛋白胨4%、葡萄糖1%、KH2PO40.2%、MgSO40.05%,粗制花生油0.5%,以Na2HPO4调节pH为5.0;聚乙烯醇(PVA,聚合度1750±50) 天津市化学试剂三厂;橄榄油 上海医药(集团)上海化学试剂公司;无水乙醇 济南三恩化工有限公司;其他化学试剂 均为进口或国产分析纯。
SPS-250B型生化培养箱 上海跃进医疗器械厂;工业摇床 江苏锡山制锁设备厂;SW-CJ型超净工作台 中外合资苏州安泰空气技术有限公司;752型紫外光栅分光光度计 上海分析仪器总厂;GC9790型气相色谱仪 浙江温岭福立分析仪器有限公司;20L-NLF22型自动控制发酵罐 瑞士Bioengineering公司。
1.2 脂肪酶活性测定
采用中华人民共和国行业标准[8]。脂肪酶水解活力单位定义为:以脂肪酶水解油脂,每分钟产生1μmol脂肪酸的酶量,定义为一个脂肪酶活力单位(U)。
1.3 发酵液中葡萄糖含量测定
采用3,5-二硝基水杨酸(DNS)比色法测定[9]。
1.4 发酵过程细胞浓度测定
取发酵液20mL,其中10mL在3000×g下离心15min,蒸馏水洗涤、离心2次,移菌体至恒重的称量瓶中,至105℃烘干至恒重,称重,即可算出细胞浓度(g/L,干重)。
1.5 其他相关发酵参数测定
发酵罐中的温度、溶氧和pH由发酵罐中相应的电极进行在线测量。其中溶氧为相对溶氧,以无氧水定义为0%,以灭菌后在0.4Bar、26℃时培养基氧浓度达到饱和时为100%。通过改变空气通气量、发酵罐罐压和搅拌速度等,控制溶氧分别保持在20%±2%、30%±2%、40%±2%和50%±2%。发酵过程中每隔2h取样一次,并测定脂肪酶酶活力。
2 结果与讨论
2.1 培养基条件的确定
由于本研究采用20L-NLF22型自动控制发酵罐进行脂肪酶发酵动力学的研究,为了方便研究基质对菌体生长、代谢和产酶的影响,因此从筛选过的氮、碳源中选择蛋白胨和葡萄糖作为培养基中的主要氮、碳源,并对培养基中碳源及氮源配比进行重新优化。根据前期工作,诱导剂(脂肪)及其他培养基成分和含量以产酶初始培养基为准。菌体于(26±1)℃摇瓶培养23h后,测定发酵液脂肪酶活力。蛋白胨和葡萄糖对脂肪酶活力的影响见图1。

图1 蛋白胨和葡萄糖对脂肪酶活性的影响Fig.1 The effect of peptone and glucose on lipase activity
对结果分析并构建三维图形(图1)。由图1可知,当蛋白胨浓度为4%、葡萄糖浓度为1.25%时,发酵获得最大脂肪酶活力。根据脂肪酶活力随蛋白胨和葡萄糖起始浓度变化趋势知,脂肪酶活力受葡萄糖浓度影响较大,而受蛋白胨浓度影响较小。尤其在蛋白胨和葡萄糖浓度较高时,脂肪酶活力随着葡萄糖起始浓度的升高迅速下降。
2.2 发酵过程中溶氧对脂肪酶活力影响
溶氧是发酵过程中的一个重要参数。对于需氧的产酶菌而言,深层培养时需要适量的溶氧以维持其呼吸代谢和某些代谢产物的合成。发酵液中溶氧过低,不利于菌体的生长,表现为菌体生长缓慢,延迟期较长,酶的活力受到影响。而在较高的溶氧下,会使酵母菌生长过于迅速,菌体迅速生长起来而使培养基中的营养物质迅速消耗,从而影响到脂肪酶的生产[10]。根据文献[11]报道,当培养基中溶氧过高时甚至有可能会抑制酵母菌呼吸作用。因此有必要初步探讨溶氧对脂肪酶活力的影响。
根据结果显示(见图2),当发酵过程中溶氧控制在20%±2%时,菌体生长缓慢,脂肪酶的生产时期较其他浓度长,并且产酶的最高浓度比溶氧为30%±2%和40%±2%时低。推测这可能是由于发酵液中的溶氧略微偏低所致。当溶氧为40%±2%时,脂肪酶的生产时间大大提前,其在发酵液中累积达到最大浓度的时间也大大缩短,但脂肪酶浓度达到最高浓度后,便迅速下降,不利于放罐时间的控制。溶解氧为50%±2%时,脂肪酶活力比40%±2%时更低。当溶氧浓度为30%±2%时,脂肪酶活力达到最大值的时间、发酵液最高酶浓度和维持时间都较为合适,因此选定该溶氧浓度为发酵过程中的溶氧控制浓度。

图2 溶氧对脂肪酶活性的影响Fig.2 Effect of dissolved oxygen concentration on lipase activity
2.3 生长曲线及代谢规律分析
发酵培养基为:4%蛋白胨、1.25%葡萄糖、KH2PO40.2%、MgSO40.05%,粗制花生油0.5%,以Na2HPO4调节pH为5.0。发酵过程中,控制溶氧30%±2%,温度(26±1)℃,pH5.5。菌体浓度、脂肪酶活力和葡萄糖浓度随发酵时间的变化曲线见图3。
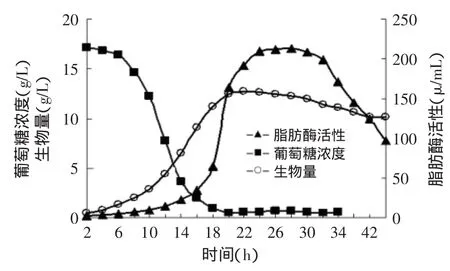
图3 脂肪酶批式发酵生长动力学曲线Fig.3 Kinetic curve of batch fermentation
一般认为发酵产物形成与菌体生长的关系可分为:与生长相关联型和与生长不相关联型。由图3可看出Bohaisea-9145的细胞生长曲线比较典型。各个期段比较分明,从生长曲线与耗糖曲线在细胞生长期间基本呈影镜关系的现象可以推测,碳源葡萄糖是细胞生长限制性基质[12]。而从生长曲线与酶活曲线的关系可以看出碱性脂肪酶的产生始于细胞对数生长期且随着比生长速率下降而加速增长,由此推论Bohaisea-9145产脂肪酶发酵类型属于与生长非关联型[13]。
2.3.1 模型建立与参数估算 由图3 X-t曲线可看出,发酵过程中菌体生长的各个阶段比较分明。在维持培养液体积基本不变的情况下,用指数方程描述指数生长期细胞的增长速率:
dX/dt=μmX0式(1)
式中,X为细胞浓度(g/L,干重);t为时间(h);μ为比生长速率(h-1);μm为最大比生长速率(h-1);X0为菌体初浓度。
将方程(1)定积分得方程:
lnX=lnX0+μmt 式(2)
根据图3中的实验数据,以lnX对t作图得一直线(y=0.2126x-1.0642,见图4)。其中,直线斜率的物理意义为μm=0.2126h-1,即细胞最大比生长速率;直线与纵轴的截距lnX0=-1.0642,则X0=0.3517g/L,其物理意义为菌体初浓度。通过图3中的实验数据,建立细胞浓度与发酵时间的关系方程式:
X=0.3517e-1.045t式(3)

图4 指数生长期lnX与t关系Fig.4 The relation between lnX and time(t)in exponential phase
微生物发酵中酶的产量与细胞浓度的关系密切相关,在一定范围内细胞浓度越高则酶的产量越大,但随着时间的延长,过多的细胞将消耗大量的碳氮源和氧气,从而对酶的合成产生影响,因此我们也要考虑产物生成速率与菌体增长间关系,使菌体浓度和酶产量达到一个平衡点,从而获得最大的产出。
2.3.2 细胞生长速率与限制性基质浓度间的关系 在其他培养条件(温度、pH、溶氧)确定之后和非生长限制营养成分过量的情况下,细胞的比生长速率主要与生长限制性基质浓度有关,尤其当S<<Ks时,比生长速率与限制性基质浓度呈线性关系[12]。根据monod模型:

其中,S为限制性基质浓度(葡萄糖,g/L);Ks为μ达到0.5μm时的基质浓度。将上式变形为:
1/μ=(Ks/μm)(1/S)+(1/μm) 式(5)
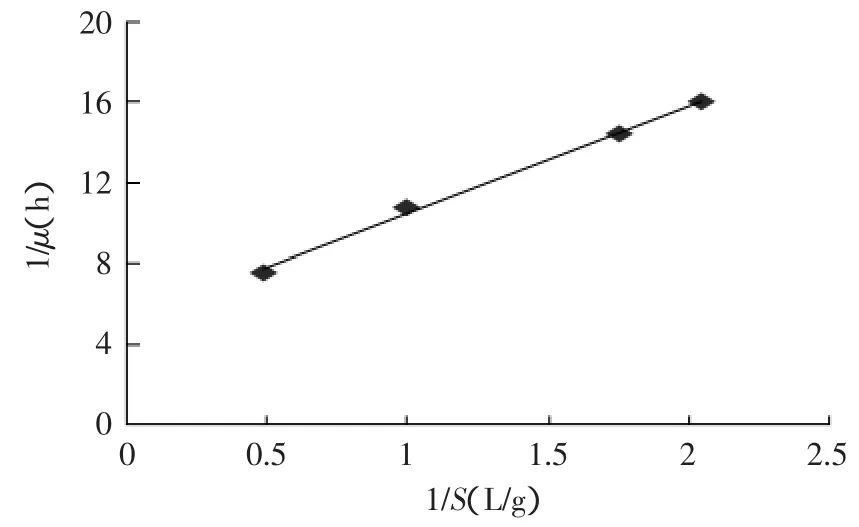
图5 1/μ与1/S关系图Fig.5 The relation between 1/μ and 1/S
根据实验中的实测数据,并以(1/μ)对(1/S)作图,得一直线(y=5.3554x+5.1261,见图5)。其中,直线的斜率为Ks/μm=5.3554,故Ks=1.1386g/L,即当限制性基质葡萄糖浓度达到2.2772g/L时细胞生长速率最大,也说明在脂肪酶发酵中葡萄糖的浓度最好控制在此范围内,或大或小都会影响细胞的生长速度。
2.4 产酶动力学实验
产脂肪酶酵母菌Bohaisea-9145产生的脂肪酶是胞外酶,以酶活性高低衡量酶的活力。从分批发酵结果来看,碱性脂肪酶的产生始于细胞对数生长期。设定Bohaisea-9145发酵类型为非生长关联型,其产物生成速率可表示为:
dP/dt=βX 式(6)
式中,P为产物浓度(酶活,μ/mL);β为比例常数。可分别进行在指数生长期和稳定期的产酶速率估算,求得β值。
2.4.1 酵母菌产酶速率方程的建立 参照图3,2~16h可看作菌体指数生长期,此期间lnX=lnX0+μmt,故方程式(6)可改写为:
dP/dt=βX=βX0eμmt 式(7)
对上式两端进行积分得:

上式两端同时取对数得:
lnP=(lnβ+lnX0-lnμm)lnP0+μmlnP0t 式(9)
令α=(lnβ+lnX0-lnμm)lnP0,则上式可简化为:
lnP=α+μmlnP0t 式(10)
其中,P0为对数期起始脂肪酶浓度(以酶活力表示,2.50μ/mL),X0=0.3517。以指数生长期内的lnP对时间t作图,得到一直线(y=0.1949x+0.3768,见图6)。

图6 lnP与时间关系图Fig.6 The relation between lnP and time
则:μmlnP0=0.1949,(lnβ+lnX0-lnμm)lnP0=0.3768。经计算:β=0.9110。所以,酵母菌产酶速率方程为:
dP/dt=0.9110X 式(11)
2.4.2 产物生成速率与菌体增长间关系 分析方程式(11)和图3可知,产酶生成速率与菌体浓度成正比。所以发酵初期大量生长菌体和延长稳定期时可使产物量(酶活)提高。根据酵母菌产酶速率长方程(11)分析得知:碱性脂肪酶的产生始于细胞对数生长期,并且随着比生速率μ的减小而酶合成速率(dP/dt)逐步增大。当μ趋近于极小值时,发酵液中活菌的浓度达到最大,酶的合成速率亦达到最大。随着发酵进入衰亡期,发酵液中细胞的数量开始减少,酶的合成速率也开始随之减小。虽然理论上酶的浓度仍可能会有所提高,但由于发酵液中大量有毒物质和代谢产物的积累,常常会使酶的合成速率很快降至零,并有可能导致酶的失活或降解。
3 结论
通过对产脂肪酶海洋酵母菌Bohaisea-9145分批发酵过程特征的分析,同时结合数学推导得出了该菌株分批发酵生产脂肪酶的菌体生长、脂肪酶产物合成以及限制性基质葡萄糖浓度与细胞生长速率之间的关系,并获得了方程中的参数值,该方程式基本能够描述海洋酵母Bohaisea-9145分批发酵产脂肪酶的动态过程,可以为以后的进一步放大实验及连续发酵过程的优化控制提供参考。
[1]刘虹蕾,缪铭,江波,等.微生物脂肪酶的研究与应用[J].食品工业科技,2012(12):376-381.
[2]张开平,惠明,田青,等.微生物脂肪酶的应用领域及研究进展[J].河南工业大学学报:自然科学版,2012(1):90-94.
[3]邵铁娟,孙谧,郑家声,等.Bohaisea-9145海洋低温碱性脂肪酶研究[J].微生物学报,2004,44(6):789-793.
[4]Jun Sheng,Fang Wang,HaiYing Wang,et al.Cloning,characterization and expression of a novel lipase gene from marine psychrotrophic Yarrowia lipolytica[J].Annals of Microbiology,2012,62(3):1071-1077.
[5]刘朝辉,陈云,齐崴,等.中性甘露聚糖酶分批发酵动力学研究[J].化学工程,2008,36(10):66-71.
[6]张建国,陈晓明,贺新生.灵芝胞外多糖分批发酵动力学模型[J].生物工程学报,2007,23(6):1065-1070.
[7]宋超先.微生物与发酵基础教程[M].天津:天津大学出版社,2007:175-190.
[8]中华人民共和国轻工业部全国食品发酵标准化中心.QB/T 1803-1903.工业酶制剂通用实验方法[S].北京,1993.
[9]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1994:13-14.
[10]俞俊棠,唐孝宣.生物工艺学(上)[M].上海:华东化工学院出版社,1991:129-132.
[11]Gonzalez-SM,Freire-PM,Ramil E,et al.Respirofermentative metabolism in Kluyveromyces lactis:insights and perspectives[J].Enzyme and Microbial Technology,2000,26:699-705.
[12]孙谧,王跃军,李民,等.黄海黄杆菌YS-9412-130低温碱性蛋白酶发酵过程动力学研究[J].海洋水产研究,2001,22(3):14-23.
[13]俞俊棠,唐孝宣.生物工艺学(上)[M].上海:华东化工学院出版社,1991,75-103.

