瑞舒伐他汀部分恢复吗啡耐受大鼠的吗啡镇痛效能
李永乐,谢军明,舒银银,张 瑶,底 妍,孙 茜,刘 健,李伟彦
(1.南方医科大学南京临床医学院,2.南京军区总医院麻醉科,江苏南京 210002)
长期应用吗啡可导致吗啡镇痛效应的下降,出现吗啡耐受现象。大量研究表明,脊髓胶质细胞在吗啡耐受发生中发挥着重要的作用[1-3]。最近研究发现[4],他汀类药物可调控脊髓胶质细胞,治疗神经病理性疼痛。但其能否通过相似机制减轻吗啡的耐受尚不清楚。因此,本研究观察口服瑞舒伐他汀对已形成吗啡耐受的大鼠的吗啡镇痛效能的作用,及腰段脊髓星形胶质细胞活化、ERK磷酸化的变化,以期为临床用药提供参考。
1 材料与方法
1.1 动物选择和分组 ♂ SD大鼠48只(由南京军区南京总医院比较医学科提供),体质量200~250 g,随机分成6组,每组8只。Ⅰ组为空白对照组;Ⅱ组为吗啡耐受组;Ⅲ组为10 mg·kg-1瑞舒伐他汀(阿斯利康制药)对照组;Ⅳ组为0.4 mg·kg-1瑞舒伐他汀处理组;Ⅴ组为2 mg·kg-1瑞舒伐他汀处理组;Ⅵ组为10 mg·kg-1瑞舒伐他汀处理组,瑞舒伐他汀的剂量参考既往文献[4]。
1.2 慢性吗啡耐受模型的建立 参照Raghavendra等[2]方法建立吗啡耐受模型,每天8∶00和16∶00,Ⅱ、Ⅳ、Ⅴ、Ⅵ组皮下注射吗啡10 mg·kg-1,连续5天;Ⅰ组和Ⅲ组每天同样时间皮下注射等量的生理盐水。模型建立后,6组继续每天皮下注射吗啡或生理盐水至d 10。
1.3 给药方案 d 6开始,Ⅰ、Ⅱ组在每天皮下注射前30 min给予生理盐水灌胃,连续5 d;Ⅲ组在每天皮下注射前30 min给予10 mg·kg-1瑞舒伐他汀灌胃,连续5 d;Ⅳ、Ⅴ、Ⅵ组在每天皮下注射吗啡前30 min分别给予相应剂量的瑞舒伐他汀灌胃,连续5 d。
1.4 行为学测试和MPE值计算 d 6和d 11给药前,参照 Bianchi等[5]方法测定热缩足潜伏期(PWTL),最长照射时间为20 s,以防止组织灼伤。连续测定3次,每次间隔1 min,取平均值为基础PWTL。测定基础PWTL值后,从鼠尾静脉注射吗啡4 mg·kg-1,测定静脉注射吗啡后30 min每组大鼠的PWTL,取平均值记为镇痛阈值。通过公式计算MPE=(镇痛阈值–基础阈值)/(最长照射时间-基础阈值)。
1.5 免疫印迹法(Western blot) 取腰5脊髓,组织匀浆,离心取上清液,蛋白定量后,将40 μg总蛋白加入SDS上样缓冲液,煮沸5 min使其变性,经SDS凝胶电泳,转至PVDF膜,封闭液(5%脱脂牛奶)室温封闭1 h,兔抗大鼠ERK和p-ERK一抗(1∶1 000,cell signaling technology)4℃孵育过夜,TBST清洗5 min×6次,羊抗兔二抗(1∶1 000,Cell Signaling Technology)室温孵育1 h,TBST清洗5 min×6次,暗室内加显色底物显色曝光,扫描。内参为GAPDH(1 ∶1 000,cell signaling technology)测定条带灰度值,以目的条带灰度值与GAPDH灰度值的比值反映ERK和p-ERK的表达水平。
1.6 免疫荧光染色 取腰5脊髓,蔗糖溶液梯度脱水,将组织进行连续冰冻切片,片厚20 μm。5%的BSA封闭1 h,随后加入GFAP抗体(1∶500,santa cruz biotechnology),4℃孵育过夜,用 TBST洗3次后,加入异硫氰酸荧光素标记的二抗(1∶300,santa cruz biotechnology),室温避光孵育2 h,漂洗3次。荧光显微镜下观察并照相。
1.7 统计学分析 采用SPSS 13.0统计软件包进行统计学分析,正态分布的计量数据采用±s表示,组间均数总的比较采用单因素方差分析,两两组间比较采用Bonferroni检验。
2 结果
2.1 行为学测试 各组大鼠在静脉注射吗啡前基础PWTL均无差异(Tab 1)。d 6,静脉注射4 mg·kg-1吗啡30 min后,与Ⅰ组相比,Ⅱ、Ⅳ、Ⅴ和Ⅵ组MPE值明显降低(P<0.05),但Ⅲ组无差异。d 11,静脉注射4 mg·kg-1吗啡30min后,与Ⅰ组相比,Ⅱ组和Ⅳ组大鼠的MPE值明显降低(P<0.05),但Ⅲ、Ⅴ和Ⅵ组则无差异。与Ⅱ组相比,Ⅴ以及Ⅵ组大鼠的MPE值均升高(P<0.05),但Ⅳ组则无差异(Fig 1)。

Tab 1 Basic paw withdraw latency of rats on day 6 and day 11
2.2 Western blot 各组大鼠腰5脊髓内总ERK含量差异均无统计学意义。与Ⅰ组相比,Ⅱ、Ⅳ组腰5脊髓内p-ERK含量明显升高(P<0.05),Ⅲ、Ⅴ、Ⅵ组差异则无统计学意义;与Ⅱ组相比,Ⅲ、Ⅴ、Ⅵ组腰5脊髓内p-ERK含量明显降低(P<0.05),Ⅳ组差异则无统计学意义(Fig 2)。
2.3 免疫荧光染色 免疫荧光染色的结果显示,Ⅰ组和Ⅲ组大鼠腰5脊髓背角只有少量的GFAP表达,而Ⅱ组大鼠腰5脊髓背角GFAP表达明显增加。与Ⅱ相比,Ⅵ组口服10 mg·kg-1瑞舒伐他汀后,腰5脊髓背角GFAP表达明显减少(Fig 3)。
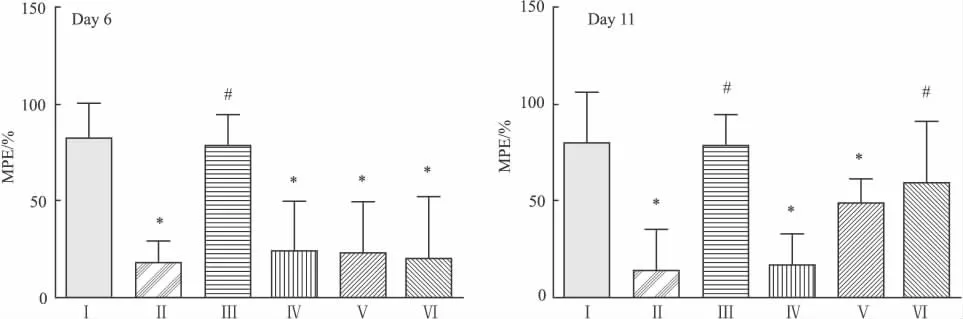
Fig 1 %MPE at 30min of rats on day 6 and day 11.
3 讨论
大量的研究均发现长期使用吗啡能引起脊髓内胶质细胞活化,活化的胶质细胞通过释放细胞因子、趋化因子、一氧化氮等物质,诱导和维持吗啡耐受,其中星形胶质细胞在吗啡耐受的维持中发挥着重要作用。通过使用多种胶质细胞抑制剂,如己酮可可碱、米诺环素、AV411等均能明显缓解吗啡耐受[6-8]。这充分说明了通过调控胶质细胞,尤其是星形胶质细胞的活性是防治吗啡耐受形成和发展的重要方向。
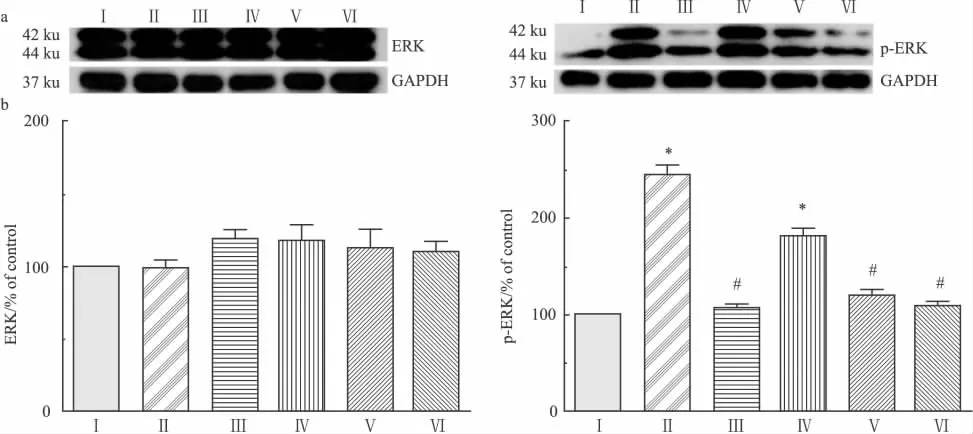
Fig 2 ERK and p-ERK expression in L5 spinal cord of rats.
近年来,他汀类药物因其具有独特的免疫调节作用而得到了越来越多的关注。Shi等[4]发现瑞舒伐他汀能抑制星形胶质细胞的激活,缓解坐骨神经结扎引起的神经病理性疼痛。Garcia等[9]发现阿托伐他汀可以降低5种疼痛模型大鼠对疼痛刺激的敏感性,起到镇痛作用,该效应亦与其调控胶质细胞,减轻炎效相关。因此,他汀类药物可能成为防治吗啡耐受的一种新选择。
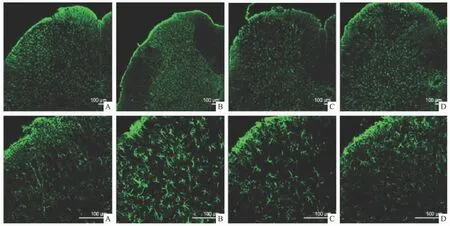
Fig 3 Expression of GFAP in L5 spinal cord was limited in group saline control group(A)and 10 mg·kg-1rosuvastatin control group(C)while that in morphine tolerance group(B)was increased significantly.The expression of GFAP in L5 spinal cord in 10 mg·kg-1rosuvastatin treatment group(D)was significant decreased compared with that in morphine tolerance group(B)
本研究参照Raghavendra等[1]方法建立吗啡模型。d 6各组大鼠基础PWTL并无明显差异,说明连续5 d吗啡皮下注射对大鼠基础热痛阈并无影响。但接受皮下注射吗啡的大鼠d 6出现吗啡镇痛效能下降,这证明吗啡耐受建模成功。连续5 d不同剂量的瑞舒伐他汀灌胃治疗后,吗啡耐受大鼠的吗啡镇痛效能呈剂量依赖得到了恢复,说明瑞舒伐他汀能部分恢复了吗啡耐受大鼠的吗啡镇痛效能。与生理盐水对照组相比,d 6和d 11瑞舒伐他汀处理组基础热痛阈并无明显变化,说明瑞舒伐他汀并无直接镇痛作用,其作用是通过其它效应实现的。为此,本研究观察了脊髓星形胶质细胞活性的改变,发现吗啡耐受的大鼠脊髓内星形胶质细胞标志物GFAP免疫活性增强,10 mg·kg-1瑞舒伐他汀灌胃能有效地抑制星形胶质细胞的活化,说明瑞舒伐他汀的缓解吗啡耐受的作用可能与其有效抑制腰段脊髓内星形胶质细胞活化有关。
ERK通路的激活在吗啡耐受时脊髓星形细胞的活化的重要作用已被既往研究报道[10]。ERK是MAPK信号通道中的重要一员。大量的研究发现[11,12],吗啡耐受大鼠的不同脑区和脊髓中均有ERK的激活。Wang等[13]发现,ERK可通过影响降钙素基因相关肽(CGRP)的表达引起吗啡耐受,后者已被证明是吗啡耐受形成发展的重要环节。本研究发现各组大鼠总ERK并无明显变化,但吗啡耐受大鼠p-ERK含量较生理盐水组大鼠明显增高,而瑞舒伐他汀处理组大鼠p-ERK表达量呈剂量依赖地下降,这提示瑞舒伐他汀可能通过抑制脊髓内ERK的磷酸化,从而抑制了星形胶质细胞的活化。
综上所述,瑞舒伐他汀能呈剂量依赖地恢复吗啡耐受大鼠吗啡镇痛效能,该效应可能与其有效抑制腰段脊髓内ERK磷酸化、从而抑制星形胶质细胞活化有关。
[1]Raghavendra V,Rutkowski M D,DeLeo J A.The role of spinal neuroimmune activation in morphine tolerance/hyperalgesia in neuropathic and sham-operated rats[J].J Neurosci,2002,22(22):9980-9.
[2]Song P,Zhao Z Q.The involvement of glial cells in the development of morphine tolerance[J].Neurosci Res,2001,39(3):281-6.
[3]刘 微,郭瑞鲜,崔 宇,等.脊髓星形胶质细胞的JNK介导吗啡耐受[J].中国药理学通报,2010,26(11):1435-9.
[3]Liu W,Guo R X,Cui Y,et al.JNK in spinal astrocytes mediates morphine antinocieptive tolerance[J].Chin Pharmacol Bull,2010,26(11):1435-9.
[4]Shi X Q,Lim T K,Lee S,et al.Statins alleviate experimental nerve injury-induced neuropathic pain[J].Pain,2011,152(5):1033-43.
[5]Bianchi M,Sacerdote P,Ricciardi-Castagnoli P,et al.Central effects of tumor necrosis factor alpha and interleukin-1 alpha on nociceptive thresholds and spontaneous locomotor activity[J].Neurosci Lett,1992,148(1-2):76-80.
[6]Cui Y,Liao X X,Liu W,et al.A novel role of minocycline:attenuating morphine antinociceptive tolerance by inhibition of p38 MAPK in the activated spinal microglia[J].Brain Behav Immun,2008,22(1):114-23.
[7]Mika J,Wawrzczak-Bargiela A,Osikowicz M,et al.Attenuation of morphine tolerance by minocycline and pentoxifylline in naive and neuropathic mice[J].Brain Behav Immun,2009,23(1):75-84.
[8]Hutchinson M R,Lewis S S,Coats B D,et al.Reduction of opioid withdrawal and potentiation of acute opioid analgesia by systemic AV411(ibudilast)[J].Brain Behav Immun,2009,23(2):240-50.
[9]Garcia G G,Miranda H F,Noriega V,et al.Antinociception induced by atorvastatin in different pain models[J].Pharmacol Biochem Behav,2011,100(1):125-9.
[10]Wang Z,Ma W,Chabot J G,et al.Cell-type specific activation of p38 and ERK mediates calcitonin gene-related peptide involvement in tolerance to morphine-induced analgesia[J].Faseb J,2009,23(8):2576-86.
[11]Eitan S,Bryant C D,Saliminejad N,et al.Brain region-specific mechanisms for acute morphine-induced mitogen-activated protein kinase modulation and distinct patterns of activation during analgesic tolerance and locomotor sensitization[J].J Neurosci,2003,23(23):8360-9.
[12]Cao J L,He J H,Ding H L,et al.Activation of the spinal ERK signaling pathway contributes naloxone-precipitated withdrawal in morphine-dependent rats[J].Pain,2005,118(3):336-49.
[13]Wang Z,Chabot J G,Quirion R.On the possible role of ERK,p38 and CaMKII in the regulation of CGRP expression in morphine-tolerant rats[J].Mol Pain,2011,7:68.

