HPLC法测定盐酸拉贝洛尔注射液的含量和有关物质
周怡,郑金琪(1.国家药典委员会,北京100061;.浙江省食品药品检验所,杭州310004)
盐酸拉贝洛尔,化学名为5-[1-羟基-2-(1-甲基-3-苯丙胺基)-乙基]水杨酰胺盐酸盐,是一种兼具α、β受体阻滞作用的抗高血压药物[1-2],主要用于治疗各种类型高血压。本品于1980年在国内批准上市,主要剂型为片剂和注射剂。盐酸拉贝洛尔分子结构中含有酚羟基和酰胺基,易被氧化和水解,在生产和贮藏过程中亦可能产生降解物。经查阅,国家标准[3]和美国药典(USP)34版[4]标准中均未对盐酸拉贝洛尔注射液进行有关物质检查。英国药典(BP)2011年版[5]采用薄层色谱(TLC)法检查盐酸拉贝洛尔注射液的游离羧酸及其他有关物质,TLC法的分离度、灵敏度和准确度均较低。另外未见对盐酸拉贝洛尔注射液进行有关物质检查的文献报道。国家标准[3]中采用紫外外标对照品法测定盐酸拉贝洛尔注射液的含量。在2011年国家药典委员会组织的化学药质量标准提高工作中,为严格有效地控制药品的质量,笔者参考USP 34版[4]标准,采用改进的高效液相色谱(HPLC)方法,首次研究并建立了HPLC测定盐酸拉贝洛尔注射液有关物质的方法,并统一了含量测定方法。经方法学考察,该法操作简单、快速、专属性强、结果准确。
盐酸拉贝洛尔的化学结构见图1。
1 材料
LC-20AT HPLC仪、LC-20AT泵、SPD-M20A二极管阵列检测器、LC solution色谱工作站(日本Shimadzu公司)。
图1 盐酸拉贝洛尔的化学结构Fig 1 The chemical structure of labetalol hydrochloride
盐酸拉贝洛尔对照品(批号:100484-201001,纯度:99.8%)由中国食品药品检定研究院提供;5-[1-羟基-2-(1-甲基-3-苯丙胺基)乙基]水杨酸(游离羧酸)对照品(批号:1335,纯度:100.0%)由英国药典委员会提供;3批盐酸拉贝洛尔注射液样品(批号:100101、110101、110102,规格:50 mg∶10 ml)由江苏天禾迪赛诺制药有限公司提供;甲醇为色谱纯,水为重蒸水,其余试剂均为分析纯。
2 方法与结果
2.1 溶液的制备
供试品溶液:精密量取样品适量,用流动相稀释制成每1 ml中含盐酸拉贝洛尔200 μg的溶液。
对照品溶液:取盐酸拉贝洛尔对照品约10 mg,精密称定,置于50 ml量瓶中,加流动相溶解并稀释至刻度,摇匀,即得。
2.2 色谱条件与测定方法
色谱柱为Agilent TC-C18(250 mm×4.6 mm,5 μm);流动相为甲醇-0.1 mol/L磷酸二氢钠溶液(55∶45),流速为1.0 ml/min;柱温为50℃;检测波长为230 nm。
取盐酸拉贝洛尔对照品和游离羧酸对照品各适量,加流动相溶解并稀释制成每1 ml中含盐酸拉贝洛尔和游离羧酸各约25、100 μg的溶液,作为混合对照品溶液。取此溶液10µl注入液相色谱仪,记录色谱图,见图2A。
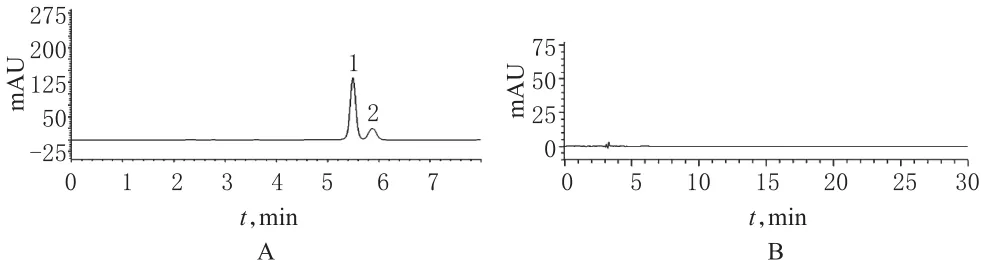
图2 系统适用性试验高效液相色谱图A.混合对照品溶液;B.辅料溶液;1.游离羧酸;2.盐酸拉贝洛尔Fig 2 HPLC chromatograms of system applicability testsA.mixed control solution;B.adjunctive solution;1.free carboxylic acid;2.labetalol hydrochloride
由图2A可见,盐酸拉贝洛尔的出峰时间为5.938 min,游离羧酸的出峰时间为5.542 min,两者的分离度为1.5,符合规定,理论板数按盐酸拉贝洛尔峰计算不低于2000。
2.3 专属性试验
2.3.1 辅料试验。取处方量辅料,依法制备成辅料溶液,进样10 μl,色谱见图2B。
由图2B可知,辅料对主成分测定无干扰。
2.3.2 强制降解试验。取批号为100101的样品5份,每份5 ml,分别置于25 ml量瓶中。分别加入3.0 mol/L盐酸溶液1.0 ml,放置24 h,加3.0 mol/L氢氧化钠溶液1.0 ml中和后,摇匀,作为酸破坏样品;加入3.0 mol/L氢氧化钠溶液1.0 ml,放置24 h,加3.0 mol/L盐酸溶液1.0 ml中和后,摇匀,作为碱破坏样品;加入30%过氧化氢溶液1.0 ml,摇匀,放置24 h,作为氧化破坏样品;在(4500±500)lx光照强度下放置24 h,作为光照破坏样品;在80℃水浴中加热4 h,放冷,作为热破坏样品。各破坏样品色谱结果见图3。
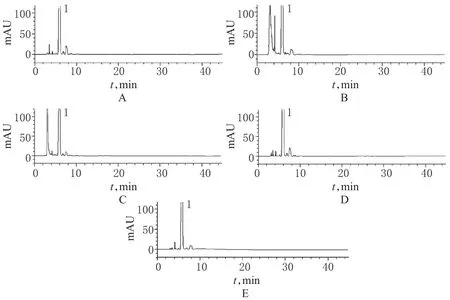
图3 降解试验高效液相色谱图A.酸破坏样品;B.碱破坏样品;C.氧化破坏样品;D.热破坏样品;E.光破坏样品;1.盐酸拉贝洛尔Fig 3 HPLC chromatograms of degradation testsA.samples treated with strong acid;B.samples treated with strong alkali;C.samples treated with oxidation;D.samples treated with heat;E.samples treated with strong light;1.labetalol hydrochloride
2.4 标准曲线和检测限考察
取盐酸拉贝洛尔对照品约10 mg,精密称定,置于10 ml量瓶中,加流动相溶解并稀释至刻度,摇匀,作为标准贮备液;分别精密量取该溶液0.4、1.0、1.6、2.0、2.4、3.0、3.6 ml,置于10 ml量瓶中,用流动相稀释至刻度,摇匀,分别取上述溶液10 μl注入液相色谱仪,记录色谱图。以浓度(c)对峰面积(y)作标准曲线,得线性回归方程为:y=14445c+10585(r=1.0000,n=7)。由此可见,盐酸拉贝洛尔检测质量浓度线性范围为41.40~372.60 μg/ml。取盐酸拉贝洛尔对照品溶液逐步稀释测定,得检测限为52.54 ng/ml(信噪比为6.0)。
2.5 回收率试验
精密称取盐酸拉贝洛尔对照品适量,加入处方量的辅料溶液,用流动相溶解并定量稀释制成每1 ml中约含盐酸拉贝洛尔160、200、240 μg的溶液各3份,精密量取10 μl注入液相色谱仪,记录色谱图;另取盐酸拉贝洛尔对照品适量,同法测定,计算每份的回收率。结果,低、中、高3种不同水平溶液的回收率分别为100.1%、100.2%、99.6%,RSD分别为0.91%、0.19%、0.71%;平均回收率为99.97%,RSD为0.64%。
2.6 精密度试验
取批号为100101的样品,于同日内及6 d内各分别测定含量6次,计算日内和日间RSD。结果,盐酸拉贝洛尔的平均含量分别为100.9%和100.8%,日内、日间RSD分别为0.56%和0.58%,表明本方法精密度良好。
2.7 相对响应因子
游离羧酸是盐酸拉贝洛尔注射液在贮藏过程中酰胺基可能水解生成的特殊杂质,BP2011年版采用TLC外标对照品法测定其含量。取盐酸拉贝洛尔对照品和游离羧酸对照品各适量,加流动相溶解并稀释制成每1 ml中含盐酸拉贝洛尔和游离羧酸各约25 μg和100 μg的混合溶液,进行相对响应因子测定。结果,游离羧酸与盐酸拉贝洛尔的相对响应因子为1.05。为方便试验,同时考虑到游离羧酸与盐酸拉贝洛尔的相对响应因子在0.90~1.10范围内,故以盐酸拉贝洛尔为自身对照测定杂质。
2.8 稳定性试验
取批号为100101的供试品溶液,分别于0、1、3、6、12、24 h进行有关物质测定,结果供试品溶液在24 h内基本稳定,详见表1。
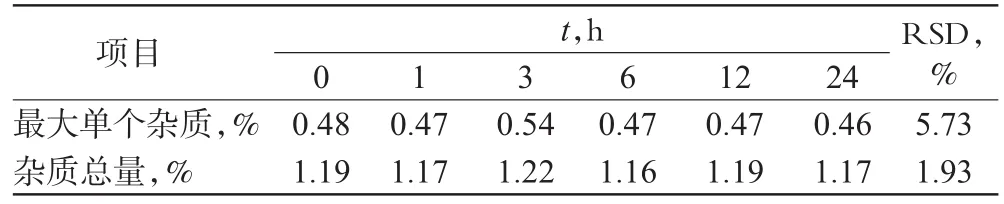
表1 溶液稳定性试验结果Tab 1 Results of stability test of solution
2.9 有关物质检查方法
取本品,作为供试品溶液;精密量取1 ml,置于100 ml量瓶中,加流动相稀释至刻度,摇匀,作为对照溶液。精密量取对照溶液10 μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%,再精密量取供试品溶液和对照溶液各10 μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3.5倍。供试品溶液的色谱图中如显杂质峰,单个杂质峰面积不得大于对照溶液的主峰面积(1.0%),各杂质峰面积之和不得大于对照溶液主峰面积的2倍(2.0%)。
2.10 样品测定
取盐酸拉贝洛尔注射液3批,按“2.1”及“2.9”项下方法制备供试品溶液及对照溶液,测定主药含量和有关物质,结果见表2。
3 讨论
3.1 测定有关物质的必要性
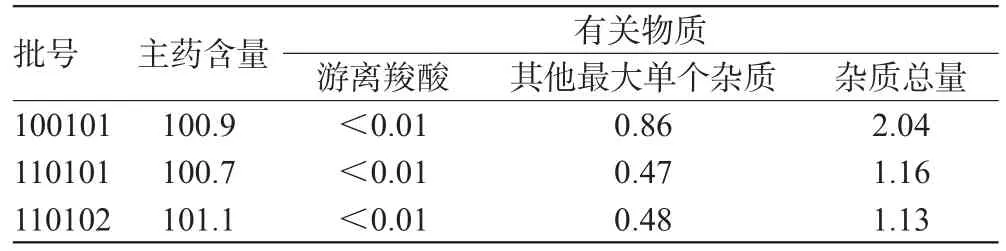
表2 3批样品含量和有关物质测定结果(%%)Tab 2 Determination results of content and related substances in 3 batches of samples(%%)
盐酸拉贝洛尔分子结构中含有酚羟基和酰胺基,在生产和贮藏过程中可能被氧化和水解,亦可能产生降解物,而国家标准中未进行有关物质检查。BP2011年版[5]采用TLC法对盐酸拉贝洛尔注射液的有关物质进行了检查,规定游离羧酸不得过2.0%,其他杂质不得过0.5%。可见,有必要建立一个完善合理的检查方法对盐酸拉贝洛尔注射液的质量进行控制和提高。
3.2 色谱条件的选择
BP2011年版[5]中采用TLC法测定盐酸拉贝洛尔注射液的有关物质。与HPLC法比较,TLC法的灵敏度和分离度均较低,且不易定量检测,标准中供试品溶液的浓度高达80 mg/ml,在实际试验过程中易产生拖尾现象,影响试验结果。HPLC法具有分离效果好、灵敏度高的特点,能进行定量检测,供试品溶液浓度较低,测定结果更加准确。因而笔者参考USP34版[4]含量测定的色谱条件,建立了HPLC含量测定方法,同时也建立了分离度、灵敏度和准确度均更好的HPLC检查有关物质的方法,取得了满意的结果。
3.3 色谱条件的优化
参考BP2011年版[5]盐酸拉贝洛尔有关物质测定和USP34版[4]盐酸拉贝洛尔片含量测定的色谱条件,考虑到溶剂对试验者身体健康和环境的影响,避免使用四氢呋喃,选用甲醇和磷酸盐缓冲液为流动相。标准中的柱温为60℃,为常规十八烷基硅烷键合硅胶柱的最高使用温度,长时间使用,会影响色谱柱寿命,增加色谱柱损耗。故在试验中,对色谱柱的柱温和流动相中甲醇和磷酸盐缓冲液的比例进行了考察。当柱温为60℃,甲醇与磷酸盐缓冲液的比例为35∶65时,拉贝洛尔的出峰时间约为16.0 min,峰形较钝,有分叉迹象,柱效很低;当柱温降为40℃时,保留时间延长至62.8 min,峰形分叉;试着提高甲醇比例至55%,降低柱温至25℃,拉贝洛尔的保留时间约为11.5 min,峰形分叉;提高柱温至50℃,拉贝洛尔的保留时间提前至约6.3 min,出峰时间合适,柱效较高,峰形尖锐对称。经盐酸拉贝洛尔与游离羧酸的分离度试验及盐酸拉贝洛尔注射液的强制降解试验,此色谱条件能使主峰与游离羧酸峰及各降解物峰均完全分离。
3.4 色谱行为的分析
在色谱条件的优化试验中发现,当流动相中甲醇占比较低或柱温较低时,盐酸拉贝洛尔保留时间延长,柱效大大降低,色谱峰变钝或分叉。原因是盐酸拉贝洛尔为一对非对映异构体混合物[6-8],在出峰较慢时因色谱行为略有差异,有一定程度的分离;当流动相中甲醇占比或柱温提高时,非对映异构体色谱行为趋于一致,色谱峰尖锐对称。当柱温为60℃时,较低的甲醇占比并不能使非对映异构体的色谱行为完全一致,而高柱温反而会加速色谱柱的损耗;相反,提高甲醇占比至55%,同时降低柱温至50℃,非对映异构体的色谱行为基本一致,同时能使十八烷基硅烷键合硅胶柱有较长的使用寿命。
3.5 检测波长的选择
取盐酸拉贝洛尔对照品和游离羧酸对照品各适量,加流动相溶解并稀释制成每1 ml中含盐酸拉贝洛尔和游离羧酸各约25 μg和100 μg的混合溶液,进行HPLC-紫外法测定,结果显示盐酸拉贝洛尔和游离羧酸均在230 nm波长处有较大吸收;同时降解试验显示,各降解杂质均在230 nm波长处有较大吸收,因而选用230 nm波长测定有关物质。
3.6 非对映异构体的检查
盐酸拉贝洛尔为一对非对映异构体,Carvalho TM[6]、Bragg W[7]和Goel TV[8]等采用液相色谱(LC)-质谱(MS)/MS、毛细管电色谱(CEC)-MS和毛细管电泳法对盐酸拉贝洛尔非对映异构体的分离和测定进行了详细的研究,BP2011年版[5]亦采用衍生化气相色谱(GC)法对非对映异构体的比例进行了控制。在拟提高的国家药品质量标准中,采用衍生化GC法对非对映异构体的比例进行考察。本试验中,盐酸拉贝洛尔的一对非对映异构体合并为单个色谱峰出峰,以单个色谱峰作为一种物质进行分析。
3.7 含量测定方法的统一
为提高方法的准确度与灵敏度,含量测定由紫外外标对照品法修改为HPLC外标对照品法,色谱条件同有关物质测定方法。结果表明方法的线性、准确度和精密度均良好。
[1]Meyers FH,Jawetz E,Goldlien A.Review of medical pharmacology[S].7th ed.Los Angeles:Lange Medical Publications,1980:95-104.
[2]顾天华,顾得官.柳胺苄心啶的临床药理和毒理进展[J].中国新药与临床杂志,1984,3(3):28.
[3]国家药典委员会.国家药品标准:化学药品地方标准上升国家标准:第7册[S].北京:国家药品监督管理局,2002:214.
[4]United States Pharmacopeia Convention.USP:34[S].Baltimore:United Book Press,2011:3256.
[5]British Pharmacopoeia Commission.BP:2012[S].London:The Stationary Office,2012:1259-1260、2972-2973.
[6]Carvalho TM,Cavalli Rde C,Marques MP,et al.Stereoselective analysis of labetalol in human plasma by LC-MS/MS:application to pharmacokinetics[J].Chirality,2009,21(8):738.
[7]Bragg W,Norton D,Shamsi SA.Optimized separation of beta-blockers with multiple chiral centers using capillary electrochromatography-mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2008,875(1):304.
[8]Goel TV,Nikelly JG,Simpson RC,et al.Chiral separation of labetalol stereoisomers in human plasma by capillary electrophoresis[J].J Chromatogr A,2004,1027(1/2):213.

