pAcGFP1-C1-Ngb真核表达载体的构建及在SH-SY5Y细胞中的表达
杨前,高殿文
(1.大连医科大学附属第二医院眼科,辽宁 大连11 6023;2.中国医科大学附属盛京医院眼科,沈阳110004)
脑红蛋白(neuroglobin,Ngb)是2000年由德国Burmester等首先发现的一种携氧球蛋白,是继血红蛋白(Hb)和肌红蛋白(Mb)之后的第三种携氧球蛋白[1]。主要在脑组织中表达,故命名。Ngb能够可逆性地结合氧,与氧有很高的亲和力,能够特异性地向脑组织供氧,在神经系统氧的摄取、运输和利用等生理过程中起极其重要的作用。即使血氧浓度较低,与氧具有很高亲和力的Ngb仍将促进氧向线粒体的扩散或直接介导氧向线粒体的传递,促进ATP的产生,从而维持正常神经元的功能[2]。已有实验证实,Ngb可以保护神经元免受缺血缺氧的损害[3,4]。视觉信息传导过程中需要消耗大量的氧气,因此视网膜是人体耗氧量最大的组织之一。视网膜中Ngb的含量是大脑中的100倍,分布于除色素上皮以外的所有视网膜神经细胞内[5]。Ngb与氧结合的特性,以及Ngb在视网膜的特异性分布为我们进行缺血缺氧视网膜疾病的研究带来了全新的令人振奋的思路和方向。
本研究旨在构建以GFP为报告基因的重组表达质粒pAcGFP1-C1-Ngb,并将其转入神经母细胞瘤细胞(SH-SY5Y)中,为进一步研究Ngb基因的功能奠定基础。
1 材料与方法
1.1 主要材料和试剂
健康雄性成年SD大鼠1只,体质量210 g,由大连医科大学实验动物中心提供。质粒pAcGFP1-C1购自美国Clontech公司,大肠杆菌JM109为本室保存。RNAiso Plus、KpnⅠ限制性内切酶、BamHⅠ限制性内切酶、质粒抽提试剂盒、DL-2000 Marker,DNA胶回收试剂盒及RNA PCR Kit(AMV)Ver3.0均购自大连宝生物工程公司。LipofectamineTM2000和DMEM培养液为Invitrogen公司产品,胎牛血清购于Gibico公司,SH-SY5Y细胞购自中国医学科学院肿瘤研究所。引物的合成及DNA测序均由大连宝生物工程公司完成。
1.2 方法
1.2.1 Ngb基因的PCR扩增:将SD大鼠断头处死,取出适量的脑组织,按照RNAiso Plus说明书提取总RNA,经分光光度计检测其纯度及含量。采用两步法RT-PCR扩增Ngb基因。20 μL反转录体系包括:1 μL Total RNA,1 μL Oligo dT Primer,1 μL dNTP Mixture,4 μL5× PrimeScript RT Buffer,0.5 μL RNase Inhibitor(40 U/μL),PrimeScript RTase0.5 μL,12 μL 去 RNase水。反应条件为:42 ℃,60 min;70℃,15 min。反应产物(大鼠cDNA)在-20℃保存。
根据大鼠Ngb基因的全长序列设计引物:Ngb上游引物:5′-ATAGGTACCATGGAGCGCCTAGAGT CAGA-3′,Ngb 下游引物:5′-AATGGATCCTTACTCC CCGTCCCAGCCTCG-3′以大鼠cDNA为模板,使用Prime STARⓇHS DNA Polymerase试剂盒进行PCR扩增。50 μL反应体系包括:1 μL反转录反应液,10 μL5× Prime STAR Buffer(Mg2+plus),0.5 μLNgb 上游引物(20μmol/L),0.5μLNgb下游引物(20μmol/L),4 μL dNTP Mixture,0.5 μL PrimeSTAR HS DNA Polymerase(2.5 U/μL),33.5 μL dH2O。反应条件为:94℃3 min,98℃10 s→68℃1 min,共30个循环。将PCR产物以1%琼脂糖凝胶电泳分析。使用TaKaRa Agarose Gel DNA Purification Kit Ver.2.0试剂盒切胶回收上述Ngb基因PCR扩增产物(456 bp)。经BamHⅠ和KpnⅠ双酶切后,回收备用。
1.2.2 重组真核表达载体pAcGFP1-C1-Ngb的构建及鉴定:将上述回收纯化的Ngb基因PCR扩增产物与pMD19-T Vector连接,转化大肠杆菌JM109,挑取阳性菌落提取重组质粒pMD19-Ngb。分别使用限制性内切酶KpnⅠ和BamHⅠ对pMD19-Ngb及pAcGFP1-C1商品化空载体进行双酶切处理。1%琼脂糖凝胶电泳分离酶切产物,切胶回收pAcGFP1-C1/KpnⅠ/BamHⅠ线性载体片段和pMD19-Ngb/KpnⅠ/BamHⅠ中的Ngb基因片段,将二者使用DNA连接酶进行连接,并转化大肠杆菌JM109,提取重组表达质粒pAcGFP1-C1-Ngb并进行核苷酸序列测定。
1.2.3 重组真核表达载体pAcGFP1-C1-Ngb转染SH-SY5Y细胞及其表达:质粒DNA的制备:大量提取无内毒素质粒pAcGFP1-C1-Ngb,分光光度计测定并计算质粒浓度,保存备用。
神经母细胞瘤细胞培养:神经母细胞瘤细胞株(SH-SY5Y)在37℃、5%CO2条件下置于10%胎牛血清的DMEM液中培养。2 d换液1次,2~3 d用消化液常规消化传代。取对数生长期细胞进行各项实验。在进行转染的前1 d,将细胞间隔交叉接种在6孔培养板,细胞密度为2×105/孔,培养24 h达60%~80%融合。
pAcGFP1-C1-Ngb质粒的脂转:将SH-SY5Y细胞分为2组,转染组和空白对照组,转染组按照Lipofectamine2000说明书进行质粒转染,继续培养48 h后,收集2组细胞检测Ngb蛋白的表达。
蛋白表达的检测:转染后48 h,荧光显微镜下观察绿色荧光表达情况。Western blot检测2组细胞Ngb表达情况。
2 结果
2.1 Ngb目的基因的PCR扩增
Ngb目的基因PCR扩增产物以1%琼脂糖凝胶进行电泳,凝胶成像系统上观察电泳结果,于500 bp附近可见一较亮条带,未见有非特异条带存在(见图1)。
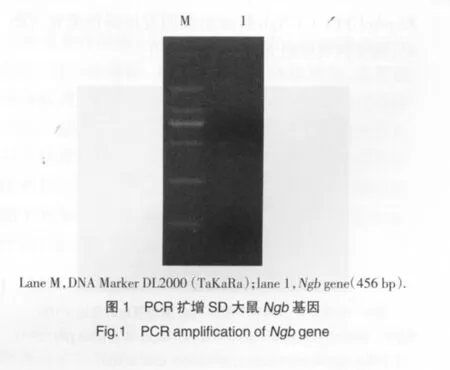
2.2 重组真核表达载体pAcGFP1-C1-Ngb酶切及测序鉴定结果
双酶切产物中Ngb基因片段和线性载体pAcGFP1-C1经纯化后的电泳鉴定结果(图2、图3)。
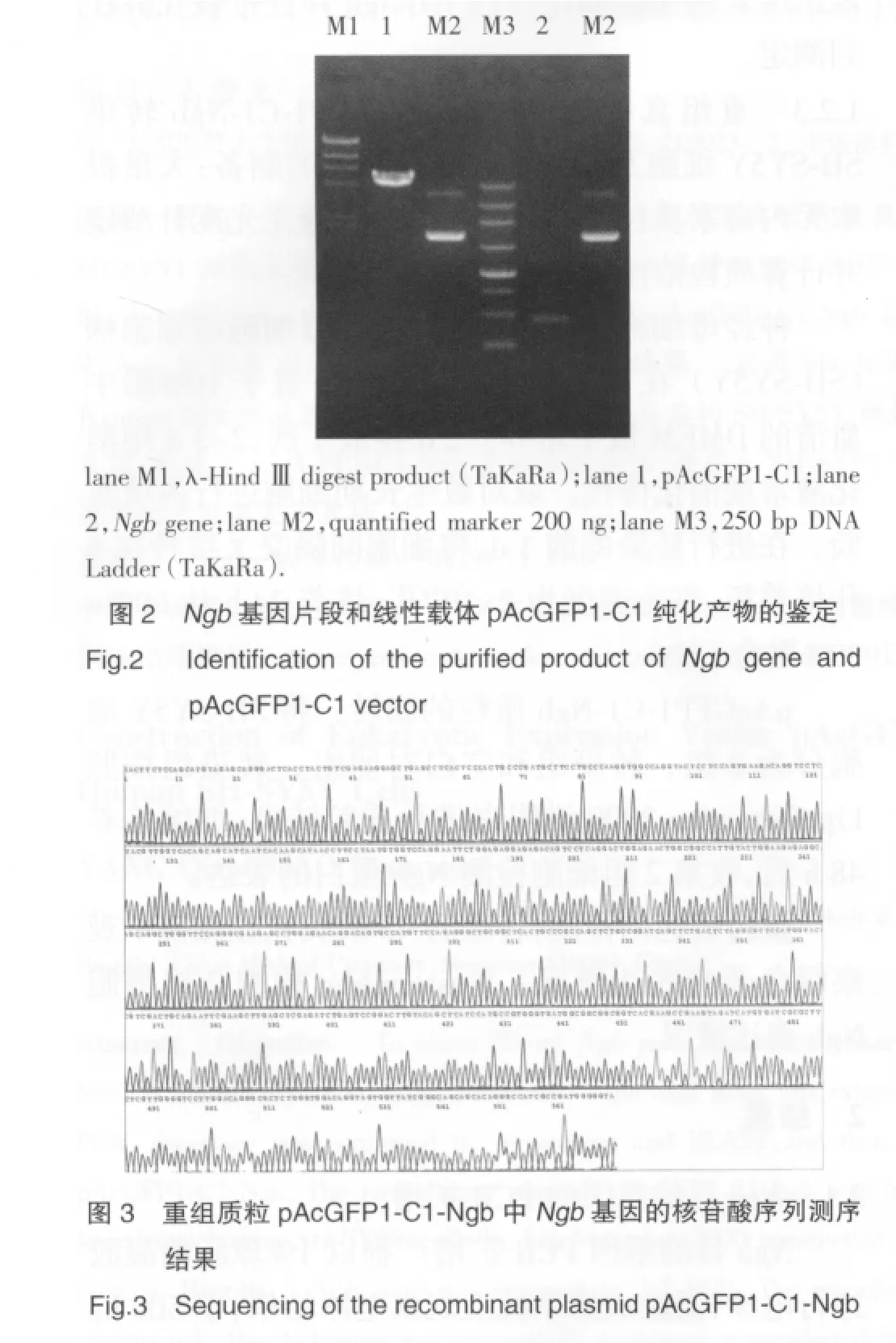
2.3 荧光显微镜观察
倒置荧光显微镜下观察,转染48 h后,重组质粒pAcGFP1-C1-Ngb转染组细胞发出绿色荧光(图4),而空白对照组无绿色荧光发出。
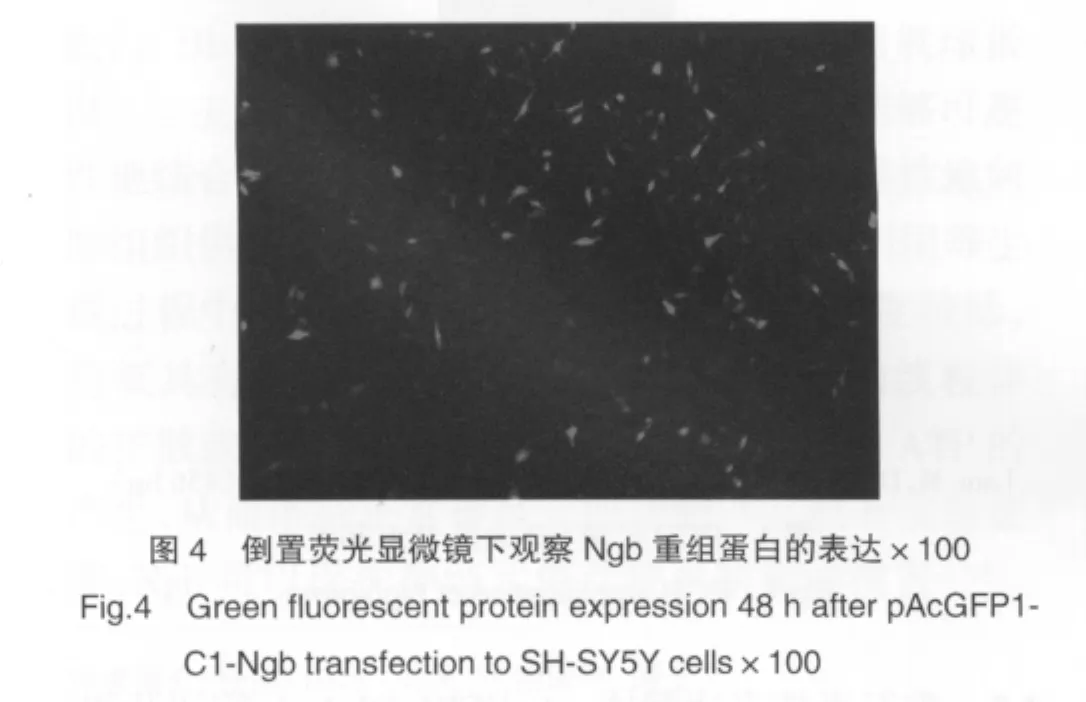
2.4 Western blot结果
转染组SH-SY5Y细胞中Ngb蛋白表达明显高于对照组细胞(图5)。
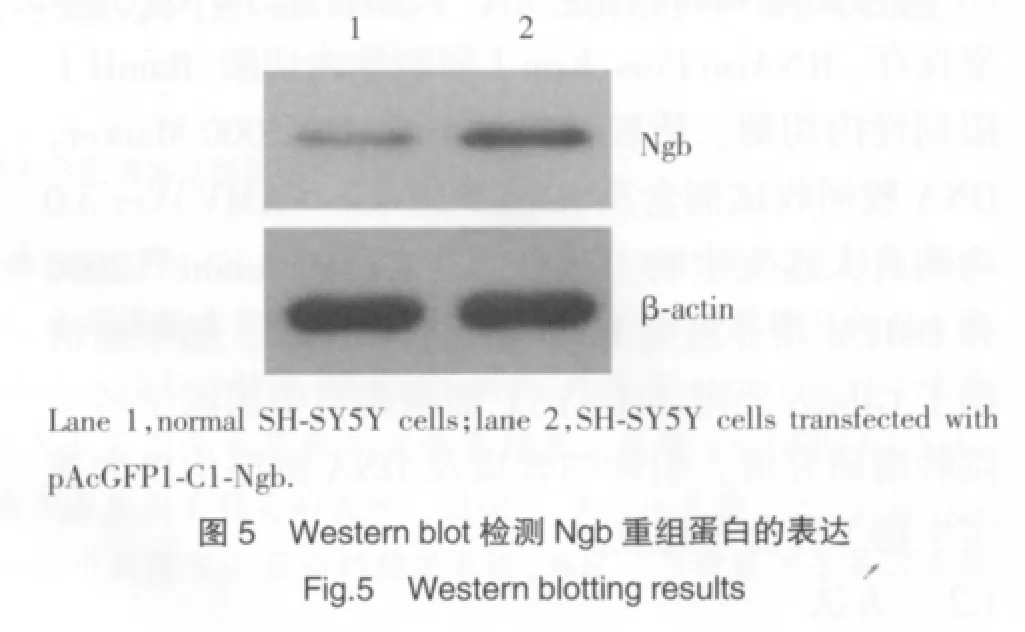
3 讨论
Ngb是Burmester等在人和小鼠脑内发现的一类携氧球蛋白,由151个氨基酸组成的单体蛋白,分子量为17 kDa。Ngb具有独特的外显子和内含子结构,Ngb基因缺乏TATA阅读框。Ngb与血红蛋白、肌红蛋白同属球蛋白家族,但氨基酸序列相似性很小(与血红蛋白的同源性小于21%,与肌红蛋白的同源性小于25%),这表明Ngb在进化上和功能上具有独特性。Ngb主要在脑组织、视网膜及内分泌组织中表达[1]。Ngb能够可逆地结合氧,且与氧有很高的亲和力,能够特异性地向神经组织供氧[2]。受此启发,对缺血缺氧性视神经、视网膜疾病的治疗提供了新思路。
为了进一步研究Ngb的结构和功能,我们从雄性SD大鼠脑组织中提取总RNA,根据引物设计采用RT-PCR逆转录获取cDNA,经测序分析,获得其编码序列为456个碱基,与基因库里的大鼠Ngb编码区序列完全一致,没有碱基发生突变。随后我们将PCR扩增的目的片段连接到T载体(TS-Ngb),利用基因重组技术将TS-Ngb及目的载体pAcGFP1-C1进行双酶切,进行连接,构建真核表达质粒pAcGFP1-C1-Ngb。
质粒pAcGFP1-C1是一种真核表达质粒,由GFP报告基因、SV40启动子、多克隆酶切位点和卡那霉素及新霉素抗性基因等组成。报告基因GFP是最早从水母中分离出来,其基因编码区序列长714 bp,蛋白相对分子量约26 kDa。用波长约450~490 nm的蓝光线激发后发出绿色荧光,可通过荧光显微镜直接观测。GFP无需任何的作用底物或共作用物。检测的灵敏度不受反应效率的影响,保证了极高的检出率。GFP蛋白本身性质稳定,可在多种异源生物中表达且无细胞毒性。GFP基因片段长度较小,易于构建融合蛋白,且融合蛋白仍能保持荧光激发活性,为研究其他基因表达产物的分布提供了方便。GFP与其他蛋白的融合表达已有很多成功的例子,而且其N及C端均可融合,并不影响其发光。
本实验成功构建了GFP与Ngb基因直接嵌合生成的真核表达载体pAcGFP1-C1-Ngb,以表达产生融合蛋白,既保留了Ngb蛋白的神经保护活性,又能通过融合蛋白表达后仍能保持荧光激发活性。在后来的实验中,我们将pAcGFP1-C1-Ngb转染至SH-SY5Y细胞中,倒置荧光显微镜下可明显观察到细胞呈绿色荧光,说明融合蛋白成功表达。而对转染的SH-SY5Y细胞Westernblot检测也进一步说明Ngb基因已成功插入到真核表达载体pAcGFP1-C1中,真核表达载体构建成功。为后续的实验研究打下了基础。
[1]Burmester T,Weich B,Reinhardt S,et al.A vertebrate globin expressed in the brain[J].Nature,2000,407(6803):520-523.
[2]Mammen PP,Shelton JM,Goetsch SC,et al.Neuroglobin,a novel member of the globin family,is expressed in focal regions of the brain[J].J Histochem Cytochem,2002,50(12)∶1591-1598.
[3]Sun Y,Jin K,Mao XO,et al.Neuroglobin is up-regulated by and protects neurons from hypoxic-ischemic injury[J].Proc Natl Acad Sci USA,2001,98(26):15306-15311.
[4]Sun Y,Jin K,Peel A,et al.Neuroglobin protects the brain from experimental stroke in vivo[J].Proc Natl Acad Sci USA,2003,100(6):3497-3500.
[5]Yu DY,Cringle SJ.Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease[J].Prog Retin Eye Res,2001,20(2):175-208.
[6]Jiang T,Xing B,Rao J.Recent developments of biological reporter technology for detecting gene expression[J].Biotechnol Genet Eng Rev,2008,25:41-75.
[7]Querido E,Chartrand P.Using fluorescent proteins to study mRNA trafficking in living cells[J].Methods Cell Biol,2008,85:273-292.

