超声辐照对炎性痛的镇痛效应及机制初探
佘朝堃,乔海,王智彪,向理科,白晋
(1.重庆医科大学生物医学工程学院,省部共建超声医学工程国家重点实验室,超声医学工程重庆市市级重点实验室,重庆 400016;2.重庆医科大学病理学教研室,重庆 400016)
外周组织损伤引起的炎性病理性疼痛是日常多发病,临床主要采用非类固醇类抗炎药物治疗。经皮电刺激等物理治疗手段也具有一定的镇痛效果[1,2]。超声治疗目前在促进术后伤口愈合、软组织损伤修复、治疗皮肤老化和促进骨折愈合等方面已有较好的疗效[3]。已有研究表明超声辐照可提高正常兔的痛耐受阈值[4],而对炎性疼痛是否存在缓解作用国内外尚未见报道。本实验拟采用角叉菜胶致兔足跖炎性痛模型[5],研究低剂量超声辐照对炎性疼痛的缓解作用,并对其机制进行初步探讨。
1 材料与方法
1.1 材料
1.1.1 实验动物:16~18月龄健康新西兰大白兔35只,雌雄不限,体质量2.0~2.1 kg[重庆医科大学动物实验中心提供,许可证号:SCXK(YU)2007-001]。
1.1.2 实验试剂:角叉菜胶(Sigma公司,货号:22049-5G-F);注射用盐酸纳洛酮(国药一心制药有限公司,货号:H20060741)
1.1.3 测痛仪:von Frey触觉测量套件 (IITC Life Sciences,Woodland Hills,CA),型号:2391;测量范围:0~600 g。
1.1.4 治疗仪器:超声治疗仪(型号Y22010-05�03,频率0.2 MHz,输出功率0~2 W)由超声医疗国家工程研究中心提供。
1.2 方法
1.2.1 基准痛阈值测定及分组:动物剃毛器去除兔表层毛发后,以硫化钠溶液涂抹足跖,暴露皮肤,于足跖部中心位置做标记点。将兔置于网孔状底板的笼中适应30 min后,使用von Frey触觉测量套件硬性探头向上施压刺激兔足跖标记点,记录产生收缩逃逸反应时所施压力数值(单位g)。以2 min为间隔,测试3次,取平均值作为实验前基准痛阈值。采用分层随机分组法,将35只兔分为5组,分别为模型组、超声辐照组、假照组、纳洛酮组、生理盐水组,各组内基准痛阈值呈正态分布。
1.2.2 角叉菜胶致兔足跖炎性痛模型制作:各组兔右后腿足跖部皮下注射200 μL3%角叉菜胶溶液。离标记点1.5 cm处沿皮下进针,确保注射点位于标记点下,注射后立即将兔放回笼中。
1.2.3 痛阈值测定:足跖注射后,每小时测量足跖标记点机械痛阈值致第8 h,每个时间点以2 min为间隔测量3次取平均值。各时间点的痛阈值减去该兔基准痛阈值,得到的差值记为痛觉过敏分数(简称痛敏分数),作为评价炎症所致疼痛过敏程度的指标。
1.2.4 超声辐照:超声辐照组、纳洛酮组和生理盐水组,足跖注射角叉菜胶2.5 h后,使用0.2 MHz超声辐照足跖标记点20 min,输出声强0.3 W/cm2。假照组,超声治疗头紧贴足跖标记点,不予输出。辐照完毕立即放回笼内。
1.2.5 注射纳洛酮溶液和生理盐水:超声辐照前10 min,对纳洛酮组和生理盐水组分别予以肌肉注射纳洛酮溶液(0.8 mg/kg)或等体积生理盐水。
1.3 统计学分析
2 结果
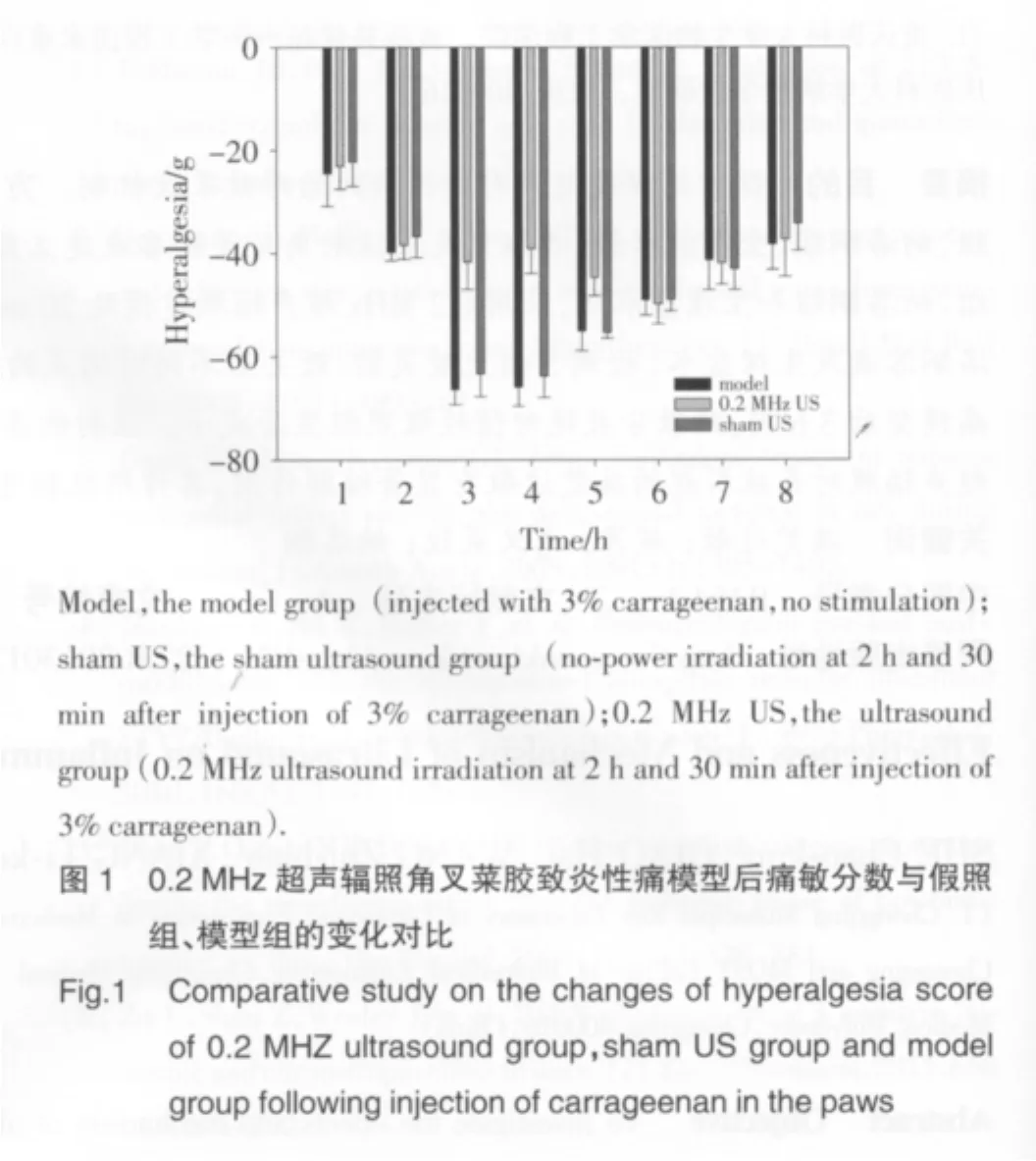
2.1 0.2 MHz的超声辐照兔足跖炎症处后痛敏分数的改变
注射角叉菜胶后第3 h、4 h、5 h,超声辐照组痛敏分数绝对值 [(41.64±5.39)g、(39.11±4.77)g、(44.63±3.60)g]与假照组[(63.33±4.42)g、(63.82±4.12)g、(55.32±1.19)g]相比显著减小,差异有统计学意义(P<0.01),其余各时间点痛敏分数绝对值差异无统计学意义(P>0.05);假照组与模型组各小时痛敏分数绝对值差异无统计学意义(P>0.05)(图1)。
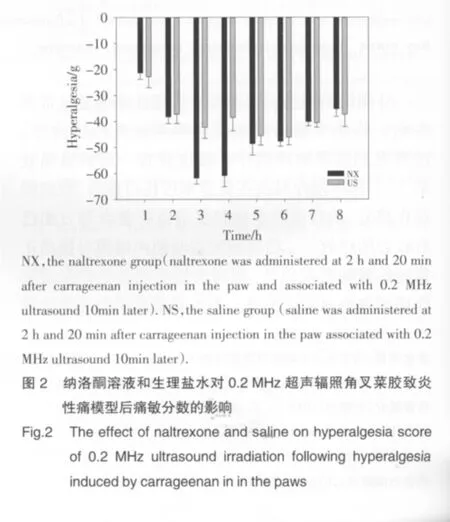
2.2 低剂量纳洛酮对超声辐照建模点后痛敏分数的影响
如图2所示:第3h、4h纳洛酮组[(-61.81±2.29)g、(-60.85±4.21)g]与生理盐水组[(-42.29±4.22)g、(-38.55±5.18)g]相比,痛敏分数绝对值增大,差异有统计学意义(P<0.01),其余各时间点痛敏分数绝对值差异无统计学意义(P>0.05)。
3 讨论
炎症过程中前列腺素等炎性介质能使周围神经中的伤害感受器神经元内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)含量升高,对缓激肽等物质的敏感性增强。使第1级传入伤害感受器对刺激反应阈值的下降,出现痛觉过敏症状。
临床所用非类固醇抗炎药通过抑制环加氧酶,(该酶催化花生四烯酸转化为前列腺素和血栓素),进而抑制前列腺素生物合成而发挥其镇痛抗炎作用。阿片类药物通过激活位于感觉神经外周端末梢上的阿片受体,抑制腺苷酸环化酶,降低细胞内cAMP水平,从而使由于炎性介质的影响而敏化的传入细纤维的兴奋性恢复到正常水平,以达到镇痛效果。有学者针对角叉菜胶致兔足跖炎性疼痛模型,在2.5 h时间点注射剂量为0.3 mg/kg的吗啡,机械痛阈值升高20 g左右[5]。而生物体自身存在内源性阿片肽系统,环境刺激,如冷热改变等可激活内源性阿片肽神经元,导致内源性阿片肽释放量增加[6],Bender等[7]通过温水和桑拿形成热刺激,使兔血浆β-内啡肽含量显著增加。
本实验证实,0.2 MHz超声辐照20 min,对炎症引起的痛觉过敏,在辐照后3 h内有显著缓解作用,与假照组相比机械致痛耐受阈值可最多升高20 g;假照组与模型组相比无显著性差异,排除了压力对镇痛效果的影响。
进一步实验发现0.2 MHz频率超声作用于炎症所致痛觉过敏模型,产生的痛觉过敏缓解效果,在注射纳洛酮后约2 h内明显减弱。纳洛酮能特异性地阻断阿片肽受体,3种主要阿片受体亚型(μ、δ和κ)中,纳洛酮与μ受体的亲和力较大,本实验采用针对兔的较低剂量纳洛酮,仅能对μ受体产生较强拮抗作用[8,9],故 μ 受体对应的 β-内啡肽或 Dermorphin等内源性阿片肽参与了0.2 MHz超声缓解炎性痛的过程。超声的温热作用和低频超声的机械振动作用,可能导致内源性阿片肽系统的激活,产生镇痛效果。
本实验建立了角叉菜胶致炎性痛模型,采用0.2 MHz进行超声辐照,结果显示超声辐照能有效缓解炎症导致的痛觉过敏,其镇痛机制可能与内源性阿片肽的参与有关。是否还存在其他镇痛途径,例如兴奋脊髓背角内的局部抑制回路[10]等,有待进一步实验证实。
[1]Francis RP,Marchant P,Johnson MI.Conventional versus acupuncture-like transcutaneous electrical nerve stimulation on cold-induced pain in healthy human participants:effects during stimulation[J].Clin Physiol Funct Imaging,2011,31(5):363-370.
[2]Nekhendzy V,Lemmens HJ,Tingle M,et al.The analgesic and antihyperalgesic effects of transcranial electrostimulation with combined direct and alternating current in healthy volunteers[J].Anesth Analg,2010,111(5):1301-1307.
[3]汪琴,乔海,白晋.低频超声促进哺乳期大鼠泌乳的实验研究[J].南方医科大学学报,2012,32(5):730-733.
[4]赵骏,林强,刘琳,等.聚焦超声辐照兔左侧足三里穴后双耳痛耐受阈的变化研究[J].中国医科大学学报,2011,40(5):390-393.
[5]Dong H,Sun H,Magal E,et al.Inflammatory pain in the rabbit:a new,efficient method for measuring mechanical hyperalgesia in the hind paw[J].J Neurosci Methods,2008,168(1):76-87.
[6]谢启文,王宪,朱文玉,等.神经肽[M].上海:复旦大学出版社,2004:131-141.
[7]Bender T,Nagy G,Barna I,et al.The effect of physical therapy on beta-endorphin levels[J].Eur J Appl Physiol,2007,100(4):371-382.
[8]Han JS.Acupuncture and endorphins[J].Neurosci Lett,2004,361(1-3):258-261.
[9]Wall PD,McMahon SB,Koltzenburg M.Wall and Melzack′s textbook of pain [M].5th ed.Philadelphia:Elsevier/Churchill Livingstone,2006:15-19.
[10]Johnson MI,Bjordal JM.Transcutaneous electrical nerve stimulation for the management of painful conditions:focus on neuropathic pain[J].Expert Rev Neurother,2011,11(5):735-753.

