叉头框转录因子M1在甲状腺乳头状癌组织中的表达及意义
吴文艺,张丽婷,王朝阳,邱建龙,朱世泽
(1.福建医科大学附属第二医院普通外科,福建 泉州3 62000;2.解放军第一八零医院内分泌科,福建 泉州3 62000)
甲状腺乳头状癌是甲状腺癌最常见的一种类型,占甲状腺恶性肿瘤的80%~85%[1]。尽管大部分病例预后良好,l0年生存率超过90%~95%[2],但文献报道甲状腺乳头状癌的发病率近几十年呈上升趋势[3],且依靠现有的方法无法判定临床颈淋巴结阴性(cN0)病例有无颈部淋巴结转移。如其他系统的肿瘤一样,基因改变长期以来被认为在甲状腺肿瘤的发生中起到一个基本的作用[4],其机制可能为抑癌基因启动子的高甲基化[4,5]、基因突变或表达异常。叉头框转录因子Ml(forkhead box M1,FoxM1)是Fox转录因子家族的重要成员,在肝癌、乳腺癌和脑恶性胶质细胞瘤等多种恶性肿瘤中过度表达,被认为是促进这些恶性肿瘤发生发展的重要因素,对这些肿瘤的生长、侵袭及血管形成能力均有重要影响[6~8]。本研究采用实时荧光定量PCR和Western blot,分别从mRNA和蛋白水平检测FoxM1在甲状腺乳头状癌中的表达,探讨其在甲状腺乳头状癌发生发展中的作用,以期为其早期诊治提供依据。
1 材料与方法
1.1 材料
所有新鲜组织标本均于2011年2月至2012年3月取自福建医科大学附属第二医院普通外科(均取得患者知情同意),其中甲状腺乳头状癌组织20例、癌旁正常甲状腺组织20例(对侧甲状腺正常组织)及甲状腺腺瘤20例作为对照组。甲状腺乳头状癌组中男8例,女12例;年龄26~62岁,中位年龄42岁;其中伴区域淋巴结转移10例,根据国际抗癌联盟和美国抗癌协会2002年的甲状腺癌临床分期,I期8例,Ⅱ期6例,Ⅲ期3例,ⅣA期3例。所有病例的癌组织经术后病理证实均为甲状腺乳头状癌,术前甲状腺功能均正常,均未接受放、化疗,均有完整的临床和病理资料。所取标本均平分切成2份(对侧甲状腺正常组织平分切成3份,其中1份送病理检查证实为正常组织),一份置于-80℃超低温冰箱中保存,用于Western blot,另一份则置于RNA样品保存液中,于4℃冰箱中保存,用于实时荧光定量PCR检测。
1.2 主要试剂及仪器
RNA提取试剂Trizol购自美国Invitrogen公司,逆转录试剂盒ReverAidTMH Minus First Strand cDNA Synthesis kit购自加拿大MBI公司,荧光定量PCR试剂SYBRⓇGreen Realtime PCR Master Mix购自日本东洋纺生物技术有限公司,RIPA裂解液、BCA法蛋白定量试剂盒RIPA裂解液、BCA法蛋白定量试剂盒、UltraECL底物化学发光检测试剂盒购自北京百泰克生物技术有限公司,兔抗人FoxM1单克隆抗体购自美国Santa Cruz公司,辣根过氧化物酶标记羊抗小鼠IgG购自北京中杉金桥生物技术有限公司,紫外可见分光光度计(DU800)购自美国贝克曼库尔特公司,基因扩增仪(PE9600)购自美国ABI公司,荧光定量PCR仪(ABI7500)购自美国ABI公司,凝胶成像分析系统(Tanon-2500)购自上海天能科技有限公司。
1.3 实验方法
1.3.1 实时荧光定量PCR:应用实时荧光定量PCR检测20例甲状腺乳头状癌组织及相应的20例癌旁正常甲状腺组织和20例甲状腺腺瘤组织中FoxM1 mRNA的表达情况。
1.3.1.1 RNA提取及逆转录反应 根据Trizol使用说明书,称取标本各约50 mg抽取其RNA,分光光度计测定各样品OD260与OD280吸光值,计算比值OD260/OD280,要求在1.80~2.00之间,同时1%琼脂糖凝胶电泳鉴定RNA完整性。电泳显示28S、18S和5S条带完整清晰。逆转录反应:1 μg经检测合格的总 RNA、0.5 μL Oligo(dT)、0.5 μL Random primer、2 μL10 mmol/L dNTPs mix、4 μL5 ×buffer、0.5 μL RNase inhibitor、0.5 μL M-MLV,并加水至20 μL,30℃保温10 min;42℃保温60 min;72℃保温10 min终止反应,取出-20℃保存备用。
1.3.1.2 荧光实时定量PCR 按照东洋纺荧光定量PCR试剂使用说明书,混合10 μL SYBRⓇGreen Realtime PCR Master Mix,10 ummol/L上下游特异引物各0.5 μL,9 μL适当稀释的cDNA模板,总反应体积为20 μL,在ABI7500荧光定量PCR仪上进行如下反应:95℃5 min(1个循环);95℃15 s,60℃15 s,72℃32 s采集荧光信号强度(40个循环),重复实验3次。内参基因选用人类18srRNA基因(GenBank 号:NR_003286,Homo sapiens18S ribosomal RNA)。引物序列自行设计,上游引物:CCTGGA TACCGCAGCTAGGA,下游引物:GCGGCGCAATACG AATGCCCC,扩增产物大小为112 bp;FoxM1上游引物:TGGATCTTGGGTTCTTCACT,下游引物:ACCCA CACTCTGCTTCAGTT,扩增产物大小为200 bp。将PCR产物作熔解曲线分析,确定产物特异性。
1.3.1.3 结果分析 采用定量PCR仪自带分析软件分析各样品各基因表达情况。相对定量的计算方法采用2-ΔΔCT法,具体计算公式:ΔΔCT=(CT.Target-CT.Actin)Timex-(CT.Target-CT.Actin)Time0,RQ 值 =2-ΔΔCT。 RQ T.Target与RQ T.Actin的比值即为相对定量值,其中T.Target为目的基因,T.Actin为内参基因,Timex为病理样品,Time0为正常人样品。
1.3.2 Western blot检测:应用Western blot检测20例甲状腺乳头状癌组织及相应的20例癌旁正常甲状腺组织和20例甲状腺腺瘤组织中FoxM1蛋白的表达情况。每例标本取3 g,将组织剪切成细小的碎片(组织直径1 mm)。按照每20 mg组织加入150 μL裂解液的比例加入裂解液。用玻璃匀浆器匀浆,直至充分裂解。12000 r/min,4℃离心5 min,收集上清,用于后续实验。采用北京百泰克生物技术有限公司生产的BCA法蛋白定量试剂盒测定各样品总蛋白含量。SDS-PAGE电泳,转膜,封闭,加入适当稀释的一抗、二抗(一抗稀释倍数为200倍,二抗稀释倍数为1000倍),ECL化学发光法检测显影。底片通过凝胶灰度分析软件Quantity One 4.6.2进行灰度值定量。每组实验重复3次。
1.4 统计学处理
实验所得数据均采用SPSS17.0软件进行分析,采用t检验或ANOVA分析比较均值。P<0.05为差异有统计学意义。
2 结果
2.1 FoxM1mRNA的表达情况
FoxM1mRNA在甲状腺乳头状癌组织(41.68±15.65)中呈高表达,在癌旁正常甲状腺组织(2.73±1.00)、甲状腺腺瘤组织(2.32±1.06)中呈低表达。甲状腺乳头状癌组织中FoxM1mRNA的表达显著高于其对应的癌旁正常甲状腺组织(P=0.000)和甲状腺腺瘤组织(P=0.000)。癌旁正常甲状腺组织和甲状腺腺瘤组织中FoxM1mRNA表达的差异无统计学差异(P=0.257)。
2.2 FoxM1蛋白的表达情况
FoxM1蛋白在甲状腺乳头状癌组织(0.897±0.117)中呈高表达,在癌旁正常甲状腺组织(0.211±0.029)和甲状腺腺瘤组织(0.193±0.028)中呈低表达。甲状腺乳头状癌组织与癌旁正常甲状腺组织及甲状腺腺瘤组织比较,FoxM1蛋白表达的差异有统计学意义(P<0.01)。癌旁正常甲状腺组织和甲状腺腺瘤组织中FoxM1蛋白表达的差异无统计学意义(P>0.05)。见图1。
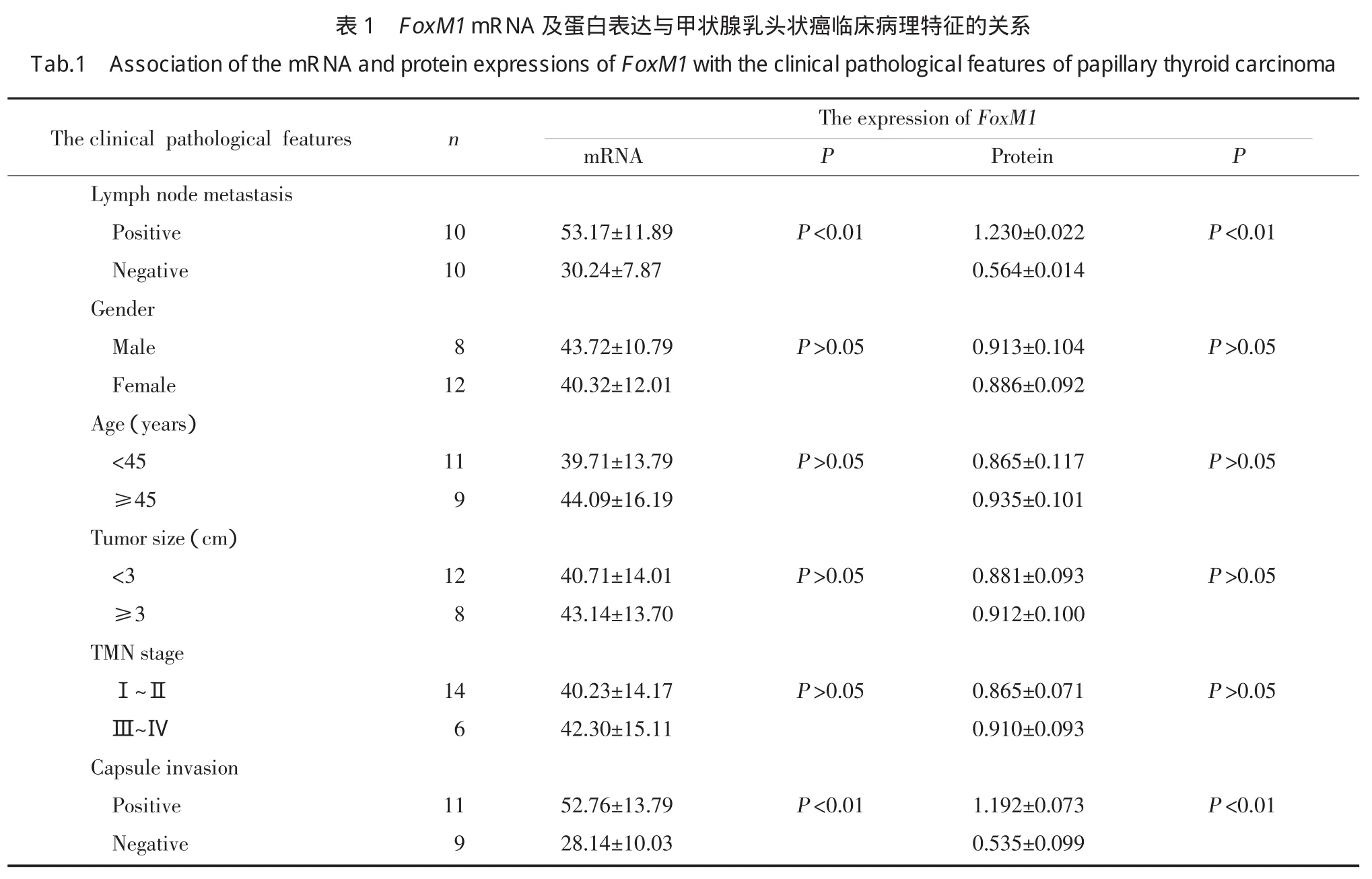
2.3 FoxM1mRNA及蛋白表达与甲状腺乳头状癌临床病理特征的关系
在甲状腺乳头状癌组织中,FoxM1mRNA及蛋白在有淋巴结转移组的表达要高于无淋巴结转移组,有包膜侵犯组FoxM1mRNA及蛋白表达高于包膜无侵犯组,差异均有统计学意义(均P<0.01)。FoxM1mRNA及蛋白的表达与患者的性别、年龄、肿瘤大小及TNM分期均无关(P>0.05)。见表1。
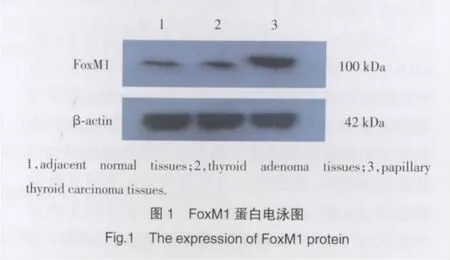
3 讨论
FoxM1是Forkhead蛋白家族中的一员,定位于染色体12p13.3末端着丝粒区域,全长约25 kb,仅在具有分裂活性的细胞中表达。FoxM1与细胞增殖密切相关,Wonsey等[9]发现,FoxM1在DNA 合成前期、DNA合成期和有丝分裂期表达显著增强,可介导细胞进入DNA合成和有丝分裂期。FoxM1对细胞增殖的影响主要是通过抑制细胞周期素依赖性激酶抑制剂p21Cip1/Waf1和p27Kip,进而影响某些细胞周期素或细胞周期素依赖性激酶活化剂Cdc25a和Cdc25b磷酸酶的活性来实现的[10]。FoxM1功能的缺失可能阻碍细胞分化,并最终导致细胞恶性转变[11]。FoxM1基因在多种肿瘤细胞中异常高表达,促进肿瘤的发生发展及肿瘤干细胞存在和功能的发挥,如在肝癌、乳腺癌、胰腺癌、胃癌、结直肠癌、上皮性卵巢癌、脑胶质细胞瘤、非小细胞肺癌等多种恶性肿瘤中异常升高,是促进多种恶性肿瘤细胞增殖和侵袭的关键转录因子[6~8,12~19]。
本研究中,荧光实时定量PCR结果显示FoxM1 mRNA在甲状腺乳头状癌的表达明显高于癌旁正常甲状腺组织和甲状腺腺瘤组织。Western blot结果与实时定量PCR结果一致,FoxM1蛋白在甲状腺乳头状癌组织的表达明显高于癌旁正常甲状腺组织和甲状腺腺瘤组织,而癌旁正常甲状腺组织和甲状腺腺瘤组织FoxM1mRNA及蛋白表达的差异均无统计学意义(P>0.05)。有包膜侵犯组FoxM1mRNA及蛋白表达明显高于包膜无侵犯组,差异有统计学意义(P<0.01)。甲状腺乳头状癌组织中FoxM1表达异常升高,可能促进了甲状腺乳头状癌的发生、发展及包膜的侵袭。刘钢等[20]的研究表明,凋亡抑制基因Survivin在甲状腺乳头状癌组织中表达明显高于癌旁正常甲状腺组织和甲状腺腺瘤组织,结合本研究结果,我们推论甲状腺乳头状癌组织中FoxM1表达异常升高,是引起其下游基因Survivin在甲状腺乳头状癌异常表达的根本原因。本研究还发现,有颈部淋巴结转移组FoxM1mRNA及蛋白的表达较无淋巴结转移组明显增加,差异有统计学意义(P<0.01),这可能是甲状腺乳头状癌易于早期出现颈部淋巴结转移的原因之一。但它在颈部淋巴结转移过程中所发挥的作用及作用的大小以及发生淋巴结转移的确切机制尚不明确,需进一步证实。
影响甲状腺乳头状癌预后的因素有性别、年龄、肿瘤大小、原发癌是否侵出包膜及有无周围器官侵犯[21]。本研究显示FoxM1mRNA及蛋白在不同性别、年龄、肿瘤大小及TNM分期的甲状腺乳头状癌组织中的表达差异无统计学意义(P>0.05),提示甲状腺乳头状癌中FoxM1的表达与患者性别、年龄、肿瘤大小及TNM分期无关。
综上,FoxM1的过度表达在甲状腺乳头状癌的发生发展、淋巴结转移、包膜侵犯中可能有重要作用,可能是其发生过程中的早期事件。但FoxM1 mRNA及蛋白在不同性别、年龄、肿瘤大小及TNM分期的甲状腺乳头状癌组织中的表达无明显差异,提示甲状腺乳头状癌的发病过程中可能有多种因素参与,单一FoxM1的过度表达并不能预测甲状腺乳头状癌的预后,FoxM1在甲状腺乳头状癌的发生、发展中的作用及确切机制还需要进一步的研究。
[1]Sosa JA,Udelsman R.Papillary thyroid cancer[J].Surg Oncol Clin N Am,2006,15(3):585-601.
[2]How J,Tobah R.Explaining the increasing incidence of differentiated thyroid cancer[J].Can Med Assoc J,2007,117(11):1383-1384.
[3]Puxeddu E,Moretti S.Clinical Prognosis in BRAF-Mutated PTC[J].Arq Bras Endocrinol Metab,2007,51(5):737.
[4]戴亚丽,蔡德鸿,陈宏,等.乳头状甲状腺癌TSHR基因转录表达和启动子区甲基化研究[J].南方医科大学学报,2010,30(1):114-116.
[5]戴亚丽,蔡德鸿,陈宏,等.促进甲状腺激素受体和p16抑癌基因甲基化与乳头状甲状腺癌临床病理的关系[J].首都医科大学学报,2012,33(3):361-365.
[6]Kaliniehenko VV,Major ML,Wang X,et al.FoxM1b transcription factor is essential for development of hepatocellular carcinomas and is negatively regulated by the p19ARF tumor suppressor[J].Genes Dev,2004,18(7):830-850.
[7]Madureim PA,Varshochi R,Constantinidou D,et al.The Forkhead box M1 protein regulates the transcription of the estrogen receptor alpha in breast cancer ceils[J].J Biol Chem,2006,281(35):25167-25176.
[8]Liu M,Dai B,Kang SH,et al.FoxM1B is overexpressed in human glioblastomns and critically regulates the tumorigenicity of glioma cells[J].Cancer Res,2006,66(7):3593-3602.
[9]Wonsey DR,Follettie MT.Loss of the forkhead transcription factor FOXMl causes centrosome amplification and mitotic catastrophe[J].Cancer Res,2005,65(12):518l-5189.
[10]Petrovic V,Costa RH,Lau LF,et al.FoxM1 regulates growth factorinduced expression of kinase-interacting stathmin(KIS)to promote cell cycle progression[J].J Biol Chem,2008,283(1):453-460.
[11]Wang X,Quail E,Hung NJ,et al.Increased levels of forkhead box MlB transcription factor in transgenic mouse hepatocytes prevent age-related proliferation defects in regenerating liver[J].Proc Natl Acad Sci USA,200l,98(20):11468-11473.
[12]Wang Z,Banerjee S,Kong D,et al.Down-regulation of Forkhead Box M1 transcription factor leads to the inhibition of invasion and angiogenesis of pancreatic cancer cells[J].Cancer Res,2007,67(17):8293-8300.
[13]Kim IM,Ackemon T,Ramakrishna S,et al.The Forkhead Box M1 transcription factor stimulates the proliferation of tumor cells during development of lung cancer[J].Cancer Res,2006,66(4):2153-2161.
[14]冯亚光,魏正强.Shh、Glil、FoxM1蛋白在胃癌中的表达及临床意义[J].广东医学,2011,32(19):2536-2538.
[15]唐惠,郭强,朱军,等.FoxM1在结直肠腺瘤和结直肠癌组织中的异常表达及意义[J].肿瘤防治研究,2011,38(10):1197-1200.
[16]陈国庆,姚珍薇,罗欣.FoxM1在上皮性卵巢癌中的表达及临床意义[J].生命科学研究,2011,15(1):70-74.
[17]刘怡茜,郭人花,刘连,等.叉头框转录因子M1在非小细胞肺癌中的表达及其与患者临床病理特征和生存的关系[J].中华肿瘤杂志,2011,33(6):426-429.
[18]周磊,张萍海,徐欣,等.下调叉头转录因子M1基因表达对非小细胞肺癌细胞生长与侵袭能力的影响[J].中华医学杂志,2009,89(34):2424-2428.
[19]孙红成,李敏,陆吉,等.短发卡RNA稳定沉默FOXMl对肝癌细胞体外生长的影响[J].中华普通外科杂志,2011,26(5):398-401.
[20]刘钢,史火喜,袁又能,等.凋亡抑制基因Survivin在甲状腺癌组织中的表达及意义[J].中华临床医师杂志,2011,5(3):840-843.
[21]董志伟,谷铣之.临床肿瘤学[M].北京:人民卫生出版社,2002:618-619.

