TTC染色评价豚鼠离体心脏缺血/再灌注损伤梗死面积的适宜观察时间及计算方法
王燕,胡慧媛,赵美眯,闵冬雨,聂志伟,孙雪菲,赵金生,印丹丹,郝丽英
(1.中国医科大学药学院药物毒理教研室,沈阳110001;2.辽宁中医药大学附属医院中心实验室,沈阳110032;3.中国医科大学基础医学院机能实验中心,沈阳110001)
2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)是脂溶性光敏感复合物,1894年首次合成用来检测种子的生存能力,1958年开始用来染色检测哺乳动物组织的缺血梗死[1]。TTC染色因染色后颜色较易观察且灵敏性高而被广泛用于研究离体心脏缺血/再灌注损伤中[2]。在TTC染色方法中染料浓度、染色时间较为明确,TTC浓度大多采用1%[3]和1.5%[4],染色时间为10~20 min[5~9]。但是,对于TTC染色后较为适宜的观察时间目前尚无文章报道。在结果分析方面,大多实验采用全部心脏切片进行TTC染色。此法虽可全面评估缺血/再灌注损伤,但TTC染色后的心脏横切片无法再应用于Western blot、PCR等后续实验中[10]。因此,本研究通过制作豚鼠离体心脏缺血/再灌注模型,将心脏制成4个横切片后进行TTC染色,分别于染色后4个时间点(1、2、3、4周)对其进行逐个观察,明确应用TTC染色方法评价豚鼠离体心脏缺血/再灌注损伤的适宜观察时间;并分别统计前2片、前3片和前4片的梗死面积百分比,明确是否可采用单个横切片染色判断缺血/再灌注损伤以及如何采用多个横切片进行统计等问题,以此建立节省实验时间和动物的TTC染色观察和统计方法。
1 材料与方法
1.1 材料
豚鼠11只,雌雄不限,280~420 g,由中国医科大学实验动物中心提供。TTC染料(由Amrecro公司提供);主要配方:Krebs-Henseleit(K-H) 溶液(mmol·L-1):NaCl116,KCl3.6,CaCl21.2,KH2PO41.16,MgSO40.58,NaHCO323.0,Glucose5.4,Pyruvate0.3,Insulin2.8 U·L-1,pH 7.38~7.42。0.1 mol/L PBS溶液(mmol/L):NaH2PO419,Na2HPO481,NaCl15.4,以上试剂均购自国药集团。
1.2 方法
1.2.1 实验动物分组及动物模型的制备:11只豚鼠饲养观察1周后,腹腔注射戊巴比妥钠(50 mg/kg)麻醉,仰卧位固定,剪开颈部皮肤,分离颈部肌肉,暴露气管,穿线,剪开气管,行气管插管,固定气管。剪胸部皮毛,分离胸肌,暴露主动脉,分离主动脉旁结缔组织,主动脉插管,插管成功后将心脏离体并置于37℃的保温槽中行主动脉逆行灌注(稳定后心率<130次/min者放弃)。灌流温度控制在(37±0.2)℃,灌注压为75 cmH2O,并于灌注过程中持续通入含95%O2和5%CO2混合气体。
1.2.2 分组:Langendorff灌流装置中用正常K-H液灌注心脏,先平衡10 min,稳定15 min,对照组(control组,n=5)继续用正常K-H液灌流90 min,缺血/再灌注组(I30R60组,n=6)用止血钳夹紧灌流管,全心缺血30 min后松开止血钳,正常K-H液再灌注60 min。
1.2.3 TTC染色:灌流结束后,取下心脏,取刀片垂直心脏长轴将其横切为5片,每片约为2 mm。展平后置于PBS(0.1 mol/L)溶解的1%TTC溶液中,37℃避光孵育20 min,取出后置于10%中性甲醛(0.1 mol/L PBS配制)中。分别于染色后第1、2、3、4周对4个横切片的正反两面进行图像采集,照片采用Photoshop3S Extended软件计算梗死面积。梗死面积百分比(%)=梗死面积/横切片总面积×100%。
1.3 统计学处理
2 结果
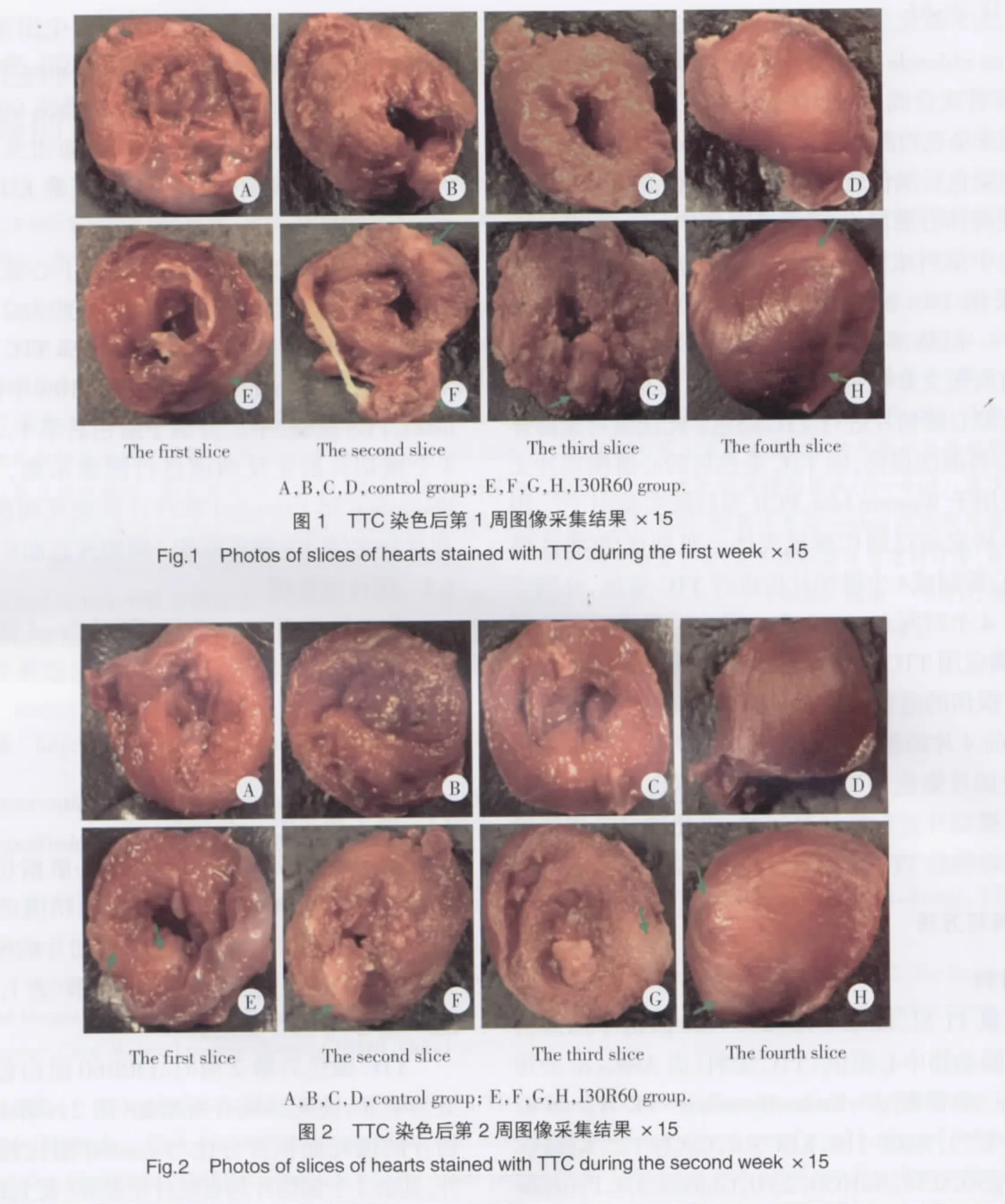
2.1 第1周TTC染色结果
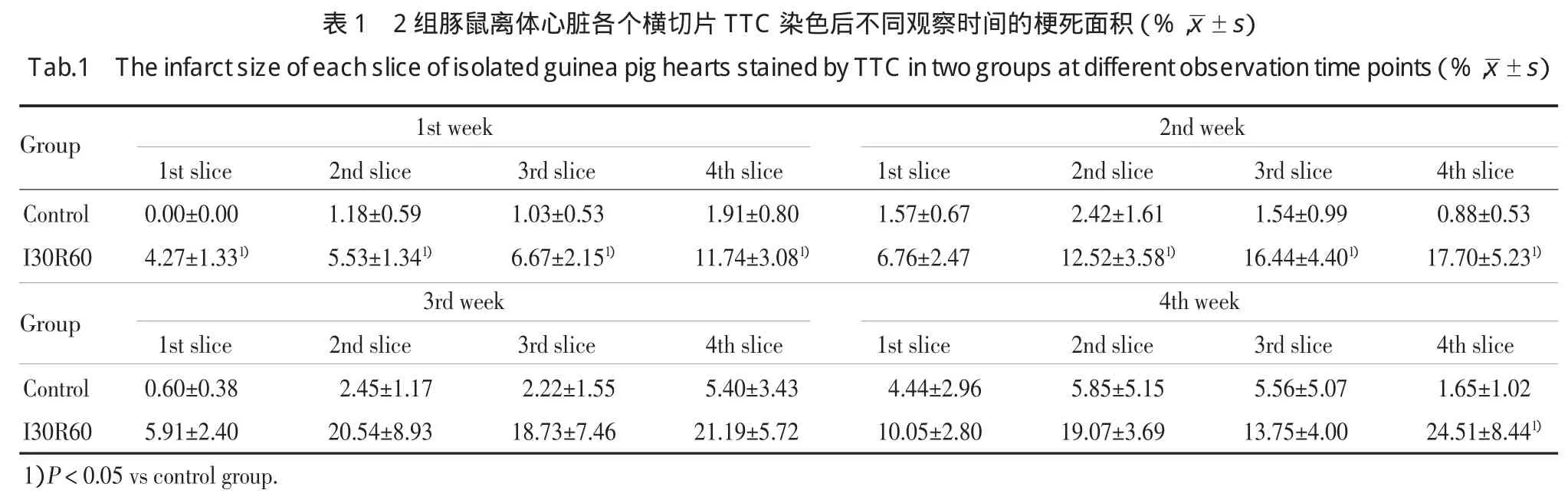
如图1所示,control组各个心脏横切片染色后为砖红色。I30R60组染色后可见稍浅的白色区域(图1箭头所示),第1、2、3、4横切片的梗死面积百分比与control组比较均有统计学差异(表1,P<0.05)。
2.2 第2周TTC染色结果
TTC染色后第2周时,I30R60组白色梗死区域更为明显,梗死区域有所增加(图2),第1、2、3、4 横切片的梗死面积百分比与control组比较除第1片外,其余3个横切片均有统计学差异(表1,P<0.05)。
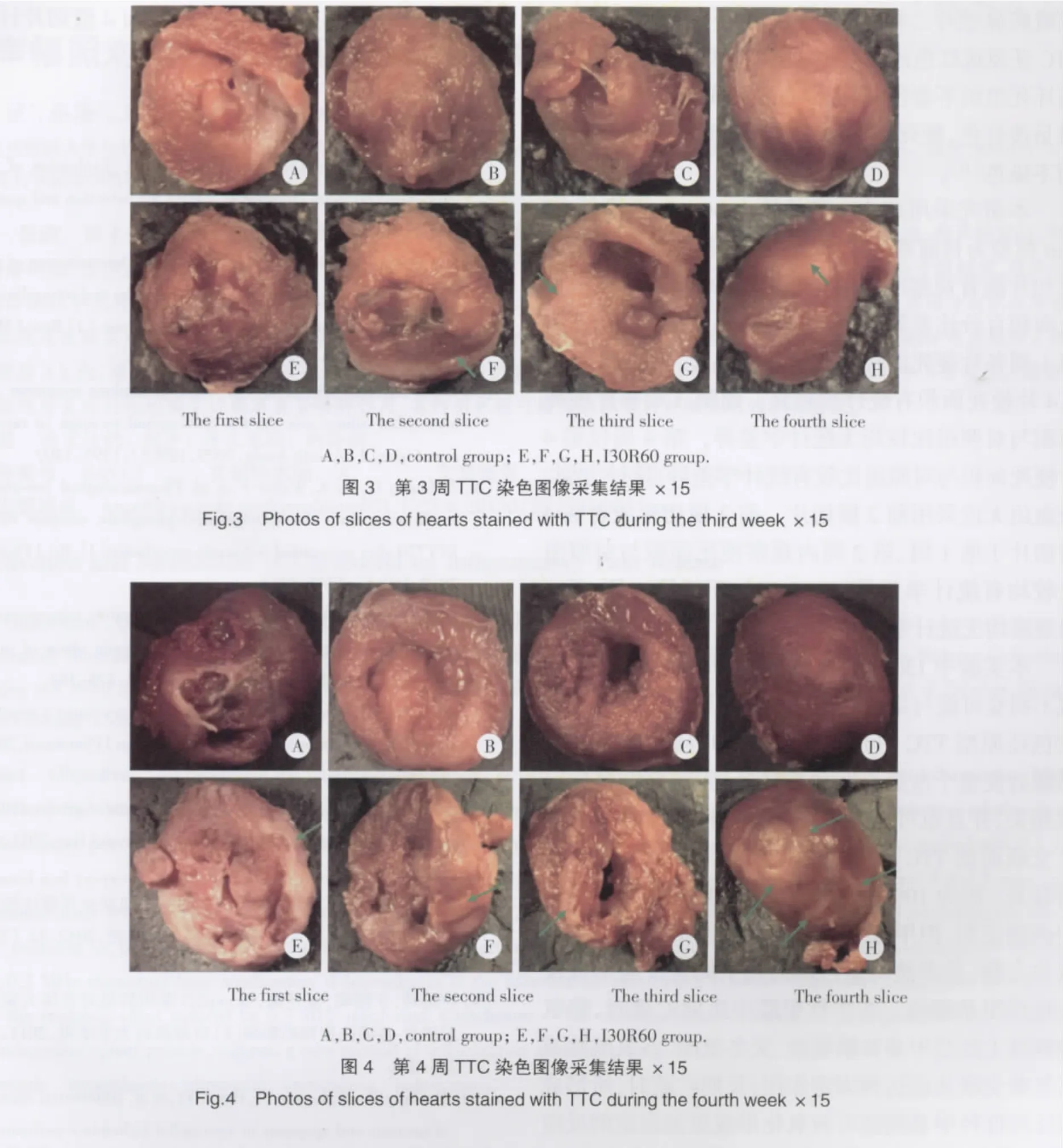
2.3 第3周TTC染色结果
如图3所示,I30R60组染色后可见稍淡的白色区域,第1、2、3、4横切片的梗死面积百分比与control组比较均无统计学差异(P>0.05,表1)。
2.4 第4周TTC染色结果(图4)
TTC染色后4周I30R60组中第4个横切片梗死面积百分比,与control组比较具有统计学差异(P<0.05),其余各横切片均无统计学差异(P>0.05,表1)。
2.5 TTC染色梗死面积计算方法比较
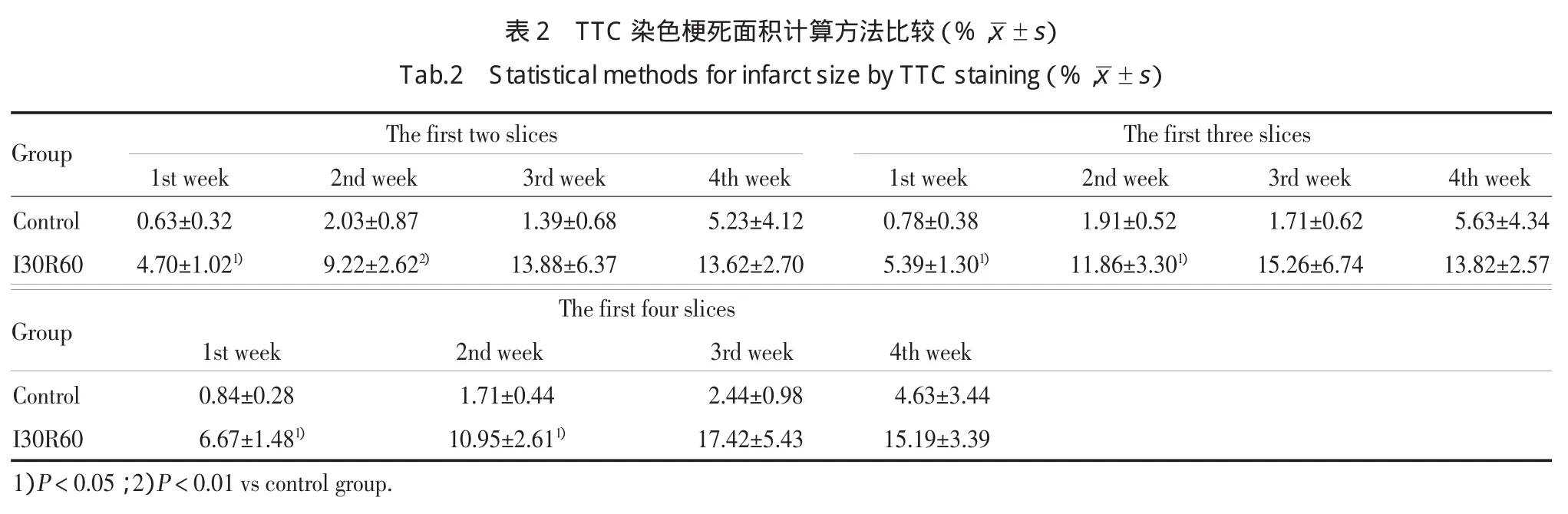
如表2所示,采用前2横切片(包括第1片和第2片)计算梗死面积百分比的结果显示,I30R60组第1周和第2周的梗死面积与control组比较有统计学差异(P<0.01,P<0.05),第3周和第4周2组与control组比较无统计学差异(P>0.05)。前3横切片(包括第1片、第2片和第3片)计算结果可见,I30R60组第1周和第2周的梗死面积百分比与control组比较有统计学差异(P<0.05),第3周和第4周2组比较无统计学差异(P>0.05)。前4横切片(包括第1片、第2片、第3片和第4片)计算结果显示,I30R60组第1周和第2周的梗死面积百分比与control组比较有统计学差异(P<0.05),第3周和第4周2组比较无统计学差异(P>0.05)。
3 讨论
TTC染色法是依据组织中琥珀酸脱氢酶在二氢烟酰胺腺嘌呤二核苷酸存在条件下,将无色氧化型TTC还原成红色还原型TTC,使有活性的组织染色,而坏死组织不着色,即正常心肌染成砖红色,存活心肌呈淡红色,梗死心肌由于缺乏完整的脱氢酶系统而不染色[11]。
本研究采用离体心脏的缺血30 min再灌注60 min模型为目前常用模型,结果表明,缺血组各个心脏切片随着观察时间的延长I30R60组与对照组梗死面积百分比差异较小,与对照组比较,I30R60组第1周各片梗死面积均有统计学差异,第2周第2、3、4片梗死面积有统计学差异,而第3周各片梗死面积与对照组比较均无统计学差异,第4周仅第4片梗死面积与对照组比较有统计学差异。统计方面,缺血组无论采用前2横切片、前3横切片或者前4横切片于第1周、第2周内观察梗死面积与对照组比较均有统计学差异(P<0.05),而于第3周、第4周观察均无统计学差异(P>0.05)。
本实验中I30R60组于第3、4周内观察梗死区域不明显可能与染色后的心肌长期贮存于甲醛中使红色还原型TTC甲月赞(formazan)溶解,所染颜色渐褪后使整个所染心肌色差降低,无法判断梗死区域相关,并且也可能与甲醛中心脏横切片的蛋白发生交联而使TTC染色后的砖红色区域褪色或者变白有关。因为10%中性甲醛虽是诊断病理学中最常用的固定剂,但甲醛水溶液中甲醛能形成亚甲基氢氯化合物,后者能与蛋白质的几个侧链反应形成反应性羟甲基侧链。在中性甲醛中短期贮藏时,赖氨酸侧链上的羟甲基和精氨酸、天冬氨酸、谷氨酰胺或酪氨酸交联从而达到固定作用;长期贮藏时,所形成的反应性羟甲基侧链可被氧化形成更加稳定的反应基,从而使大分子变性并使它们不可溶解进而出现蛋白交联[12]。
本实验结果提示,在利用TTC染色进行评价豚鼠离体心脏缺血/再灌注损伤实验时单个横切片或多个横切片共同观察的适宜观察时间为第1周和第2周。统计方法上,可采用第1周或第2周的前2横切片、前3横切片,剩余切片可用于Western blot、PCR等后续实验中;在实验时间和条件允许情况下,亦可使用第1周或第2周的前4横切片计算梗死面积百分比。
[1]Bederson JB,Pitts LH,Germano SM,et al.Evaluation of2,3,5-triphenyltetrazolium chloride as a stain for detection and quantification[J].Stroke,1986,17(6):1304-1308.
[2]Dos Santos L,Mello AF,Antonio EL,et al.Determination of myocardial infarction size in rats by echocardiography and tetrazolium staining:correlation,agreements,and Simplifications[J].Braz J Med Biol Res,2008,41(3):199-201.
[3]Gross ER,Hsu AK,Gross GJ.Acute methadone treatment reduces myocardial infarct size via the delta-opioid receptor in rats during reperfusion[J].Anesth Analg,2009,109(5):1395-1402.
[4]Hofmann U,Hu K,Walter F,et al.Pharmacological pre-and postconditioning with the sphingosine-1-phosphate receptor modulator FTY720 after myocardial ischaemia-reperfusion[J].Bri J Pharmacol,2010,160(5):1243-1251.
[5]Dost T,Cohen MV,Downey JM.Redox signaling triggers protection during the reperfusion rather than the ischemic phase of preconditioning[J].Basic Res Cardiol,2008,103(4):378-384.
[6]Zu L,Shen Z,Wesley J,et al.PTEN inhibitors cause a negative inotropicandchronotropiceffectinmice[J].EurJPharmacol,2011,650(1):298-302.
[7]Clark C,Smith W,Lochner A,et al.The effects of gender and obesity on myocardial tolerance to ischemia[J].Physiol Res,2011,60(2):291-300.
[8]董淑英,童旭辉,刘浩,等.石榴多酚对心肌缺血再灌注损伤大鼠心功能的保护作用[J].南方医科大学学报,2012,32(7):924-927.
[9]卢玲巧,于刚刚,张冬梅,等.cyp2j3基因转染对在体大鼠离体心肌缺血-再灌注损伤的影响[J].首都医科大学学报,2011,32(2):234-238.
[10]McCully JD,Wakiyama H,Hsieh YJ,et al.Differential contribution of necrosis and apoptosis in myocardial ischemia-reperfusion injury[J].AmJPhysiolHeartCircPhysiol,2004,286(5):H1923-H1935.
[11]Ferrera R,Benhabbouche S,Bopassa JC,et al.One hour reperfusion is enough to assess function and infarct size with TTC staining in langendorffrat model[J].Cardiovasc Drugs Ther,2009,23(4):327-331.
[13]Bancroft JD,Gamble M.组织学技术的理论与实践[M].周小鸽,译.北京:北京大学医学社,2010:47-50.

