长期递增负荷运动对大鼠脾淋巴细胞增殖活性、凋亡及凋亡相关基因表达的影响
王雪芹,郝选明
运动免疫学研究业已证实,长期从事长时间大强度运动对免疫机能有非常强烈的负性影响[2],表现为淋巴细胞数量减少,亚群改变;细胞毒性降低,细胞免疫功能受损;主要免疫球蛋白及补体含量降低;中性粒细胞吞噬作用降低;大负荷运动降低巨噬细胞的抗原提呈及MHC的表达等,说明长期大强度运动训练对细胞和体液免疫都有明显的负性作用。为了进一步揭示长期大强度运动对免疫机能及机制的影响,课题组前期进行了大量研究,发现6周递增负荷运动会使中枢免疫器官骨髓、胸腺中B细胞和T细胞的发育分化失衡;会影响外周免疫器官脾脏、小肠集合淋巴结中淋巴细胞的增殖分化、吞噬能力、IL-2表达、sIL-2R 表 达 及 凋 亡 等[3,9-11,13]。
脾脏是重要的外周免疫器官,是淋巴细胞定居、增殖和产生免疫应答的场所。那么,6周递增负荷运动会导致脾脏淋巴细胞增殖活性和凋亡的改变,从而影响机体的免疫水平吗?其机制又是什么?本研究主要通过观察递增负荷运动对脾脏淋巴细胞的增殖能力、线粒体膜电位(mitochondrial membrane potential,△Ψm)的变化及Bax和Bcl-2 mRNA的表达情况,探讨6周递增负荷运动对脾脏淋巴细胞增殖活性与凋亡及机制。
1 研究对象与方法
1.1 研究对象与分组
8周龄、64只SPF级雄性SD大鼠[购自广东中医药大学实验动物中心,许可证号:SCXK(粤)2008-0020;NO:0104976,粤监证字F2008A002]被随机分为对照组和实验组[0周组(WK0)、2周组(WK2)、4周组(WK4)和6周组(WK6)]共8组,每组8只。实验组32只进行6周递增强度训练;对照组32只正常喂养,不进行运动干预,用于判别大鼠生长对测试指标的影响,结果发现,对照组指标各周之间没有显著性差异(P>0.05),表明6周生长对这些指标没有显著影响。实验组分别于第0、2、4、6周周末取脾脏并测试相关指标。
1.2 运动方案
本研究采用6周递增负荷运动模型(表1),本模型是课题组通过反复实验性探索获得的运动性免疫失衡发生、发 展 的 动 物 训 练 模 型[3,9,11-13]。 采 用 适 应 性 运 动 训 练 (10 m/min)1周后,负荷递增至20m/min;随后,每周负荷增量5m/min;第6周时达到40m/min,基本达到大鼠的最大负荷强度。分别于第0、2、4、6周的最后一次运动后48 h,安静状态下无菌取脾脏。
无菌取得大鼠脾脏后,一部分用锡纸包好放在液氮中,用于mRNA的研究;一部分直接放入灭菌的PBS中,制备细胞悬液,进行淋巴细胞刺激指数和线粒体膜电位的测定。

表1 本研究运动训练方案一览表Table 1 List of Exercise Plan in the Study
1.3 测试指标与方法
1.3.1 脾脏系数的测定
在冰块上迅速分离取脾脏,称重,用于计算脾脏系数[脾脏系数=脾脏重量(mg)/体重(g)×100%]。
1.3.2 淋巴细胞悬液的制备[7]及 MTT法测定淋巴细胞刺 激 指 数[5,15,21]
无菌摘取脾脏,用200目钢网把脾脏研磨到PBS中,制备成细胞液;吸取淋巴细胞分层液(每8ml细胞液加3 ml分层液)置于10ml离心管中,然后将离心管倾斜45°角,将细胞液在距分层液界面1cm处沿试管壁缓慢加至分层液上面,注意保持两者界面清晰,勿使血液混入分层液内;将离心管放于水平式离心机内,在18℃~20℃下,以2 000rpm离心20min。离心后,用毛细吸管吸取淋巴细胞悬液;将所得细胞悬液用PBS洗涤2次,依次以2 000 rpm、1 500rpm,离心10min;用完全 RPMI-1640定容细胞,记数细胞后再调整细胞至所需浓度。细胞活力和数目测定采用计数板法:将细胞悬液0.5ml加入试管中,后加入0.5ml 0.1%的台盼蓝染液,染色1min;镜下观察,不着色、体积较小、折光性强者为活淋巴细胞,凡染成蓝色、体积较大且无光泽者为死淋巴细胞。镜下取几个任意视野分别计数死细胞和活细胞数。活力测定可以与细胞计数同时进行,但要考虑到染液对原细胞悬液的加倍稀释作用。活细胞数/ml=(4个大方格内活细胞总数/4)×2×104;活细胞数%=活细胞数/(活细胞数+死细胞数)×100%.
用加样器将制备好的淋巴细胞悬液(浓度2×106/ml)加到96孔细胞培养板中(100μl/孔),每个样本加6孔,6个样本孔中,其中3孔加ConA,100μl/孔,另外3孔加培养液作对照,100μl/孔;置5%CO2、37℃的培养箱中培养68h,后每孔加入10μl质量浓度为5mg/ml的 MTT,37℃温育4h(共72h);每孔加入溶剂100μl,稍振荡待甲肷产物充分溶解;用酶标仪(Tecan Infinite F200)以波长570nm测定OD值,重复3次;计算SI(Stimulating Index)=ConA刺激管中的OD均值/对照管中的OD均值。
1.3.3 线粒体膜电位测定
1.3.4 Bax、Bcl-2mRNA的测定
RNAiso Plus和SYBR○RPremix Ex TaqTM 反应试剂购自(TaKaRa)大连宝生物公司;引物(表2)委托上海Invitrogen公司合成;采用全自动荧光定量PCR仪进行测定。反应结束后,PCR仪给出各反应孔的Ct值,以甘油醛-3-磷酸脱氢酶(GAPDH)基因为内参,根据公式2-△△Ct计算样品目的基因的相对表达量。

表2 本研究GAPDH、Bax、Bcl-2的引物情况一览表Table 2 Gene-specific Primers of GAPDH,Bax,Bcl-2
1.4 数据的统计学处理
2 结果
2.1 长期递增负荷运动对大鼠脾系数及淋巴细胞刺激指数(SI)的影响
结果显示,6周递增负荷运动过程中,大鼠脾脏系数是呈递减的。与WK0组相比,WK2组的脾脏系数明显低于WK0组,差异显著(P<0.05);WK4、WK6组的脾脏系数也都明显低于 WK0组,差异非常显著(P<0.01)。在6周递增负荷运动过程中,大鼠脾脏淋巴细胞SI也明显降低。与WK0组相比,WK4、WK6组的脾脏淋巴细胞SI都明显低于 WK0组,差异显著(P<0.05)。与 WK2组相比,WK4、WK6组的脾脏淋巴细胞SI都明显低于 WK2组,差异显著(P<0.05;表3)。
2.2 长期递增负荷运动对大鼠脾脏淋巴细胞△Ψm的影响

表3 本研究大鼠脾脏淋巴细胞SI的变化一览表Table 3 Changes of Lymphocyte SI in Spleen

表4 本研究大鼠脾脏淋巴细胞△Ψm的变化一览表Table 4 Changes of Lymphocyte△Ψm in Spleen
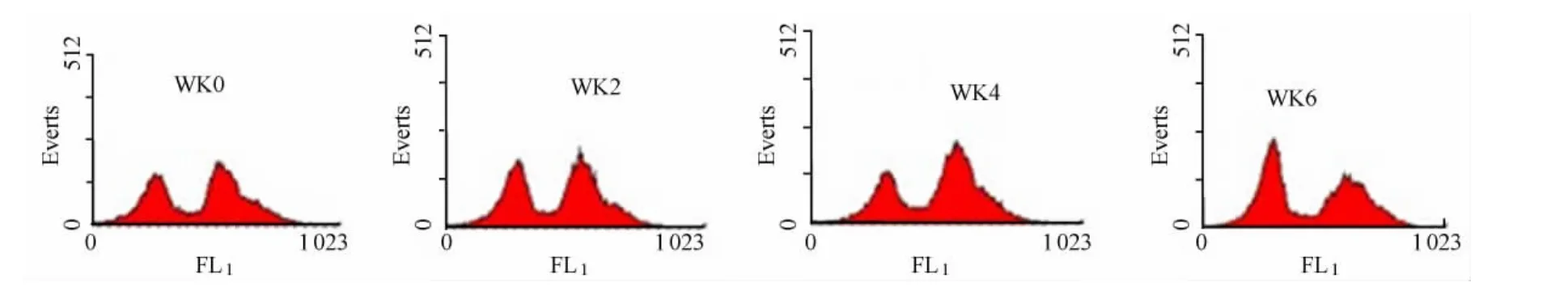
图1 本研究各组代表性JC-1检测结果示意图Figure 1. The Representative Results of JC-1in Groups
2.3 长期递增负荷运动对大鼠脾脏淋巴细胞Bax mRNA表达的影响
6周递增负荷运动过程中,Bax mRNA表达水平整体是升高的。与WK0组相比,WK2组的Bax mRNA表达升高,但没有显著性差异;WK4和 WK6组的Bax mRNA表达明显升高,且差异非常显著(P<0.01)。与 WK2相比,WK4、WK6组的Bax mRNA表达明显升高,差异非常显著(P<0.01)。与 WK4组相比,WK6组的Bax mRNA表达略有升高,但没有显著性差异(表5)。
2.4 长期递增负荷运动对大鼠脾脏淋巴细胞Bcl-2mRNA表达的影响
6周递增负荷运动过程中,Bcl-2mRNA的表达整体是降低的。与 WK0组相比,WK2组的Bcl-2mRNA表达下降,差异显著(P<0.05);WK4和 WK6组的 Bcl-2mRNA表达也明显下降,差异非常显著(P<0.01)。与 WK2组相比,WK4、WK6组的Bcl-2mRNA表达明显降低,差异非常显著(P<0.01)。与 WK4组相比,WK6组的Bcl-2mRNA表达略有下降,但没有显著性差异(表5)。
2.5 长期递增负荷运动对脾脏淋巴细胞Bcl-2/Bax的影响
6周递增负荷运动过程中,Bcl-2/Bax比值整体表现为明显降低。与 WK0组相比,WK2组的Bcl-2/Bax比值明显下降,差异显著(P<0.05);WK4和 WK6组的 Bcl-2/Bax比值也明显下降,差异非常显著(P<0.01)。与 WK2组相比,WK4、WK6组的Bcl-2/Bax明显减小,差异非常显著(P<0.05);与 WK4组相比,WK6组的 Bcl-2/Bax有所下降,但没有显著性差异(表5)。
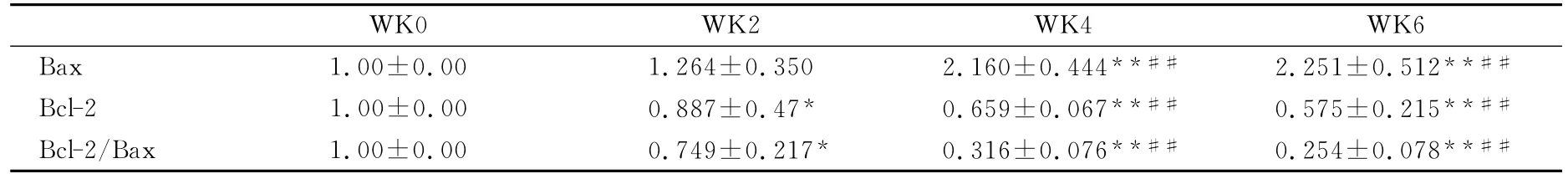
表5 本研究大鼠脾脏淋巴细胞SI的变化以及Bax和Bcl-2mRNA的变化一览表Table 5 Changes of Lymphocyte Bax mRNA and Bcl-2mRNA in Spleen
3 讨论
脾脏是体内主要的免疫器官,其重量及器官指数反映了免疫器官的发育情况,能间接的反映机体的免疫水平。本研究结果显示,6周递增负荷运动可使大鼠的脾脏系数降低,且随着运动时间的延长和强度的增加,脾脏系数下降明显。与笔者前期的研究一致[11]。另外,课题组前期的脾脏HE染色结果显示,脾脏的内部结构随着运动时间的延长、负荷的不断增加,出现了红髓、白髓、边缘区内淋巴细胞的不断减少,从第2周开始,脾小体内出现了生发中心,红髓、白髓、边缘区之间的界限也开始模糊不清[5]。提示,6周递增负荷运动不仅影响了脾脏的正常质量,也在很大程度上损伤了脾脏的结构,可能导致了脾脏的萎缩。
通过分析6周递增负荷运动对脾脏系数及脾脏结构的影响,不难发现,免疫器官脾脏对6周递增负荷运动的反应是明显的,为了进一步了解机体的免疫机能状态,本实验测定了脾脏淋巴细胞增殖活性,淋巴细胞增殖活性的测试是评价体内淋巴细胞功能状态的一个重要指标。本研究发现,6周递增负荷运动使 WK4、WK6组大鼠的脾淋巴细胞的增殖活性明显低于WK0、WK2组。说明6周递增负荷运动降低了脾淋巴细胞的增殖活性,使淋巴细胞功能下降,影响了机体的免疫水平。矫玮等[4]报道,力竭运动后T淋巴细胞转化明显降低。Green等[18,19]研究也发现,剧烈运动会降低体外T淋巴细胞的增殖应答能力。
另外,淋巴细胞凋亡增加也会影响机体的正常免疫功能。大量资料显示,力竭运动后外周血和免疫器官淋巴细胞 凋 亡 增 加 ,并 往 往 会 伴 随 免 疫 机 能 下 降[6-7,14,22]。 于 是 ,本实验对各组大鼠脾脏淋巴细胞的△Ψm进行了测定,因为线粒体既是细胞的动力工厂,又是细胞凋亡信号的提供者。△Ψm是多种细胞凋亡过程中最重要的事件之一[16,20]。本研 究 发 现,在 递 增 负 荷 运 动 过 程 中,WK2、WK4、WK6组大鼠的△Ψm明显低于0周组。提示,6周递增负荷运动降低了大鼠脾脏淋巴细胞的△Ψm,使脾脏淋巴细胞凋亡增加。说明6周递增负荷运动对脾脏淋巴细胞的增殖活性产生影响的同时也影响淋巴细胞凋亡,且随着运动时间和强度的增加,影响更加显著。
凋亡又称程序性死亡,发生的原因和途径是复杂多样的,许多基因参与细胞凋亡的基因调控。其中,Bcl-2家族是目前最受关注的调控细胞凋亡的基因家族,目前家族中人们共发现30个成员,包括抑制凋亡蛋白 Bcl-2、Bcl-x、Bcl-XL等 ,促 进 凋 亡 蛋 白 包 括 Bax、Bcl-10、Bid 等[17,24,26]。Bax接到凋亡信息后,会插入线粒体膜中,促进线粒体释放细胞色素C,激活下游因子,裂解底物,诱导细胞凋亡[23]。另外,Bax和Bcl-2的作用是相互拮抗的,当Bax同源二聚体形成,会诱导细胞凋亡;而Bcl-2表达上升时,Bax二聚体会分开,从而组织抑制凋亡的发生。本研究结果显示,随着运动负荷的递增,WK4和WK6组大鼠脾脏淋巴细胞Bax mRNA表达明显增加;而 WK2、WK4和 WK6组大鼠脾脏淋巴细胞Bcl-2mRNA表达明显降低;WK2、WK4和WK6组大鼠周脾脏淋巴细胞Bcl-2/Bax比值也明显降低。另外,课题组前期研究发现,6周递增负荷运动过程中,大鼠小肠集合淋巴结Bax蛋白表达增加,而Bcl-2蛋白表达下降,Bcl-2/Bax的比值也下降,得出大鼠小肠集合淋巴结细胞凋亡增加[8],即随着运动时间延长和强度的加大,脾脏淋巴细胞的Bcl-2/Bax比值明显减小,△Ψm也明显降低。说明6周递增负荷运动可能是通过改变调控基因Bax mRNA和Bcl-2mRNA的表达而使细胞凋亡增加的,而细胞凋亡增加可能是长时间大强度运动导致机体免疫水平下降的原因之一。
4 结论
1.大鼠脾系数变小,脾脏淋巴细胞增殖活性降低,可能是6周递增负荷运动造成机体免疫水平下降的原因之一。
2.脾脏淋巴细胞线粒体膜电位明显下降、细胞凋亡增加很可能是6周递增负荷运动造成机体免疫水平下降的另一原因。其机制可能是通过改变调控基因Bax mRNA和Bcl-2mRNA表达,而使脾淋巴细胞细胞凋亡增加,影响机体免疫水平。
3.长期递增负荷运动过程中,大鼠脾淋巴细胞凋亡的增加可能是造成淋巴细胞增殖活性降低的因素之一,但具体机理还有待于进一步研究证实。
[1]常徽,王湛,袁丽佳,等.桑葚花色苷提取物对乳腺癌细胞凋亡及线粒体膜电位的影响[J].现代生物医学进展,2012,22(12):4236-4240.
[2]邓树勋,陈佩杰,乔德才.运动生理学导论[M].北京:北京体育大学出版社,2007:112-113.
[3]耿青青.长期递增负荷运动对调控骨髓B细胞发育分化的E2A、EBF、PAX5的影响[J].体育科学,2012,32(11):76-82.
[4]矫玮,佟启良,王耐勤,等.力竭运动时阿片肽对免疫机能的作用[J].体育科学,2000,20(3):56-58.
[5]李金焕.6周递增负荷运动中大鼠胸腺和脾脏的形态结构变化特征[J].南京体育学院学报(自然科学版),2012,11(1):24-28.
[6]李靖,李皓,张蕴琨.红景天对力竭运动诱导的大鼠淋巴细胞凋亡的影响[J].中华中医药杂志,2005,20(4):240-242.
[7]林清华.免疫学实验[M].武汉:武汉大学出版社,1999:50.
[8]覃飞,郝选明.长期递增负荷运动对小肠集合淋巴结结构及淋巴细胞凋亡的影响[J].体育学刊,2012,19(1):134-138.
[9]唐亮.大鼠细胞免疫功能对六周递增负荷运动的应答性和适应性特征[D].华南师范大学硕士学位论文,2007.
[10]王雪芹.运动与免疫研究进展[J].中国运动医学杂志,2012,21(12):1137-1144.
[11]王雪芹.T细胞活性与巨噬细胞吞噬能力对长期递增负荷运动的应答和适应特征[D].华南师范大学硕士学位论文,2005.
[12]王茂叶.6周递增跑台运动对大鼠血清Th1/Th2平衡和IL-6的影响[J].体育科学,2009,10(29):46-50.
[13]张琳.运动性免疫抑制发展中T细胞的发育与调节[D].广州:华南师范大学博士学位论文,2010.
[14]张福龙.不同训练负荷后散打运动员血液淋巴细胞凋亡的研究[D].中北大学硕士学位论文,2010.
[15]朱立平,陈学清.免疫学常用实验方法[M].北京:人民军医出版社,2000:193.
[16]ADRAIN C,MARTIN S J.The mitochondrial apoptosome:a killer unleashed by the cytochrome seas[J].Trends Biochem Sci,2001,26(6):390-397.
[17]BOUILLET P,STRASSER A.BH3-only proteins-evolutionarily conserved proapoptotic Bcl-2family members essential for initiating programmed cell death[J].J Cell Sci,2002,115(Pt 8):1567-1574.
[18]GREEN K J.Improving understanding of exercise effects on in vitro T-lymphocyte function--the role of fluorescent cell division tracking[J].Exe Immunol Rev,2002,8:101-105.
[19]GREEN K J,ROWBOTTOM D G.Exercise-induced changes to in vitro T-lymphocyte mitogen responses using CFSE[J].J Appl Physiol,2003,95(1):57-63.
[20]LY J D,GRUBB D R,LAWEN A.The mitochondrial membrane potential(deltapsi(m))in apoptosis;an update[J].Apoptosis.2003,8(2):115-128.
[21]MIN B S,LEE S Y,KIM J H,et al.Anti-complement activity of constituents from the stem-bark of Juglans mandshurica[J].Biol Pharm Bull,2003,26(7):1042-1044.
[22]MOOREN F C,BL MING D,LEVHTERMANN A,et al.Lymphocyte apoptosis after exhaustive and moderate exercise[J].J Appl Physiol,2002,94(1):147-153.
[23]OLTVAI Z N,MILLIMAN C L,KORSMEYER S J.Bcl-2 heterodimerizes in vivo with a conserved homolog,Bax,that accelerates programmed cell death [J].Cell,1993,74(4):609-619.
[24]TSUKAHARA S,YAMAMOTO S,TIN-TIN-WIN-SHWE,et al.Inhalation of low-level formaldehyde increase the Bcl-2/Bax expression ratio in the hippocampus of immunologically sensitized mice[J].Neuroimmunomodulation,2006,13(2):63-68.
[25]WANG Z,TANG X,LI Y,et al.20-Hydroxyeicosatetraenoic acid inhibits the apoptotic responses in pulmonary artery smooth muscle cells[J].Eur J Pharmacol,2008,588(1):9-17.
[26]YOULE R J,SRASSER A.The BCL-2protein family:opposing activities that mediate cell death[J].Nat Rev Mol Cell Biol,2008,9(1):47-59.

