模拟氮沉降条件下木荷幼苗光合特性、生物量与C、N、P分配格局
李明月,王 健,王振兴,吴晓燕,黄儒珠,朱锦懋,*
(1.福建师范大学生命科学学院,福州 350108;2.湿润亚热带山地生态国家重点实验室培育基地,福州 350007;3.福建师范大学地理研究所,福州 350007)
植物生物量是反映植物生长和生产力的一个重要内容,植物的光合特性和体内养分含量的变化等都会影响到生物量的改变。研究表明,植物生长加快,如果根系吸收的养分元素含量未增加,就会导致叶片养分元素含量下降,叶片会出现元素的稀释效应,进而使光合速率降低,最终抑制植物生物量的增长[10-12]。因此,植物生物量的增加与体内的养分含量、光合特性有密切的联系。而植物局部特化的生物量分配格局对资源异质性的响应是植物种群克服资源环境异质性的重要途径之一[13-15]。这对于植物在异质和变化的养分环境中存活和提高竞争力至关重要。Meziane[16]及Persson等[17]认为随着氮沉降的增加,植物的最大净光合速率、叶重比升高,并进一步研究证明氮沉降促进地上部分的生长,但对根系的生长不利,根冠比降低。然而,与上述结果相反的是,有研究表明植物地上及地下部分在氮沉降处理下并没有显著性差异[18-19]。这表明植物生物量分配对氮沉降的响应策略尚无一致的认识,这是否与植物光合作用、养分含量变化密切相关目前未知。
木荷(Schima superba)是山茶科(Teaceae)的常绿乔木,是我国亚热带常绿阔叶林的主要建群种,同时还是珍贵优质阔叶用材造林树种。它具有种子量大、散布能力强、萌芽率高的特点,且幼苗喜光耐荫,适宜环境中生长较快,在群落中易占优势,因此它在亚热带常绿阔叶林恢复演替的过程中起着承上启下的作用。本文通过野外模拟试验分析氮沉降对木荷幼苗光合特性、生物量分配及不同器官C、N、P含量的影响,探讨氮沉降背景下木荷幼苗资源利用策略,为评价和预测氮沉降对木荷幼苗的影响提供科学依据,也为在氮沉降增加的背景下预期未来亚热带森林动态变化及其保护提供理论参考。
1 材料与方法
1.1 研究地自然概况
本实验在福建师范大学旗山校区实验样地(26°2'N,119°12'E)进行。该样地地势平坦,周围没有大树及高层建筑遮挡。该地区属中亚热带季风气候,年平均气温为19.5℃,年平均日照时数为1959 h,年平均降水量为2152.6 mm,降水主要集中在3—6月,尤以5—6月为多。2012年福州湿沉降中总氮沉降通量为91.06 kg N·hm-2·a-1(该数据由福建师范大学湿润亚热带山地生态国家重点实验室培育基地提供)。
1.2 实验材料和实验设计
1年生且大小相对一致(株高(25.98±2.12)cm,基茎(2.86±0.12)cm)的木荷幼苗由福建沙县金德苗木有限公司提供。样地土壤为红壤,样地土壤在移栽幼苗之前经过充分混匀,深度0.35m。移栽前土壤及幼苗根、茎、叶中碳、氮及磷含量见表1。
样地总面积为33.5 m×10.5 m,把样地分成8个样方,每个样方面积为8m×5 m。试验分4个处理,分别为CK(0 kg N hm-2·a-1)、LN(50 kg N hm-2·a-1)、MN(100 kg N hm-2·a-1)、HN(150 kg N hm-2·a-1)(以上均不包括大气沉降的氮量),每个处理由2个样方组成。为防止相互之间造成干扰,每个样方边缘用PVC板(长8 m、宽5 m、高0.6 m,不通水、不通气)镶嵌于土壤中(深度为0.35m),并且样方之间留有0.5 m宽的过道。2011年3月25日,将幼苗定植于实验地,株距30 cm,行距35 cm,每个样方移栽幼苗300株,种植密度为7.5株/m2。2011年7月木荷幼苗成活稳定后,开始实施氮沉降模拟试验。将每个样方每次所需的NH4NO3溶于5L水中(全年增加的水量相当于新增降水量3 mm),以溶液的形式向木荷幼苗全株喷施,N浓度为0、0.12、0.24、0.36 mol/L。每月月初和月中各1次,全年分成24等份平均喷施。对照处理喷洒同样数量的水。整个实验期间,幼苗在自然条件下生长。但为了实验的顺利进行,每月除草2次。连续N沉降处理9个月后,于2012年4月开始进行各项实验测定。

表1 供试土壤及幼苗移栽前的元素含量Table 1 Element contents in tested soils and seedlings before test
1.3 测定方法
1.3.1 光合作用光响应曲线的测定
于2012年4月2日到4月5日9:00—11:30用Li-6400便携式光合作用系统(LI-COR,Lincoln,Nebraska,USA)测定了光强-光响应曲线。每个样方选取2株木荷,每株选取靠近植株上部成熟健康叶测量。这样,每个处理测量4株,4个处理合计观测16株次。每天观测1次,重复观测4d。光源为LI-6400红蓝LED光源,CO2速率为380 μmol·m-2·s-1,空气流速为500 μmol·s-1,气温控制在25℃。在不同光合有效辐射通量密度(PPFD分别为:2000、1500、1000、800、500、300、150、100、50、20和0 μmol·m-2·s-1)下测定木荷的净光合速率(Pn)等光合参数。光响应曲线模型采用新型的指数方程拟合曲线[20],表达式如下:
大学士要成为宰相,必须提高品级。最简单的办法是提高大学士这一官职本身的品级。仁宗朱高炽可能顾忌到朱元璋的禁令,走了一条曲线救国的道路。他在即位之初(1424年8月),分别为杨荣、金幼孜、杨士奇、黄淮加官为太常寺卿、户部右侍郎、礼部左侍郎和通政使。这些官职都是正三品,距离正二品的尚书还有一段距离。

式中,α、β、γ为3个与光强无关的系数;P(I)为净光合速率,I为光合有效辐射(μmol·m-2·s-1),Ic为光补偿点(μmol·m-2·s-1)。通过这个方程进行拟合,计算出最大净光合速率(Pnmax)、表观量子效率(AQY)、光饱和点(LSP)、光补偿点(LCP)及暗呼吸速率(Rd)等光合参数。
1.3.2 生物量的测定
每个样方选取2株木荷,每个处理计4株,4个处理合计选取16株次进行全株收获。选取的植株用水冲洗干净,105℃杀青半小时,在80℃条件下烘干至恒重,然后测定根、茎、叶和全株的干重,并计算根重比(根干重/全株干重)、茎重比(茎干重/全株干重)、叶重比(叶干重/全株干重)和根冠比(根干重/地上部分干重)。
1.3.3 植株与土壤 C、N、P含量的测定
将生物量测定完后的木荷幼苗根、茎、叶烘干,研磨,过1mm孔径的筛。用CN元素分析仪(Elementar Vario ELⅢ,德国)来测定C、N含量。P的测定采用双酸消煮(浓硝酸和浓高氯酸)-钼锑抗比色法。
实验前后每个样方取三钻深度为15cm的土柱组成一个混合土样,每个处理两个样方共6个混合土样。烘干,研磨,过1mm孔径的筛。土壤CN的测定用元素分析仪(Elemeter MAX,德国)测定,土壤P的测定方法与植株相同。
1.4 数据处理与分析
光合参数、生物量与CNP分配数据采用统计软件SPSS 17.0分析。
2 结果分析
2.1 氮沉降对木荷光合生理的影响
图1是木荷幼苗在不同氮处理下光响应曲线,总体上各处理的光合曲线变化趋势很相似。当光照强度在0—200 μmol·m-2·s-1范围内时4种氮处理下的木荷幼苗Pn几乎呈线性增长,随着光强的增加,Pn的增长速度减慢,当光照强度达到光饱和点时Pn开始呈缓慢下降的趋势。由图1还可以看出,当光强大于300 μmol·m-2·s-1时,相对于对照处理,各氮处理的Pn均不同程度提高,其中,中氮处理的Pn最大,高氮处理次之。

图1 不同氮处理下木荷幼苗的光响应曲线Fig.1 Photosynthesis light response curves of Schima superba seedlings under different N treatments
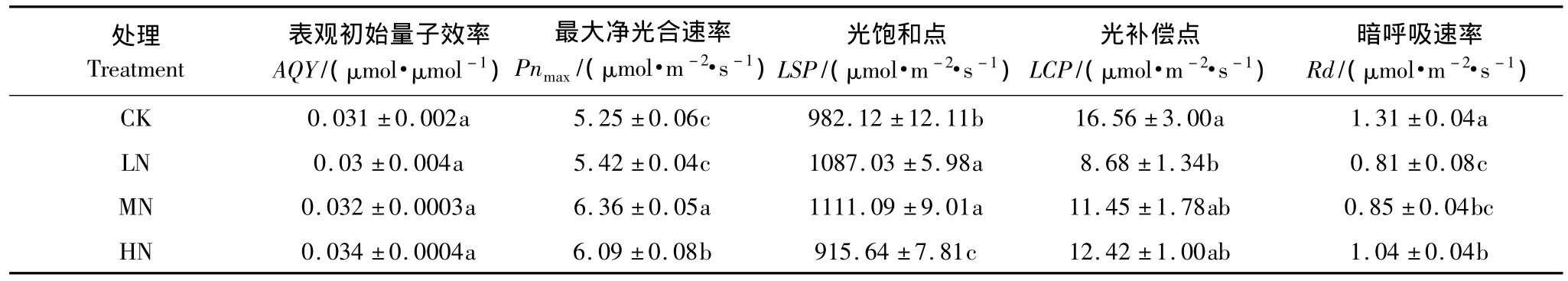
表2 不同氮处理下木荷幼苗光合特征参数Table 2 Comparison of photosynthetic parameters of Schima superba seedlings under different N treatments
表2为在不同氮处理下木荷幼苗光合特征。可以发现,随着氮沉降水平的增加,Pnmax出现先升高后降低的趋势,在中氮处理下达到最大值。与对照相比,中、高氮处理分别增加了21.1%、16%,差异极显著(P<0.01)。然而,不同氮处理条件下AQY差异不显著(P<0.05)。与对照相比,低、中氮处理的LSP分别增加了10.6%、13.1%,差异极显著(P<0.01);而高氮条件下LSP极显著低于低氮处理及中氮处理,也极显著低于对照处理(P<0.01)。LCP的变化趋势与光饱和点的变化趋势不同,在不同氮处理条件下的LCP都低于对照水平,在低氮处理下LCP显著降低(P<0.05)。不同氮处理下的Rd都低于对照,在低、中氮处理下、Rd分别降低了38.2%、35.1%,差异极显著(P <0.01);在高氮处理下,Rd 降低了20.6%,差异显著(P <0.05)。
2.2 氮沉降对生物量积累及分配的影响
表3结果表明,在不同氮处理条件下,木荷生物量积累具有不同的响应特征。与对照相比,中氮处理下总生物量增加了168.5%,差异极显著(P<0.01);高氮处理下总生物量增加了130.5%,差异显著(P<0.05)。从各器官来看,氮沉降促进了根、茎、叶生物量的增加。在中氮处理下,根的生物量比对照增加了145.6%,差异极显著(P<0.01)。氮沉降也在一定程度促进了茎生物量的增加,但是不同氮处理间茎生物量差异未达到显著水平(P<0.05)。同样,氮沉降也促进了叶生物量的增加,在中、高氮处理下叶生物量比对照增加了247.4%、228.5%,差异均极显著(P <0.01)。
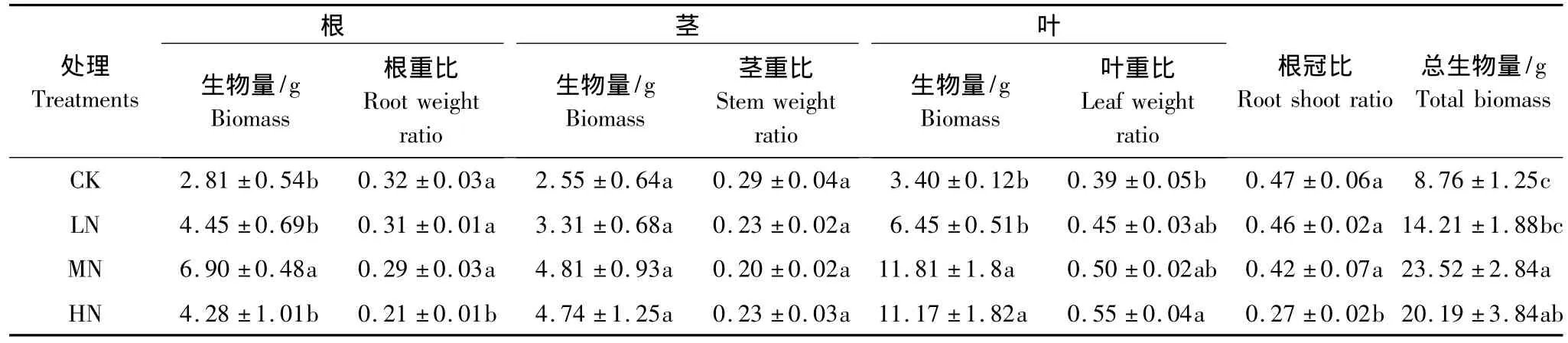
表3 不同氮处理下木荷幼苗生物量积累及其分配比较Table 3 Comparison of biomass accumulation and allocation of Schima superba seedlings under different N treatments
从表3结果可以发现,氮沉降对生物量的分配比例产生了影响。随着氮沉降量的增加,根重比出现了下降的趋势,其中在高沉降水平下,根重比显著降低(P<0.05)。不同氮处理下的茎重比都低于对照,但是不同处理间差异均未达到显著水平。随着氮沉降量的增加,叶重比出现了增加的趋势,相对于对照,高氮处理下叶重比增加了41.0%,差异显著(P<0.05)。随着氮沉降量的增加,根冠比出现降低的趋势,其中高氮处理的根冠比显著低于对照、低氮和中氮处理(P<0.05)。
2.3 氮沉降对土壤及植物不同器官C、N、P含量的影响
从表4可以看出,随着氮沉降水平的增加,土壤中C含量呈先增加后降低的趋势,在中氮处理下达最高值。在中、高氮处理下,C含量极显著增加(P<0.01)。氮沉降增加了土壤中的N含量而降低了土壤中的P含量,在中、高氮处理下N含量极显著增加(P<0.01),而土壤P含量则是中氮处理下显著降低(P<0.05),高氮处理下极显著降低(P<0.01)。

表4 不同氮处理对土壤中元素含量的影响Table 4 Effects of different N treatments on element contents in soil
图2为氮沉降处理对植物根、茎、叶中元素含量和C/N、N/P比值的影响。可以看出,除了低氮处理下的茎、叶中N含量略低于对照外,其余各器官的N含量均表现为处理大于对照。LSD检验结果表明,在高氮处理下根和茎中N含量极显著增加(P<0.01),叶中N含量显著增加(P<0.05)。
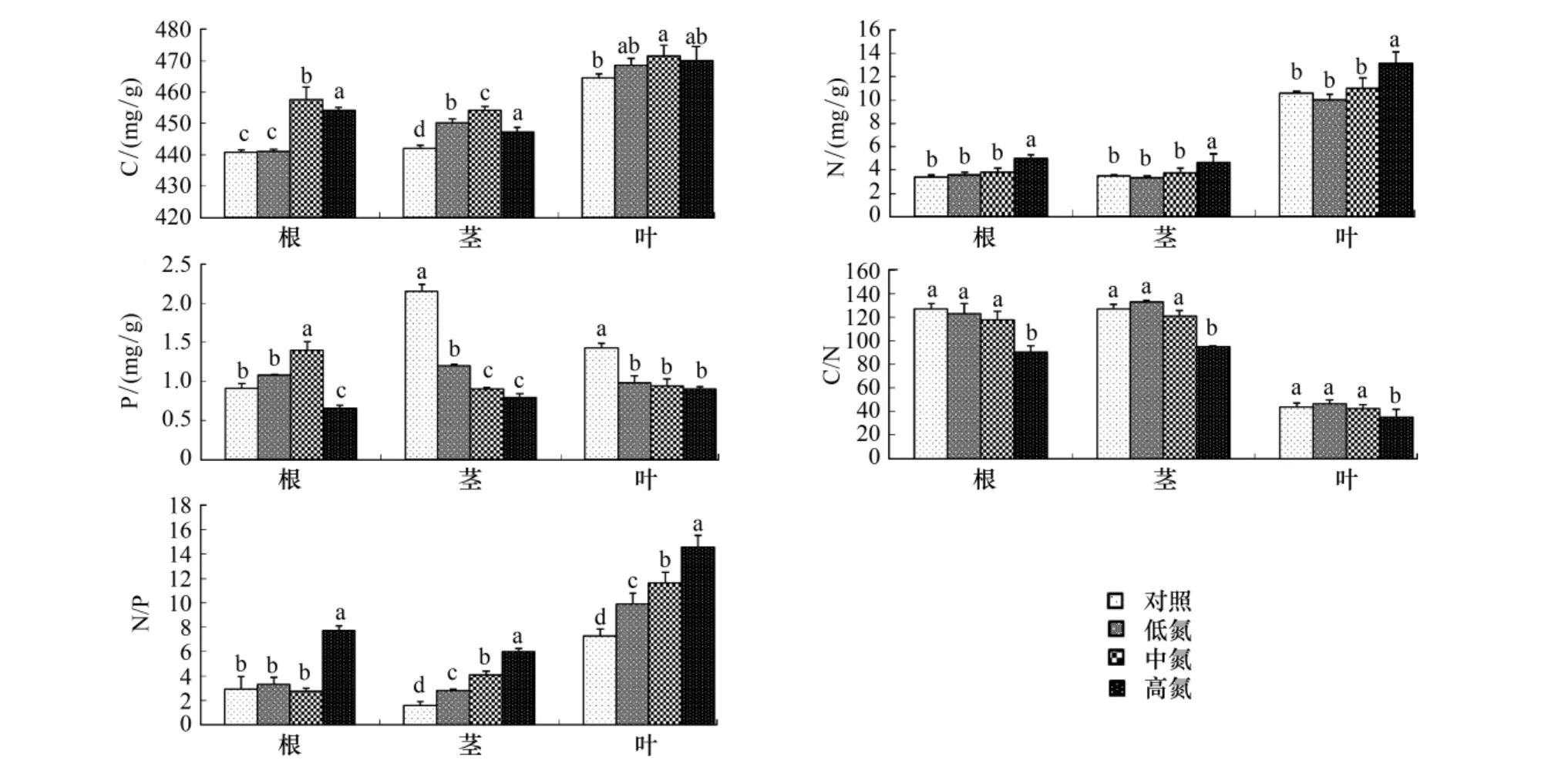
图2 不同氮处理对植物根、茎、叶中元素含量和C/N、N/P比值的影响Fig.2 Effects of different N treatments on element contents and ratio of C/N、N/P in leaves,stems and roots of Schima superba seedlings
不同器官含C量随着氮沉降水平的增加都呈先增加后降低的趋势,在中氮处理下达最大值。在中氮处理下根和茎中C含量极显著增加(P<0.01),叶中C含量显著增加(P<0.05)。在氮处理下,不同器官的P含量有不同的变化趋势(图2)。其中,根中P含量随着氮沉降量的增加呈先升高后降低的趋势,在中氮处理下极显著增加(P<0.01),高氮处理下显著降低(P<0.05)。氮处理极显著降低了茎和叶中的P含量(P<0.01)。
根中的C/N是随着氮沉降水平的增加呈降低趋势,在高氮处理下极显著降低(P<0.01)。茎和叶中C/N的变化趋势相同,都是随着氮沉降水平的增加呈先升高后降低的趋势,在低氮处理下达到最大值,在高氮处理下极显著降低(P<0.01)。同时,由图2可以看出,除了在低氮和中氮处理下根中的N/P与对照没有显著差异外,其它处理的根茎叶中N/P都显著(P<0.05)或极显著增加(P<0.01)。随着氮沉降水平的增加,叶中 N/P 从7.34 增加到14.60。
3 讨论
从本研究结果来看,氮沉降显著促进了木荷幼苗全株生物量和各部分生物量的增加。但是,随着氮沉降水平的增加,木荷全株生物量和各部分生物量都出现先升高后降低的趋势,在中氮处理下达到最大值,在高氮处理下反而下降。
为什么木荷在中氮处理下生物量最高呢?为何过量的氮会影响到植物生物量的增加呢?这些变化可能与植物的光合性能有关。由实验结果可以看出,木荷的Pnmax在中氮处理最高,在高氮处理下反而下降。而Rd是与光合作用相反的过程,它会消耗植物光合作用产生的大部分C和所固定的能量。中氮处理时木荷Pnmax最高,但是Rd却偏低。这时木荷产生的光合产物最高,而对光合产物的消耗较慢,所以物质积累量最多。而在高氮处理下,木荷Pnmax比中氮条件下低,而Rd比中氮条件下高,所以高氮处理下物质积累反而较少。LSP与LCP是反映植物对强光和弱光利用能力的指标。LCP较高、LSP较低的植物对光环境的适应性较弱;而LCP较低、LSP较高的植物对光环境的适应性较强[21]。由实验结果可知,对照条件下木荷的LCP最高,随着氮沉降水平的增加LCP呈先下降后又缓慢上升的趋势,但都低于对照,说明氮沉降提高了木荷利用弱光的能力。低氮、中氮处理显著增加了木荷的LSP,而高氮处理下LSP降低。由此可见,在低、中氮处理下木荷的LCP降低、而LSP升高,表明木荷对光能的利用范围变宽,增强了木荷对光环境的适应能力。AQY是植物光合特征的一个重要指标。AQY越大表明植物吸收与转换光能的色素蛋白复合体越多,利用弱光的能力越强[22]。实验结果表明,中、高氮处理提高了幼苗对弱光的利用能力,而且在高氮处理下的AQY最高。表2中的各个光合参数并不是独立存在的,它们之间是相互作用的,在中氮处理下虽然木荷的AQY不占优势,但是木荷通过提高Pnmax和LSP等途径改善了木荷的光合作用,使木荷在中氮处理下的光合性能得到提升。
其次生物量的这种变化也可能与植物体内的养分失衡有关。在本研究中,氮沉降引起了N在植物体内的积累,这与其它的研究结果是一致的[23-24]。除了在低氮和中氮处理下木荷根中P含量高于对照外,其它处理的各个器官的P含量均低于对照,这反映了氮沉降在一定程度上降低了木荷体内的P含量。但是安卓等[25]对长芒草(Stipa bungeana)的研究发现,随着氮素的增加,长芒草中P含量无显著变化。而樊后保等[26]通过对杉木(Cunninghamia lanceolata)幼苗进行1a的模拟氮沉降实验发现,随着氮沉降水平的提高,杉木幼苗的粗根、茎、叶中P含量呈先上升后下降的趋势。这些不同的研究结果一方面说明了氮沉降对植物养分影响的复杂性,而这种复杂性可能与研究区域条件、试验对象、氮沉降水平以及实验时间尺度等密切相关,另一方面也充分说明继续展开深入而广泛研究的必要性。植物体的C/N不仅可反映植物N的利用效率,也一定程度上反映了土壤中N的供应状况。邢雪荣等[27]认为:在营养元素供应缺乏时植物通常具有较高的养分利用效率,而在营养元素供应充足时植物的养分利用效率却较低。本研究结果表明,除了低氮处理下的茎和叶中C/N高于对照外,其余器官的C/N随氮素的增加而逐渐降低,表明氮沉降改变了土壤的N供应状况,随氮的增加,土壤中的N供应相对充足,同时也说明氮沉降使木荷的N的利用效率降低。氮沉降会引起植物体内N/P升高,其原因可能有以下几个:(1)木荷对N的奢侈吸收而引起N在体内累积。(2)氮沉降促进了土壤中铝离子的溶出,而铝离子的存在会抑制木荷对P的吸收[23]。(3)氮沉降引起土壤中的NH4+增加,而木荷对NH4+有优先吸收的特性,NH4+的存在会抑制木荷对P的吸收[28]。(4)氮沉降使土壤中的P含量减少,从而使植物所吸收的P含量降低。叶片N含量与其它元素之间的比例需要维持在一定范围之内,如N/P=6—12,超过这个范围就可能引起营养失衡[29]。而在本实验高氮处理下的木荷N/P大于12,所以在高氮处理下木荷生物量的降低有可能与养分失衡有关。
氮沉降不仅会影响到植物生物量的积累,而且也会影响生物量的分配。植物生物量分配对氮沉降的响应程度具有很大变异性。Fenn等[30]研究表明:随着氮沉降水平的增加,叶的生长增加,但是地下细根生物量分配降低。而Throop[31]的研究结果表明:氮沉降增加了豚草(Ambrosia artemisiifolia)茎和根的产量,但是根茎比却降低。然而范志强等[32]的研究表明:随着供氮水平的增加,水曲柳(Fraxinus mandshurica)幼苗地上、地下生物量都升高,但是分配到地上的生物量明显小于分配到地下的生物量,根冠比始终较高。而本实验结果表明随着氮沉降水平的增加,根重比和根冠比逐渐降低,叶重比逐渐增加,茎重比是先降低后增加。这与Persson等[17]认为氮沉降增加会促进地上部分的生长,而对地下部分的生长不利的观点一致。这同时也说明木荷幼苗通过生物量分配比例的改变来适应氮的增加。武高林等[33]认为为了缓解新生境的选择压力,拥有较宽生态幅和拓殖能力的物种具有较高的生物量分配可塑性。木荷生物量分配可塑性较高是它作为我国亚热带常绿阔叶林的主要建群种之一的原因。Grechi等[34]和Wang等[35]认为植物为了提高适应和竞争能力,会向主要的生长部位投入较多的N,而向次要部位投入较少的N。木荷在叶中投入N的比例最大,同时叶重比也最大,说明叶是木荷生长的核心。随着氮沉降水平的增加,木荷叶中N含量增加,叶重比也增大,说明了木荷叶的核心地位进一步增强,同时也说明木荷叶片中的N含量与生物量的分配表现出了一致性。
4 结论
木荷对氮沉降的响应包括形态和生理方面的变化。在形态变化方面,氮沉降促进了木荷总生物量和各部分生物量的增加。与对照相比,中氮和高氮处理下总生物量分别增加了168.5%、130.5%,差异分别达到极显著(P<0.01)和显著 (P<0.05)。随着氮沉降量的增加,根重比出现了下降的趋势,在高氮处理下,根重比显著降低(P<0.05)。与此相反,叶重比出现了增加的趋势,在高氮处理下叶重比比对照显著增加了41.0%(P<0.05)。由此可以看出,木荷幼苗叶生物量的核心地位进一步加强,针对此特点在未来氮沉降增加的条件下可以将木荷和针叶树(如马尾松、杉木)混交造林来减少木荷林的郁闭度,形成针阔叶树种多层次林分,提高生态效益。在生理方面,随着氮素的增加,木荷的Pnmax和LSP呈先升高后降低的趋势,在中氮处理下达最大值。氮沉降一定程度上降低了木荷的Rd和LCP,而对AQY的影响不显著。
氮沉降一定程度上增加了各器官的N含量,在高氮处理下根、茎、叶中N含量增加了44.7%(P<0.01)、35.1%(P<0.01)、24.8%(P<0.05)。不同器官的C含量的变化趋势都是随着氮沉降水平的增加呈先升高后降低的趋势,在中氮处理下达最大值。随着氮沉降水平的增加,根中P含量呈先升高后降低的趋势,在中氮处理下达最大值,而茎和叶中P含量在氮处理下极显著降低(P<0.01)。氮沉降一定程度上降低了木荷各器官的C/N而增加了N/P。同时,在未来氮沉降增加的条件下木荷幼苗养分管理过程中应该增加磷肥的比例,以增加木荷体内的P含量,防止木荷受到P限制和营养失衡。
[1]Reay D S,Dentener F,Smith P,Grace J,Feely R A.Global nitrogen deposition and carbon sinks.Nature Geoscience,2008,1(6):430-437.
[2]Galloway J N,Dentener F J,Capone D G,Boyer E W,Howarth R W,Seitzinger S P,Asner G P,Cleveland C C,Green P A,Holland E A,Karl D M,Michaels A F,Porter J H,Townsend A R,Vöosmarty C J.Nitrogen cycles:past,present,and future.Biogeochemistry,2004,70(2):153-226.
[3]Lamarque J F,Kiehl J T,Brasseur G P,Butler T,Cameron-Smith P,CollinsW D,Collins W J,Granier C,Hauglustaine D,Hess P G,Holland E A,Horowitz L,Lawrence M G,McKenna D,Merilees P,Prather M J,Rasch P J,Rotman D,Shindell D,Thornton P.Assessing future nitrogen deposition and carbon cycle feedback using a multimodel approach:Analysis of nitrogen deposition.Journal of Geophysical Research,2005,110(D19):DOI:10.1029/2005JD005825.
[4]Dentener F,Drevet J,Lamarque J F,Bey I,Eickhout B,Fiore A M,Hauglustaine D,Horowitz L W,Krol M,Kulshrestha U C,Lawrence M,Galy-Lacaux C,Rast S,Shindell D,Stevenson D,Van Noije T,Atherton C,Bell N,Bergman D,Butler T,Cofala J,Collins B,Doherty R,Ellingsen K,Galloway J,Gauss M,Montanaro V,Müller J F,Pitari G,Rodriguez J,Sanderson M,Solmon F,Strahan S,Schultz M,Sudo K,Szopa S,Wild O.Nitrogen and sulfur deposition on regional and global scales:a multimodel evaluation.Global Biogeochemical Cycles,2006,20(4):DOI:10.1029/2005GB002672.
[5]Townsend A R,Braswell B H,Holland E A,Penner J E.Spatial and temporal patterns in terrestrial carbon storage due to deposition of fossil fuel nitrogen.Ecological Applications,1996,6(3):806-814.
[6]Galloway J N,Cowling E B.Reactive nitrogen and the world:200 years of change.Ambio,2002,31(2):64-71.
[7]Zhou G Y,Yan J H.The influences of regional atmospheric precipitation characteristics and its element inputs on the existence and development of Dinghushan forest ecosystems.Acta Ecologica Sinica,2001,21(12):2002-2012.
[8]Xue J H,Mo J M,Li J,Wang H.Effects of nitrogen deposition on soil microorganism.Ecology and Environment,2005,l4(5):777-782.
[9]Galloway J N,Levy II H,Kasibhatla P S.Year 2020:Consequences of population growth and development on deposition of oxidized nitrogen.Ambio,1994,23(2):120-123.
[10]Reich P B,Hobbie S E,Lee T,Ellsworth D S,West J B,Tilman D,Knops J M H,Naeem S,Trost J.Nitrogen limitation constrains sustainability of ecosystem response to CO2.Nature,2006,440(4):922-925.
[11]Yamakawa Y,Saigusa M,Okada M,Kobayashi K.Nutrient uptake by rice and soil solution composition under atmospheric CO2enrichment.Plant and Soil,2004,259(1/2):367-372.
[12]Zhang S R,Dang Q L,Yü X G.Nutrient and[CO2]elevation had synergistic effects on biomass production but not on biomass allocation of white birch seedlings.Forest Ecology and Management,2006,234(1/3):238-244.
[13]Bazzaz F A,Grace J.Plant resource allocation.New York:Academic Press,1997.
[14]Weiner J.Allocation,plasticity and allometry in plants.Perspectives in Plant Ecology,Evolution and Systematics,2004,6(4):207-215.
[15]Zhang D Y.Plant life-history evolution and reproductive ecology.Beijing:Science Press,2004.
[16]Meziane D,Shipley B.Interacting components of interspecific relative growth rate:constancy and change under differing conditions of light and nutrient supply.Functional Ecology,1999,13(5):611-622.
[17]Persson H,Ahlström K,Clemensson-Lindell A.Nitrogen addition and removal at Gårdsjön-effects on fine-root growth and fine-root chemistry.Forest Ecology and Management,1998,101(1/3):199-205.
[18]Spinnler D,Egli P,Körner C.Four-year growth dynamics of beech-spruce model ecosystems under CO2enrichment on two different forest soils.Trees,2002,16(6):423-436.
[19]Johansson M.The influence of ammonium nitrate on the root growth and ericoid mycorrhizal colonization of Calluna vulgaris(L.)Hull from a Danish heathland.Oecologia,2000,123(3):418-424.
[20]Ye Z P.A new model for relationship between irradiance and the rate of photosynthesis in oryza sativa.Photosynthetica,2007,45(4):637-640.
[21]Yang X H,Zou Q,Zhao S J.Photosynthetic characteristics and chlorophyll fluorescence in leaves of cotton plants grown in full light and 40%sunlight.Journal of Plant Ecology,2005,29(1):8-15.
[22]Xu D Q.Photosynthetic efficiency.Shanghai:Shanghai Science and Technology Press,2006.
[23]Nakaji T,Takenaga S,Kuroha M,Izuta T.Photosynthetic response of Pinus densiflora seedlings to high nitrogen load.Environmental Science,2002,9(4):269-282.
[24]Li D J,Mo J M,Peng S L,Fang Y T.Effects of simulated nitrogen deposition on elemental concentrations of Schima superba and Cryptocarya concinna seedlings in subtropical China.Acta Ecologica Sinica,2005,25(9):2165-2172.
[25]An Z,Niu D C,Wen H Y,Yang Y,Zhang H R,Fu H.Effects of N addition on nutrient resorption efficiency and C ∶N∶P stoichiometric characteristics in Stipa bungeana of steppe grasslands in the Loess Plateau,China.Journal of Plant Ecology,2011,35(8):801-807.
[26]Fan H B,Liao Y C,Liu W F,Yuan Y H,Li Y Y,Huang R Z.Effects of simulated nitrogen deposition on nutrient balance of Chinese fir(Cunninghamia lanceolata)seedlings.Acta Ecologica Sinica,2011,31(12):3277-3284.
[27]Xing X R,Han X G,Chen L Z.A review on research of plant nutrient use efficiency.Journal of Applied Ecology,2000,11(5):785-790.
[28]Schulze E D.Air pollution and forest decline in a spruce(Picea abies)forest.Science,1989,244(4906):776-783.
[29]Hüttl R F.Nutrient supply and fertilizer experiments in view of N saturation.Plant and Soil,1990,128(1):45-58.
[30]Fenn M E,Baron J S,Allen E B,Rueth H M,Nydick K R,Geiser L,Bowman W D,Sickman J O,Meixner T,Johnson D W,Neitlich P.Ecological effects of nitrogen deposition in the western United States.Biological Science,2003,53(4):404-420.
[31]Throop H L.Nitrogen deposition and herbivory affect biomass production and allocation in an annual plant.Oikos,2005,111(1):91-100.
[32]Fan Z Q,Wang Z Q,Wu C,Li H X.Effect of different nitrogen supply on Fraxinus mandshurica seedling's biomass,N partitioning and their seasonal variation.Journal of Applied Ecology,2004,15(9):1497-1501.
[33]Wu G L,Chen M,Du G Z.Response of biomass allocation and morphological characteristics to light and nutrient resources for seedlings of three alpine species.Acta Ecologica Sinica,2010,30(1):0060-0066.
[34]Grechi I,Vivin P,Hilbert G,Milin S,Robert T,Gaudillère J P.Effect of light and nitrogen supply on internal C∶N balance and control of root-toshoot biomass allocation in grapevine.Environmental and Experimental Botany,2007,59(2):139-149.
[35]Wang G G,Bauerle W L,Mudder B T.Effects of light acclimation on the photosynthesis,growth and biomass allocation in American chestnut(Castanea dentata)seedlings.Forest Ecology and Management,2006,226(1/3):173-180.
参考文献:
[7]周国逸,闫俊华.鼎湖山区域大气降水特征和物质元素输入对森林生态系统存在和发育的影响.生态学报,2001,21(12):2002-2012.
[8]薛璟花,莫江明,李炯,王晖.氮沉降增加对土壤微生物的影响.生态环境,2005,14(5):777-782.
[15]张大勇.植物生活史进化与繁殖生态学.北京:科学出版社,2004.
[21]杨兴洪,邹琦,赵世杰.遮荫和全光下生长的棉花光合作用和叶绿素荧光特征.植物生态学报,2005,29(1):8-15.
[22]许大全.光合作用效率.上海:上海科学技术出版社,2006.
[24]李德军,莫江明,彭少麟,方运霆.南亚热带森林两种优势树种幼苗的元素含量对模拟氮沉降增加的响应.生态学报,2005,25(9):2165-2172.
[25]安卓,牛得草,文海燕,杨益,张洪荣,傅华.氮素添加对黄土高原典型草原长芒草氮磷重吸收率及C∶N∶P化学计量特征的影响.植物生态学报,2011,35(8):801-807.
[26]樊后保,廖迎春,刘文飞,袁颖红,李燕燕,黄荣珍.模拟氮沉降对杉木幼苗养分平衡的影响.生态学报,2011,31(12):3277-3284.
[27]邢雪荣,韩兴国,陈灵芝.植物养分利用效率研究综述.应用生态学报,2000,11(5):785-790.
[32]范志强,王政权,吴楚,李红心.不同供氮水平对水曲柳苗木生物量、氮分配及其季节变化的影响.应用生态学报,2004,15(9):1497-1501.
[33]武高林,陈敏,杜国祯.三种高寒植物幼苗生物量分配及性状特征对光照和养分的响应.生态学报,2010,30(1):0060-0066.

