原花青素与戊二醛共交联心脏瓣膜的相容性
马旭兵,翟万银,张嘉敏,朱自严,张红锋,常 江
(1.华东师范大学 生命科学学院,上海 200062;2.中国科学研究院 上海市硅酸盐研究所高性能与超微结构国家重点实验室,上海 200050;3.上海市血液中心,上海 200051)
0 引 言
心脏瓣膜病是一种致命的严重疾病,自20世纪60年代临床上采用戊二醛(Glutaraldehyde,GA)交联制备的生物瓣作置换手术以来,已成功挽救或延长了数以百万计的患者生命[1,2].该方法制备的生物瓣具有供体来源丰富、方法简单、免疫原性较低、中心血流通畅、不需终身服用抗凝剂等优点[1,2],但仍存在严重的缺点,如钙化和GA缓慢释放所产生的细胞毒性[1,2]等,限制了其体内使用寿命和进一步的临床应用[2].目前研究集中于新交联剂或GA交联改性的探索,如采用京尼平[3]、槲皮素[4]和碳二亚胺[5]等新型交联剂或采用铝离子[2]、单宁酸[6]和钛纳米涂层[7]等改进的GA交联方法等处理心脏瓣膜,可部分改善生物瓣膜的性能,但至今尚未见到相关的临床应用研究.
近年来,我们发现原花青素(Procyanidins,PC)可通过氢键交联瓣膜细胞外基质,可有效抑制其钙化和提高稳定性[8,9].此外,PC本身还具有多种生物活性,如抗菌、抗血栓和抑制免疫原性等[10-13],因而有可能较好地改进GA交联瓣膜的缺陷.本研究采用PC与GA共交联猪主动脉脱细胞瓣膜材料,评价了该材料的细胞相容性、血液相容性以及免疫原性,以期在保留GA交联的优良性能的基础上,消除或改进其缺陷.
1 材料与方法
1.1 脱细胞猪心脏瓣膜制备
新鲜猪心脏取自上海复新屠宰场,放置于冰袋中运输至实验室.无菌条件下剪取主动脉瓣瓣叶,4℃下无钙、镁平衡盐溶液(D-Hanks液)充分清洗,按照文献报道方法脱除瓣膜细胞成分[8],再经充分清洗制备成脱细胞猪心脏瓣膜材料备用.
1.2 瓣膜间质细胞的分离与培养
瓣膜间质细胞(Heart valve interstitial cells,HVICs)按照文献报道方法分离培养[14].新鲜猪主动脉瓣膜经D-Hanks液充分洗涤后剪成约1mm3小块,加入用D-Hanks液配制的0.25%胰蛋白酶(Sigma,USA)5mL,37℃恒温消化5min,取出以D-Hanks液清洗,去除内皮细胞,再加入1.5mg/mL的Ⅱ型胶原酶(Sigma,USA,D-Hanks液配制)5mL,37℃消化1h即得到含有原代HVICs的细胞悬液.经离心(Jouan A14,France)、清洗5次,所得原代HVICs加入含20%胎牛血清(四季青)及100U/mL双抗的DMEM(Dulbecco’s Modified Eagle’s Medium,Gibco,USA)培养液,于37℃、5%CO2饱和湿度培养箱(MEMMERT,France)中培养.细胞贴壁生长至90%培养皿底面时传代培养,第3~5代的HVICs用于本研究实验.
1.3 交联剂配比的确定
由于瓣膜共交联后两种交联剂可能同时以低浓度缓慢释放,所以本研究将GA临床常用浓度(6.25mg/mL)与PC有效交联浓度(10mg/mL)以PC/GA分别为80∶20、60∶40、50∶50、40∶60和20∶80的不同配比混合后,稀释至50倍,作用于HVICs,观察不同配比混合交联剂对细胞增殖的抑制率.选择对细胞增殖抑制率最低的配比作为共交联方法中两种交联剂的最优配比.将HVICs以5×103细胞/孔接种于96孔板中培养过夜,培养液换为含有不同配比的混合交联剂的新鲜培养液,以不含交联剂的细胞培养液作空白对照,继续培养72h.用MTT法检测各实验组对HVICs的增殖抑制.细胞增殖率(Relative viability of HVICs)计算公式为:细胞增殖率%=(实验组OD值/空白对照组OD值)×100%.
1.4 脱细胞心脏瓣膜的交联制备
将瓣膜材料随机分为4组:a)不交联组(Control);b)以6.25mg/mL GA交联组(GA6);c)以10mg/mL PC交联组(PC10);d)以采用1.3所述方法选定的混合配比的共交联组,即8mg/mL PC与1.25mg/mL GA共交联组(P8G1).所有交联液均用pH 7.4的D-Hanks液配制,交联过程均在37℃、120r/min的摇床中完成.b)和c)组分别采用6.25 mg/mL GA溶液和10mg/mL PC溶液交联48h.d)组采用8mg/mL PC溶液交联4h后,再用1.25mg/mL GA溶液继续交联至48h.交联的各组瓣膜材料充分洗涤后以4℃的DHanks液保存备用.上述各组每组6个脱细胞瓣膜叶片.将未交联和交联后的脱细胞猪心脏瓣膜材料铺展在蓝色纸上,用数码相机拍摄瓣膜材料的宏观形态.
1.5 细胞相容性评价
采用瓣膜材料表面种植HVICs、计算细胞粘附率以评价交联瓣膜的细胞相容性.交联瓣膜各组样品(n=4)材料剪成直径为10mm的圆片,瓣膜材料褶皱多的一面向上放置于48孔板中.培养液将HVICs稀释成104细胞/mL细胞悬液,每孔加细胞悬液100μL,培养16h.取出瓣膜材料用D-Hanks液漂洗3遍,洗去未粘附细胞,经固定、梯度酒精脱水、干燥后,300倍下扫描电镜观察、每个样品任选4个视野拍照用于粘附细胞计数,以实验组4个视野平均粘附细胞数相对于不交联组的细胞数作为细胞相对粘附率(Relative adhesion).相对粘附率按下式计算:
相对粘附率%=(各交联组平均粘附细胞数/对照组平均粘附细胞数)×100%.
1.6 扫描电子显微镜(SEM)观察
将样品浸泡在浓度为2.5%戊二醛的D-Hanks溶液中固定4h.此后用D-Hanks溶液洗涤3次,然后依次浸泡于一系列梯度浓度的乙醇溶液中(乙醇的体积分数分别为30%,50%,70%,90%,95%和100%),每个浓度10min,使之脱水.接着将样品浸入体积分数为50%的六甲基二硅胺烷(HMDS)—乙醇溶液中干燥10min,然后放入纯的HMDS中干燥10min,最后放入通风橱中通风挥发干燥过夜,干燥样品喷金用于电镜观察.
1.7 溶血实验
新鲜抗凝血液(上海市血液中心提供)以2 000r/min离心10min,弃掉上清,沉淀用DHanks液重悬清洗3次,最后用D-Hanks液按1∶10稀释后备用.取稀释后的血液300μL分别加入:ⓐ1 200μL超纯水(阳性对照);ⓑ1 200μL无菌D-Hanks液(阴性对照);ⓒ—ⓕ各材料组1 200μL悬液,即分别含不交联组瓣膜材料和GA6,P8G1和PC10交联组瓣膜材料碎末(<1mm3)的D-Hanks液配制的悬液.轻轻混匀,室温放置2h后4 000r/min离心2min,使用数码相机拍摄各实验组的溶血状况照片;取离心后各组上清用酶联免疫检测仪(ELX800,BIO-TEK,USA)于541nm下测定其吸光度.按下式计算样品的溶血率(Hemolysis Rate):
溶血率%=[(样品OD值-阴性OD值)/(阳性OD值-阴性OD值)]×100%.
1.8 血小板粘附
脱细胞交联瓣膜各组样品(n=4)材料剪成直径为10mm的圆片,皱褶多的一面向上放置于48孔板中,每孔加入200μL血小板(106血小板/mL,上海市血液中心提供)孵育1h.弃掉孵育后的血小板溶液,SEM观察瓣膜材料表面血小板粘附状况,放大2 000倍下每样品随机选取4个视野拍照,用于粘附的血小板计数,取平均值后用于表征瓣膜材料的抗血栓形成能力.血小板粘附数量越多表示材料形成血栓的可能性越大;反之,粘附数量越少则表示材料的抗血栓能力越强.
1.9 单核巨噬细胞的粘附
THP-1细胞是人急性白血病单核细胞株(human acute monocytic leukemia cell lines,上海市血液中心提供),经佛波酯(phorbol 12-myristate 13-acetate,PMA)诱导分化可形成具有贴附生长能力的巨噬细胞,其对材料的粘附可以表征此材料的免疫原性[15,16].THP-1以106细胞/mL培养于12孔板中,RPMI-1640培养液中加入诱导剂100ng/mL的PMA培养48h,使之诱导分化为巨噬细胞.D-Hanks液洗去未贴壁细胞,收集巨噬细胞并用培养液稀释成106细胞/mL.各组瓣膜材料样品(n=4)剪成直径为10mm的圆片,皱褶多的一面向上放置于48孔板中,每孔接种200μL稀释后巨噬细胞悬液,培养16h后D-Hanks液洗去未粘附细胞,瓣膜材料经固定、脱水、干燥后,SEM观察巨噬细胞粘附状况.另取200倍下SEM照片作如1.8所述计数、计算粘附率.巨噬细胞粘附率越高表示材料潜在的免疫原性越高;反之,粘附率越低则表示材料潜在的免疫原性越低.粘附率(Cell adhesion)按下式计算:
粘附率%=(各交联组平均粘附细胞数/对照组平均粘附细胞数)×100%.
1.10 统计分析
所有实验数据用Student t-test分析软件统计分析,分析结果用平均数(mean)±标准差(SD)表示.统计学方法采用t检验检测组间差异,p<0.05表示组间有显著性差异,p<0.01表示组间有极显著差异.
2 实验结果
2.1 共交联剂配比及交联浓度的确定
如图1所示,不同混合比例配制的两种交联剂混合液对细胞的增殖抑制作用随着GA比例的减少和PC比例的增加而降低.当PC和GA浓度以160μg/mL和25μg/mL混合时,即混合比例为80∶20时,对细胞增殖的抑制作用最小.因此,本研究采用此对细胞增殖抑制最小的交联剂浓度配比,再结合GA临床常用交联浓度6.25mg/mL和PC有效交联浓度10mg/mL,确定后续共交联方法中PC与GA分别以8mg/mL和1.25mg/mL的浓度交联瓣膜材料.为叙述简洁,该共交联方法标记为P8G1.

图1 相同稀释比例的各共交联液对于HVICs增殖情况的影响Fig.1 Cell viability of HVICs cultured in co-crosslinking reagents with same dilution ratio
2.2 脱细胞及交联的心脏瓣膜形貌
脱细胞瓣膜经交联后,不交联(control)、6.25mg/mL GA交联(GA6)、共交联(P8G1)以及10mg/mL PC(PC10)交联瓣膜的宏观形貌如图2中上图所示.脱细胞未交联瓣膜呈白色半透明状,基本保持正常形态结构,稍有收缩.GA6交联瓣膜颜色呈淡黄色,形态轻度皱缩、僵硬.与其相比,P8G1与PC10交联瓣膜因PC(PC溶液呈褐色)参与交联而呈淡褐色和深褐色,形态柔软无明显皱缩.由于PC本身颜色呈褐红色,P8G1与PC10交联瓣膜因PC含量影响而呈淡褐红色和深褐红色,有少量褶皱,显示所交联的瓣膜柔软,无明显收缩.图2中下图所示为各组瓣膜的微观形貌,显示各组瓣膜基质纤维完整、无明显断裂.其中脱细胞不交联组及P8G1与PC10组纤维完整较松软,而GA6组则明显紧密,可能是GA6组宏观形貌较僵硬的原因.

图2 交联的脱细胞瓣膜宏观照片(上)和微观形貌SEM图(下)Fig.2 The photos(above)and SEM images(below)of crosslinked AHVM
2.3 细胞相容性
采用瓣膜表面种植HVICs来评价交联瓣膜材料的细胞相容性.从图3A可以看出,对照组粘附细胞数量较多,形态伸展呈梭形或多边形,有较多伪足.而GA6交联瓣膜材料只有少量细胞粘附,且有部分细胞已破裂.P8G1和PC10交联瓣膜材料表面粘附细胞数量相当,且形态均呈圆形或刚伸出伪足.细胞计数统计结果(见图3B)显示:与对照组(100%)相比,GA6交联瓣膜材料粘附的细胞量仅为(19.75±3.27)%;P8G1和PC10交联瓣膜材料的粘附量分别为(78.75±8.7)%、(98.21±4.42)%.这一结果说明P8G1交联瓣膜材料的细胞相容性介于GA6交联瓣膜材料与PC10交联瓣膜材料之间,且极显著高于GA6.

图3 各交联组瓣膜材料表面粘附HVICs的SEM照片(A)和相对粘附率(B)Fig.3 SEM images(A)and relative adhesion of(B)HVICs on crosslinked AHVM
2.4 溶血
如图4右上角插图所示,正常(阴性对照)无溶血现象,血液离心后红细胞沉降与EP管底部,上清液中没有血红素,而阳性对照由于红细胞破裂,大量血红素溶解于上清液中.与阳性对照组相比,各实验组瓣膜材料上清液中几乎没有血红素,无明显的溶血发生.溶血实验的定量结果显示:各实验组的溶血率均极显著的低于阳性对照组(纯水).Control、GA6、P8G1和PC10各组交联瓣膜材料的溶血率分别为(0.36±0.116)%、(0.42±0.3)%、(0.75±0.36)%、(0.72±0.58)%,均远低于国际标准ISO 10993-4:2002所规定的血液相容性标准最大溶血率5%[17].虽然与GA6相比,P8G1和PC10交联瓣膜材料的溶血率略有上升,但是并不存在统计学差异.
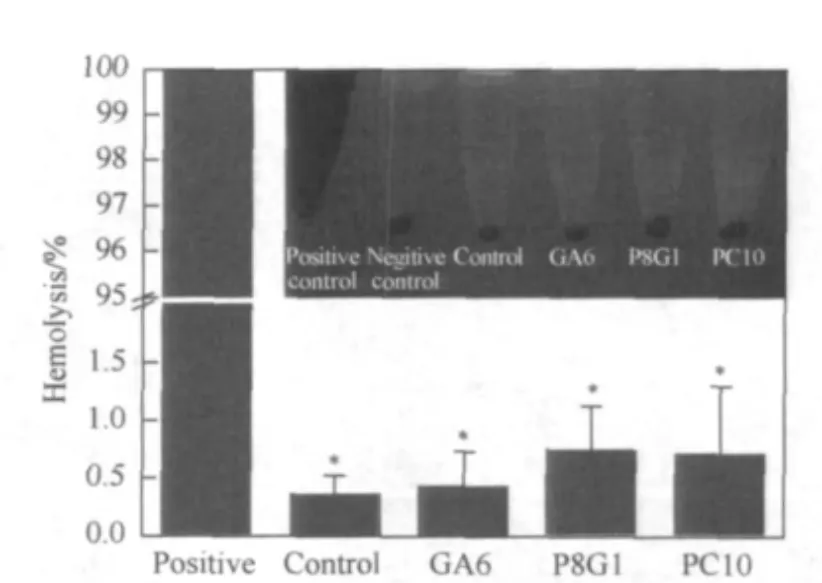
图4 各交联组瓣膜材料的溶血率Fig.4 Hemolysis rates of AHVM
2.5 血小板粘附
图5A所示为血小板粘附于各实验组瓣膜材料表面的扫描电镜照片.如图,大量血小板粘附于GA6交联瓣膜材料表面,而P8G1和PC10交联瓣膜材料表面仅粘附少量血小板.如图5B,对粘附血小板计数统计进一步验证了这一结果:PC10交联瓣膜材料的血小板粘附数量与对照组和GA6交联瓣膜均存在显著性差异(p<0.05).P8G1交联组瓣膜材料粘附的血小板数量与对照组相当,但显著低于GA6交联瓣膜(p<0.05).
2.6 免疫原性评价
瓣膜的免疫原性取决于瓣膜残留的免疫表位的多少,免疫表位越多越有利于巨噬细胞粘附,因此瓣膜单位面积粘附的巨噬细胞数量能够反映瓣膜免疫原性的强弱.图6A所示为巨噬细胞粘附于各交联瓣膜材料的扫描电镜图.如图所示,Control和GA6交联瓣膜材料表面粘附的巨噬细胞粘附数量相当,但是细胞形态差异明显:对照组粘附细胞形态开始伸展有少量伪足,GA6组粘附细胞形态未伸展呈圆形.与GA6相比,粘附于P8G1与PC10交联瓣膜材料表面的巨噬细胞数量明显减少.图6B的粘附率结果显示:4组瓣膜材料均可粘附一定数量的巨噬细胞,其中PC10交联瓣膜材料粘附率较低,虽然P8G1粘附率较PC10交联瓣膜高,但是显著低于GA6交联瓣膜材料.

图5 各交联组瓣膜材料表面血小板粘附SEM照片(A)和粘附量(B)Fig.5 SEM images(A)and number(B)of platelet adhesion for crosslinked AHVM
3 讨 论
GA是目前较常用的交联剂,广泛应用于生物瓣交联制备[1].20世纪80年代发现,GA可与胶原蛋白分子的N末端氨基、ε-氨基和羟基等反应形成共价键,使胶原蛋白分子间形成网状交联[1].与GA交联方式不同,PC主要通过其酚羟基与胶原蛋白中羟脯氨酸羟基、ε-氨基和酰胺羰基等基团形成氢键交联[8].本研究中通过这两种机理不同的交联剂共交联处理的生物瓣,在保留了GA交联的一些优良性能的基础上,克服了GA交联引起的几项缺点.
低毒性为理想生物瓣所必须[2].GA的游离醛基具有较强的细胞毒性,GA作为交联剂因其在交联的材料中可以缓慢释放,因而可引起一定的细胞毒性[1].共交联P8G1组瓣膜显示无收缩,较柔软,其所带褐红色为PC本身颜色,而PC是一种广泛存在于各种食物中,具有多种生物活性的黄酮类化合物[8].研究表明,PC的毒性远低于GA,仅为相同浓度GA的1%[8].本研究采用PC与GA共交联的方法即瓣膜先经8mg/mL PC交联,再经1.25mg/mL GA交联的方法,降低了GA的使用量(为GA单独交联浓度的1/5)从而减弱了交联后的释放量,降低了细胞毒性.相同稀释比例的共交联液对细胞的增殖抑制率(55%)远低于GA(82%).细胞相容性实验中,与对照组粘附细胞形态伸展、伸出伪足相比,共交联瓣膜材料表面粘附细胞虽然铺展较慢,仅部分伸出少量伪足,但细胞没有破裂,形态明显好于GA6交联组.此外共交联瓣膜材料表面粘附的相对细胞量(78%)约为GA单独交联(19%)的4倍,显示共交联瓣膜的细胞相容性远高于GA单独交联的瓣膜,具有较好的细胞相容性.

图6 各交联组瓣膜材料表面粘附的巨噬细胞SEM照片(A)与粘附率(B)Fig.6 SEM images(A)and cell adhesion rate(B)of immunogenicity evaluation for crosslinked AHVM
生物瓣植入体内后与血液直接接触,因此血液相容性是衡量生物瓣材料能否临床应用的重要指标之一[2].溶血试验是血液相容性评价的经典实验方法,也是血液相容性评价方法中的唯一国家标准所采用的方法,主要是检测瓣膜材料对血液中红细胞的溶血作用[18].当血液相容性差的物质与血液中的红细胞接触后,会引起红细胞膜破裂,释放出细胞内的血红蛋白,发生溶血.通过测定某物质引起的血红蛋白释放量,可以表征该物质的溶血率.血液相容性较好的材料应具有较低的溶血率.本研究中,共交联瓣膜材料几乎没有溶血现象发生,溶血率仅为0.7%,与GA交联组相当,都远低于国际标准ISO 10993-4:2002所规定的血液相容性标准所允许的5%[17],符合医用生物瓣的要求.
血小板粘附性能实验是研究生物瓣血液相容性的重要内容之一,因为血小板粘附、聚集是材料表面血栓形成过程中重要的一步[3].有研究报道PC可以减少血小板聚集,进而抑制血栓形成[12],其作用机制可能与PC的强抗氧化性能有关.本研究血小板粘附实验结果中,PC交联瓣膜单位面积粘附的血小板数量(95个)远小于GA交联瓣膜(293个),显示PC单独交联瓣膜可以有效减少血小板粘附,从而抑制血栓形成,具有较强的抗血栓形成的潜能.共交联瓣膜由于PC的前交联处理,血小板粘附量(193个)介于PC交联瓣膜与GA交联瓣膜之间,同样具备抗血栓形成的潜能.虽然共交联瓣膜抗血栓形成的能力不及PC单独交联瓣膜,但是却明显高于GA单独交联瓣膜.本研究从溶血和血栓形成两个方面证明了共交联瓣膜具有较好的血液相容性.
理想生物瓣必须在植入人体后不能引起明显的免疫排斥反应[2].研究发现,脱细胞处理瓣膜可去除引起免疫排斥反应的细胞成分,可有效地降低瓣膜的免疫原性[19].有文献报道GA可以掩盖相关抗原,进而降低GA交联生物瓣的免疫原性[1,20].但是,2003年Simon等[21]发现GA交联的脱细胞生物瓣给儿科四例患者置换后,有三位因异体脱细胞瓣膜存在免疫反应,并在术后一年内死亡.看来脱细胞和GA交联还不足以完全消除免疫原性的隐患.因此,进一步降低或消除脱细胞生物瓣的免疫原性显得尤为重要.本研究中共交联瓣膜的巨噬细胞粘附率显著低于GA交联的瓣膜,表明其潜在免疫原性低于GA单独交联.这可能是由于具有抑制免疫原性的PC[13]的加入而实现的优良效果.
4 结 论
综上所述,PC与GA共交联的猪脱细胞心脏瓣膜材料细胞相容性远高于GA单独交联的瓣膜材料,具有较低的细胞毒性.该共交联瓣膜材料不引起溶血,具有一定的抗血栓形成潜能,显示了良好的血液相容性.同时与GA交联效果相比,共交联瓣膜材料的免疫原性也显著降低.可见,PC与GA共交联作为制备人工生物瓣膜材料的新方法,很有可能应用于临床瓣膜置换术的生物瓣制备.
[1]JAYAKRISHNAN A,JAMEELA S R.Glutaraldehyde as a fixative in bioprostheses and drug delivery matrices[J].Biomaterials,1996,17:471-484.
[2]SCHOEN F J,LEVY R J.Tissue heart valves:Current challenges and future research perspectives[J].J Biomed Mater Res,1999,47:439-465.
[3]CHANG Y,HSU C K,WEI H J,et al.Cell-free xenogenic vascular grafts fixed with glutaraldehyde or genipin:In vitro and in vivo studies[J].J Biotechnol,2005,120:207-219.
[4]ZHAI W,L X,CHANG J,et al.Quercetin-crosslinked porcine heart valve matrix:Mechanical properties,stability,anticalcification and cytocompatibility[J].Acta Biomater,2010(6):389-395.
[5]SCHMIDT C E,BAIER J M.Acellular vascular tissues:Natural biomaterials for tissue repair and tissue engineering[J].Biomaterials,2000,21:2215-2231.
[6]ISENBURG J C,SIMIONESCU D T,VYAVAHARE N R.Tannic acid treatment enhances biostability and reduces calcification of glutaraldehyde fixed aortic wall[J].Biomaterials,2005,26:1237-1245.
[7]NORBERT W G,HANGORG Z,HANS H S.Nano-coating with titanium of glutaraldehyde-fixed heart valve prostheses enables a reduced immune response and a self-seeding within circulation[G]//DANIEL E.Regenerative Medicine and Tissue Engineering-Cells and Biomaterials.Rijeka:InTech,2011.
[8]ZHAI W,CHANG J,LIN K,et al.Crosslinking of decellularized porcine heart valve matrix by procyanidins[J].Biomaterials,2006,27:3684-3690.
[9]ZHAI W,CHANG J,LÜX,et al.Procyanidins-crosslinked heart valve matrix:Anticalcification effect[J].J Biomed Mater Res B,2009,90B:913-921.
[10]FURIGA A,LONVAUD F,BADET C.In vitro study of antioxidant capacity and antibacterial activity on oral anaerobes of a grape seed extract[J].Food Chem,2009,113:1037-1040.
[11]SIVAKUMARAN S,MOLAN A L,MEAGHER L P,et al.Variation in antimicrobial action of proanthocyanidins from Dorycnium rectumagainst rumen bacteria[J].Phytochemistry,2004,65:2485-2497.
[12]SANO T,ODA E,YAMASHITA T,et al.Anti-thrombotic effect of proanthocyanidin,apurified ingredient of grape seed[J].Thromb Res,2005,115:115-121.
[13]LIU Y Z,CAO Y G,YE J Q,et al.Immunomodulatory effects of proanthocyanidin A-1derived in vitro from Rhododendron spiciferum[J].Fitoterapia,2010,81:108-114.
[14]JOHNSON C M,HANSON M N,HELGESON S C.Porcine cardiac valvular subendothelial cells in culture-cell isolation and growth-characteristics[J].J Mol Cell Cardiol,1987,19:1185-1193.
[15]BRODBECK W G,NAKAYAMA Y,MATSUDA T,et al.Biomaterial surface chemistry dictates adherent monocyte/macrophage cytokine expression in vitro[J].Cytokine,2002,18:311-319.
[16]李相仕.壳聚糖基生物材料与巨噬细胞相互作用研究[D].天津:天津大学,2007.
[17]BLAZSO G,GABOR M,ROHDEWALD P.Antiinflammatory activities of procyanidin-containing extracts from Pinus pinaster Ait after oral and cutaneous application[J].Pharmazie,1997,52:380-382.
[18]刘兴光,汪钢,俞世强,等.组织工程心脏瓣膜支架材料的血液相容性[J].中国临床康复,2004,8(30):6659-6661.
[19]ZHOU J Y,FRITZE O,SCHLEICHER M,et al.Impact of heart valve decellularization on 3-D ultrastructure,immunogenicity and thrombogenicity[J].Biomaterials,2010,31:2549-2554.
[20]OKAMURA K,CHIBA C,IRIYAMA T,et al.Antigen depressant effect of glutaraldehyde for aortic heterografts with a valve,with special reference to a concentration right fit for the preservation of grafts[J].Surgery,1980,87:170-176.
[21]SIMON P,KASIMIR M T,SEEBACHER G,et al.Early failure of the tissue engineered porcine heart valve SYNERGRAFT(TM)in pediatric patients[J].Eur J Cardio-Thorac Sur,2003,23:1002-1006.

